Химия | 5 — 9 классы
SnO2 + 2Ca = Sn + 2CaO 1)Определите элемент восстановитель 2) сколько электронов отдает атом данного элемента в ходе реакции.
SnO2 + 2Ca = Sn + 2CaO
Ca° — 2e = Ca⁺² восстановитель отдаёт 2 электрона
- Срочно, пожалуйста?
- Ознакомься с уравнением химической реакции, отображающим получение металла : PbO2 + C→Pb + CO2?
- Атом химического элемента имеет на 2 электрона больше чем катион Натрия?
- Атому какого химического элемента соответствует электронная формула 1s12s22p63s23p63d104s1?
- Атом элемента имеет на четыре электрона больше, чем ион Натрия?
- Ознакомься с уравнением химической реакции, описывающим получение металла : PbO + C→Pb + CO?
- 1. какая частица образуется если атом бария потеряет 2 электрона?
- Cr2O3 + 3Mg = 2Cr + 3MgО Определите какой элемент является восстановителем и сколько электронов отдает атом данного элемента в ходе реакции?
- Атом какого элемента содержит столько же электронов , сколько их в ионе Na +?
- Атом или ион отдающий электроны в ходе химической реакции — это?
- Ознакомься с уравнением химической реакции описывающим получение металла sno2 c sn co2
- Оксид олова IV
- Содержание
- Нахождение в природе
- Получение
- Физические свойства
- Химические свойства
- Применение
- Безопасность
- Оксид олова II
- Содержание
- Физические свойства
- Получение
- Химические свойства
- Применение
- Please wait.
- We are checking your browser. gomolog.ru
- Why do I have to complete a CAPTCHA?
- What can I do to prevent this in the future?
Видео:Решение задач на термохимические уравнения. 8 класс.Скачать

Срочно, пожалуйста?
Сколько неспаренных электронов имеет атом каждого из следующих элементов : Si, Mg, Fe, Tl?
Какое максимальное количество электронов могут отдать эти элементы при окислении?
Видео:Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Химия ПростоСкачать

Ознакомься с уравнением химической реакции, отображающим получение металла : PbO2 + C→Pb + CO2?
Ознакомься с уравнением химической реакции, отображающим получение металла : PbO2 + C→Pb + CO2.
1)Определи, какой химический элемент в данной реакции является окислителем.
Впиши знак этого элемента.
2) Сколько электронов принимает атом данного элемента в ходе реакции?
Впиши это число.
Видео:Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Атом химического элемента имеет на 2 электрона больше чем катион Натрия?
Атом химического элемента имеет на 2 электрона больше чем катион Натрия.
Видео:8 класс. ОВР. Окислительно-восстановительные реакции.Скачать

Атому какого химического элемента соответствует электронная формула 1s12s22p63s23p63d104s1?
Атому какого химического элемента соответствует электронная формула 1s12s22p63s23p63d104s1?
Какая валентность будет у этого элемента?
Видео:Как решать ОРГАНИЧЕСКИЕ ЦЕПОЧКИ? Основные типы химических реакцийСкачать

Атом элемента имеет на четыре электрона больше, чем ион Натрия?
Атом элемента имеет на четыре электрона больше, чем ион Натрия.
Назовите этот элемент, составьте электронную формулу атома.
Видео:Химия | Тепловой эффект химической реакции (энтальпия)Скачать

Ознакомься с уравнением химической реакции, описывающим получение металла : PbO + C→Pb + CO?
Ознакомься с уравнением химической реакции, описывающим получение металла : PbO + C→Pb + CO.
1)Определи, какой химический элемент в данной реакции является окислителем?
2)Сколько электронов принимает атом данного элемента в ходе реакции?
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

1. какая частица образуется если атом бария потеряет 2 электрона?
1. какая частица образуется если атом бария потеряет 2 электрона?
Напишите электронную формулу этой частицы?
2. атом элемента имеет на 2 электрона больше чем ион калия.
Назови элемент и сложи электронные формулы его атома и возможного иона.
3. атом элемента имеет на 6 электронов больше, чем ион натрия.
Назови элемент и составь электронную формулу его атома.
Видео:Химические Цепочки — Решение Цепочек Химических Превращений // Химия 8 классСкачать

Cr2O3 + 3Mg = 2Cr + 3MgО Определите какой элемент является восстановителем и сколько электронов отдает атом данного элемента в ходе реакции?
Cr2O3 + 3Mg = 2Cr + 3MgО Определите какой элемент является восстановителем и сколько электронов отдает атом данного элемента в ходе реакции.
Видео:ТИПОВЫЕ ЗАДАЧИ ПО ХИМИИ: Химическое Количество Вещества, Моль, Молярная Масса и Молярный ОбъемСкачать

Атом какого элемента содержит столько же электронов , сколько их в ионе Na +?
Атом какого элемента содержит столько же электронов , сколько их в ионе Na +.
Видео:Расстановка Коэффициентов в Химических Реакциях // Подготовка к ЕГЭ по ХимииСкачать

Атом или ион отдающий электроны в ходе химической реакции — это?
Атом или ион отдающий электроны в ходе химической реакции — это.
На странице вопроса SnO2 + 2Ca = Sn + 2CaO 1)Определите элемент восстановитель 2) сколько электронов отдает атом данного элемента в ходе реакции? из категории Химия вы найдете ответ для уровня учащихся 5 — 9 классов. Если полученный ответ не устраивает и нужно расшить круг поиска, используйте удобную поисковую систему сайта. Можно также ознакомиться с похожими вопросами и ответами других пользователей в этой же категории или создать новый вопрос. Возможно, вам будет полезной информация, оставленная пользователями в комментариях, где можно обсудить тему с помощью обратной связи.
8 класс химия решить 2и 3 по примеру 1го Сu(OH).
N = 30 * 10 ^ 23 (молекул) n = N / Na, гдеNa — число Авогадро = 6. 02 * 10 ^ 23 (молекул / моль) n = 30 * 10 ^ 23 / 6. 02 * 10 ^ 23 = 5 (моль) V = Vm * n, гдеVm — объем газа при н. У. = 22. 4 (л / моль) V = 22. 4 * 5 = 112 (л).
CH₄ + 2O₂ = CO₂ + 2H₂O V(CH₄) = 0, 1 м³ = 100 л по уравнению реакции при н. У. V(CO₂) = V(CH₄) V(CH₄) = 0, 1 м³ = 100 л.
H20 + CO2 / Na7 вроде бы так это делается , в химии не очень шарю.
2Zn + O2 — — >2ZnO ZnO + CaCl2 — — >ZnCl2 + CaO ZnO + 2KOH — — >K2ZnO2 + H2O.
N = 2. 2 (моль) M(CO2) = 12 + 2 * 16 = 44 (г / моль) m = n * M = 2. 2 * 44 = 96. 8 (г) V = Vm * n, Vm — объем газа при н. У. = 22, 4 (л / моль) V = 22. 4 * 2. 2 = 49. 28 (л).
Четыре сигма — связи, sp3 — гибридизация.
Магнитом отделяем железо. Оставшееся высыпаем в воду дерево всплывает. Методом выпаривания испоряем воду остаётся соль.
10FeSO4 + 2KMnO4 + 8H2SO4 = 5Fe2(SO4)3 + 2MnSO4 + K2SO4 + 8H2O Mn + 7 о — ль, Fe + 2 в — ль.
Я на пишу кратко Na2 O = 23 * 2 + 16 = 62 а. Е. м = 0, 741 = 0, 258 C2H6 = 12 * 2 + 6 = 30 а. Е. м = 0, 8 = 0, 2 Fe2O3 = 55 * 2 + 16 * 3 = 158 a. E. m.
Видео:Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Ознакомься с уравнением химической реакции описывающим получение металла sno2 c sn co2
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Оксид олова IV
| Оксид олова IV | |
|---|---|
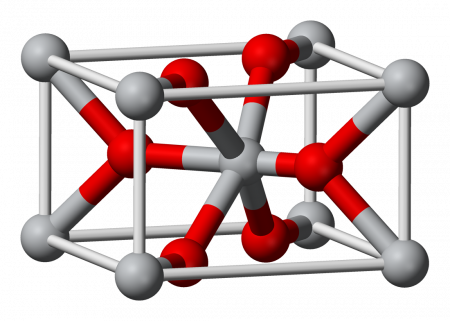 | |
| Систематическое наименование | Оксид олова IV |
| Традиционные названия | Окись олова, двуокись олова, диоксид олова, касситерит |
| Хим. формула | SnO2 |
| Рац. формула | SnO2 |
| Состояние | белые кристаллы |
| Молярная масса | 150,71 г/моль |
| Плотность | 7,0096 г/см 3 |
| Температура | |
| • плавления | 1630 °C |
| • кипения | 2500 (разл.) °C |
| • разложения | − |
| Мол. теплоёмк. | 53,2 Дж/(моль·К) |
| Энтальпия | |
| • образования | −577,63 кДж/моль |
| Давление пара | 0 ± 1 мм рт.ст. |
| Растворимость | |
| • в воде | нерастворим |
| Показатель преломления | 2,006 (D-линия натрия 589,29 нм ) |
| Кристаллическая структура | гексагональная типа рутила |
| Рег. номер CAS | 18282-10-5 |
| PubChem | 29011 |
| Рег. номер EINECS | 242-159-0 |
| SMILES | |
| RTECS | XQ4000000 |
| ChEBI | 52991 |
| ChemSpider | 26988 |
| ЛД50 | крысы, перорально 20 г/кг |
| Токсичность | низкая |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Оксид олова IV (диоксид олова, двуокись олова) — бинарное неорганическое соединение, оксид металла олова с формулой SnO2. Белые кристаллы, нерастворимые в воде.
Видео:Решение цепочек превращений по химииСкачать

Содержание
Видео:Расчеты по уравнениям химических реакций. 1 часть. 8 класс.Скачать

Нахождение в природе
В природе встречается минерал касситерит — SnO2, основная руда олова, который в чистом виде бесцветен, однако примеси придают ему самые различные цвета.
Видео:Термохимические реакции. Практическая часть - решение задачи. 9 класс.Скачать

Получение
Сжигание олова в воздухе или в кислороде при высокой температуре:
Окисление кислородом воздуха монооксида олова:
Диспропорционирование при нагревании монооксида олова:
2 SnO → 400oC SnO2 + Sn
Окисление олова горячей концентрированной азотной кислотой:
Разложение сульфата олова при нагревании:
или взаимодействием сульфата олова с разбавленной щёлочью:
Прокаливание на воздухе моносульфида олова:
Видео:Проклятая химическая реакция 😜 #shortsСкачать

Физические свойства
Оксид олова IV из раствора при осаждении выделяется в виде гидрата переменного состава SnO2· n H2O, где 1 ≤ n ≤ 2 , так называемая α -модификация). При стоянии осадка переходит химически пассивную β -модификацию ( n ≤ 1 ). Соединения со стехиометрическим составом гидратов не выделены.
В воде практически нерастворим, р ПР = 57,32. Нерастворим также в этаноле и других не взаимодействующих с веществом растворителях.
При высушивании гидрата диоксида олова образуется аморфный белый порошок с плотностью 7,036 г/см³ , переходящий при нагревании в кристаллическую модификацию с плотностью 6,95 г/см³ .
Оксид олова IV образует прозрачные бесцветные кристаллы тетрагональной сингонии, пространственная группа P 42/mnm, параметры ячейки a = 0,4718 нм , c = 0,3161 нм , Z = 2 , — кристаллическая структура типа рутила (диоксида титана).
Молярная энтропия S o
298 = 49,01 Дж/(моль·К) . Теплоёмкость C o
p = 53,2 Дж/(моль·К) . Стандартная энтальпия образования ΔH o
обр = −577,63 кДж/моль .
Является широкозонным полупроводником n -типа, при 300 К ширина запрещённой зоны 3,6 эВ , подвижность электронов 7 см 2 /(В·с) , концентрация носителей 3,5·10 14 см −3 , удельное электрическое сопротивление 3,4·10 3 Ом·см . Легирование элементами V группы, например, сурьмой увеличивает электрическую проводимость на 3—5 порядков.
Диамагнитен. Молярная магнитная восприимчивость χmol = −4,1·10 −5 моль −1 .
Диоксид олова прозрачен в видимом свете, отражает инфракрасное излучение с длиной волны более 2000 нм.
Температура плавления 1630 °C. При высокой температуре испаряется с разложением на монооксид олова (и его ди-, три- и тетрамеры) и кислород.
Видео:Расстановка коэффициентов в химических реакциях: как просто это сделатьСкачать

Химические свойства
Гидратированная форма переходит в кристаллическую при нагревании:
Растворяется в концентрированных кислотах:
При нагревании растворяется в разбавленных кислотах:
Растворяется в растворах концентрированных щелочей:
При сплавлении с щелочами и карбонатами образует метастаннаты:
а с оксидами щелочных металлов образует ортостаннаты:
- Восстанавливается водородом или углеродом до металлического олова:
SnO2 + 2 H2 → 500−600oC Sn + 2 H2O SnO2 + 2 C → 800−900oC Sn + 2 CO
Видео:Задачи на ТЕПЛОВОЙ ЭФФЕКТ | Термохимические уравненияСкачать

Применение
В сочетании с оксидами ванадия его используют в качестве катализатора для окисления ароматических соединений в синтезе карбоновых кислот и ангидридов кислот, катализатора реакций замещения и гидролиза.
В датчиках газообразных горючих газов.
Плёнки из диоксида олова, нанесённые на стекло или керамику применяются в датчиках горючих газов в воздухе — метана, пропана, оксида углерода и других горючих газов. Нагретый до температуры в несколько сотен градусов Цельсия материал в присутствии горючих газов обратимо частично восстанавливается с изменением стехиометрического соотношения в сторону обеднения кислородом, что приводит к снижению электрического сопротивления плёнки. Для применения в датчиках газа изучалось легирование диоксида олова различными соединениями, например, оксидом меди II.
В электронной промышленности
Основное применение соединения для создания прозрачных токопроводящих плёнок в различных приборах — жидкокристаллических дисплеях, фотогальванических элементах и в других приборах. Нанесение плёнки вещества производится из газовой фазы разложением летучих соединений олова, для повышения электропроводности соединение обычно легируют сурьмой и соединениями фтора.
Также применяется для создания прозрачных проводящих обогревательных противообледенительных плёнок на стеклянной поверхности окон транспортных средств.
Применяется в материалах контактов электрических коммутационных аппаратов, например, серебряных контактов электромагнитных реле — в материал вводят 2—14 % диоксида олова. Ранее для этой цели использовали весьма токсичный оксид кадмия.
Легирование кобальтом и марганцем дает материал, который можно использовать, например, в высоковольтных варисторах.
Легирование диоксида олова оксидами железа или марганца образует высокотемпературный ферромагнитный материал.
В стекольной и керамической промышленности в качестве белого пигмента
Диоксид олова плохо растворяется в расплавленной силикатной или боросиликатной стекломассе и имеет высокий показатель преломления относительно силикатного связующего, поэтому его микрочастицы в составе стёкол рассеивают свет, придавая стеклянной массе молочно-белый цвет и используется в производстве матовых стёкол, глазурованной керамической настенной плитке, сантехнических фаянсовых изделиях и др.
Изменяя состав стекломассы и технологию её приготовления можно изменять степень матовости продукта, так как растворимость диоксида олова увеличивается при повышении температуры обжига и увеличении концентрации в стекломассе оксидов щелочных металлов ( Na2O , K2O ) и оксида бора B2O3 и снижается при увеличении содержания оксидов щелочноземельных металлов ( CaO , BaO ), оксидов алюминия, цинка и свинца. Чистый диоксид олова придаёт глазури белый цвет, который можно изменить добавлением оксидов других элементов, например, оксид ванадия придаёт глазури жёлтый цвет, хрома — розовый, сурьмы — серовато-синий.
Покрытия на стекле
Тончайшие плёнки диоксида олова (
0,1 мкм) применяются в качестве адгезионного подслоя для нанесения на поверхность стеклянной посуды (в основном на бутылках, банках, сортовой посуде) полимерного покрытия, например, полиэтиленового. Нанесение таких тонких плёнок производится разложением на поверхности горячего стеклянного изделия летучих соединений олова, например, тетрахлорида олова или оловоорганических соединений, например, трихлорида бутилолова.
В качестве абразивного материала
Микрокристаллы соединения имеют высокую твёрдость и применяется в составе полировальных паст и суспензий для полировки изделий их металлов, стекла, керамики, природных камней.
Видео:Химические уравнения - Как составлять уравнения реакций // Составление Уравнений Химических РеакцийСкачать

Безопасность
Соединение малотоксично, ЛД50 для крыс 20 г/кг перорально. Пыль соединения вредно влияет на органы дыхания. Предельно допустимая концентрация пыли в воздухе производственных помещений 2 мг/м 3 .
Видео:Установление эмпирической и молек. формул по массовым долям элем., входящих в состав в-ва. 10 класс.Скачать

Оксид олова II
| Оксид олова II | |
|---|---|
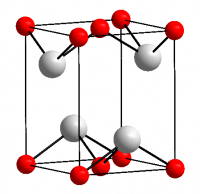 | |
| Систематическое наименование | оксид оловаII |
| Традиционные названия | монооксид олова; олово окись II, олово закись, олово одноокись |
| Хим. формула | SnO |
| Состояние | чёрный порошок |
| Молярная масса | 134.71 г/моль |
| Плотность | 6.45 г/см³ |
| Температура | |
| • плавления | (при 80 кПа) 1080 °C |
| • кипения | 1425 °C |
| • разложения | 1976 ± 1 °F [1] |
| • вспышки | негорюч °C |
| Мол. теплоёмк. | 47,8 Дж/(моль·К) |
| Теплопроводность | 47,8 Вт/(м·K) |
| Энтальпия | |
| • образования | -285,98 кДж/моль |
| Давление пара | 0 ± 1 мм рт.ст. [1] |
| Растворимость | |
| • в воде | нерастворим |
| Кристаллическая структура | тетрагональная |
| Рег. номер CAS | 21651-19-4 |
| PubChem | 88989 |
| Рег. номер EINECS | 244-499-5 |
| SMILES | |
| RTECS | XQ3700000 |
| ChemSpider | 80298 |
| Токсичность | при вдыхании вызывает кашель |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Оксид олова II — неорганическое бинарное химическое соединение олова и кислорода, химическая формула SnO, черно-синие кристаллы (по другим данным коричневато-чёрные).
Содержание
Физические свойства
Темно-синие (почти чёрные) кристаллы, тетрагональная сингония, структура типа РbО (а = 0,3802 нм, с = 0,4837 нм, Z = 2, пространственная группа P42/nmm). При давлении выше 90 ГПа (900 тыс. атм) переходит в ромбическую модификацию (а = 0,382 нм, b = 0,361 нм, с = 0,430 нм, Z = 2, пространственная группа Рm2n).
Оксид олова является полупроводником, тип проводимости которого зависит от примесей и способа получения.
Получение
Оксид олова получают осторожным разложением в инертной атмосфере гидроокиси олова:
Из диоксида олова:
SnO2 + Sn → 1000oC 2 SnO
В лабораторных условиях оксид олова часто получают осторожным нагревом оксалата олова(II) в инертной атмосфере:
С помощью твёрдотельной реакции из хлорида олова II:
Химические свойства
Оксид олова II устойчив на воздухе, амфотерен с преобладанием основных свойств. Мало растворим в воде и разбавленных растворах щелочей. Растворяется в разбавленных кислотах:
и концентрированных кислотах:
Он также растворяется в сильных кислотах, давая ионные комплексы, например Sn(OH2)3 2+ или Sn(OH)(OH2) 2+ , также в менее кислотных растворах — Sn3(OH)4 2+ .
Растворяется в концентрированных растворах щелочей и их расплавах:
SnO + NaOH + H2O ⇄ 20oC Na[Sn(OH)3] SnO + 2 NaOH → 400oC Na2SnO2 + H2O
Также известны другие безводные оловосодержащие соединения, например, K2Sn2O3, K2SnO2.
Диспропорционирует при нагревании:
2 SnO → 400oC SnO2 + Sn
Окисляется кислородом воздуха:
Восстанавливается до металлического олова водородом, углеродом, кремнием, бором и парами этилового спирта:
Sn и O могут образовывать соединения нестехиометрического состава.
Применение
Оксид олова II в подавляющем большинстве случаев используется в качестве исходного продукта в производстве других, как правило, двухвалентных, соединений олова. Может применяться также в качестве восстановителя и в создании рубинового стекла. В незначительных количествах используется в качестве этерификаторного катализатора.
Оксид церия III с оксидом олова II используется в осветительных приборах как люминофор.
Please wait.
We are checking your browser. gomolog.ru
Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 701dbc1aab170095 • Your IP : 87.119.247.227 • Performance & security by Cloudflare











