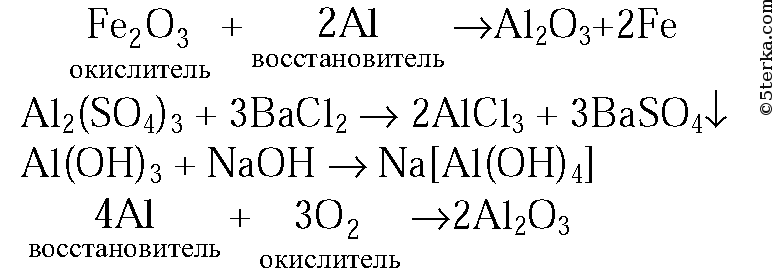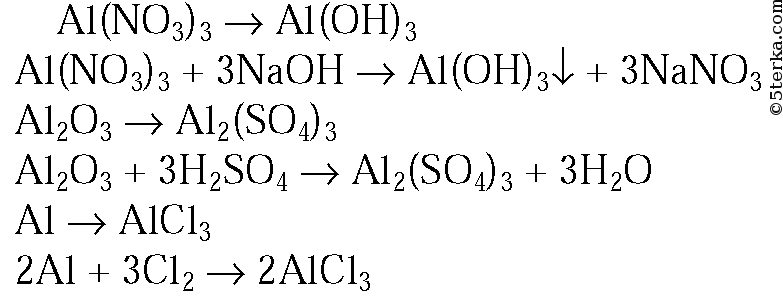Оксид железа (III)
Оксид железа (III) – это твердое, нерастворимое в воде вещество красно-коричневого цвета.
Способы получения
Оксид железа (III) можно получить различными методами :
1. Окисление оксида железа (II) кислородом.
2. Разложение гидроксида железа (III) при нагревании :
Химические свойства
Оксид железа (III) – амфотерный .
1. При взаимодействии оксида железа (III) с кислотными оксидами и кислотами образуются соли.
Например , оксид железа (III) взаимодействует с азотной кислотой:
2. Оксид железа (III) взаимодействует с щелочами и основными оксидами. Реакция протекает в расплаве, при этом образуется соответствующая соль (феррит) .
Например , оксид железа (III) взаимодействует с гидроксидом натрия:
3. Оксид железа (III) не взаимодействует с водой.
4. Оксид железа (III) окисляется сильными окислителями до соединений железа (VI).
Например , хлорат калия в щелочной среде окисляет оксид железа (III) до феррата:
Нитраты и нитриты в щелочной среде также окисляют оксид железа (III):
5. Оксид железа (III) проявляет окислительные свойства . Но есть интересный нюанс — при восстановлении оксида железа (III), как правило, образуется смесь продуктов: это может быть оксид железа (II), просто вещество железо, или железная окалина Fe3O4. Но в реакции мы записываем при этом только один продукт. А вот какой именно это будет продукт, зависит от условий реакции. Как правило, в экзаменах по химии нам даются указания на возможный продукт (цвет образовавшегося вещества или дальнейшие характерные реакции).
Например , оксид железа (III) реагирует с угарным газом при нагревании. При этом возможно восстановление как до простого железа, так и до оксида железа (II) или железной окалины:
При восстановлении оксида железа (III) водородом также возможно образование различных продуктов, например, простого железа:
Железом можно восстановить оксид железа только до оксида железа (II):
Оксид железа (III) реагирует с более активными металлами .
Например , с алюминием (алюмотермия):
Оксид железа (III) реагирует также с некоторыми другими сильными восстановителями.
Например , с гидридом натрия:
Fe2O3 + 3NaH → 3NaOH + 2Fe
6. Оксид железа (III) – твердый, нелетучий и амфотерный. А следовательно, он вытесняет более летучие оксиды (как правило, углекислый газ) из солей при сплавлении.
Например , из карбоната натрия:
Видео:Получение и превращения гидроксидов железа Fe(OH)2 и Fe(OH)3Скачать

Please wait.
Видео:Химия | Тепловой эффект химической реакции (энтальпия)Скачать

We are checking your browser. gomolog.ru
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
Видео:Химия 11 класс (Урок№10 - Общая характеристика и способы получения металлов.)Скачать

What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 701e1e7b298bc863 • Your IP : 87.119.247.227 • Performance & security by Cloudflare
Видео:Расчеты по уравнениям химических реакций. 1 часть. 8 класс.Скачать

Вариант 2
Видео:Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Вопросы:
1. Допишите уравнения химических реакций: а) Fe2O3 + Al → в) Al(ОН)3 + NaOH → б) Al2(SO4)3 + ВаС12 → г) Al + O2 →
В окислительно-восстановительных реакциях укажите окислитель и восстановитель.
2. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
3. Опишите области применения алюминия и укажите свойства, на которых оно основано.
Видео:Химия | Cкорость химической реакцииСкачать

Ответы и решения:
3. Алюминий применяется в самолетостроении, для изготовления проводов, в металлургии, при этом используются его легкость, высокая электропроводность и восстановительная способность.

задача №2
к главе «Тема V. Общие свойства металлов. Работа 5. Алюминий и его соединения».
🔍 Видео
Identify the reducing agent in the following reactions (c) Fe2O3 + 3CO → 2Fe + 3CO2Скачать

25. Схема реакции и химическое уравнениеСкачать

Реакции металлов с кислородом и водой. 8 класс.Скачать

3. КАК МЕТАЛЛЫ РЕАГИРУЮТ С ОСНОВАНИЯМИ/ Нужно знать/ ЕГЭ химия 2020Скачать

Fe2O3+3CO --2Fe+3CO2 redox reaction,in Tamil, Oxidation number#chemistrybyvalliСкачать

Химия 11 класс: Классификация химических реакцийСкачать

РЕАКЦИЯ ЭТЕРИФИКАЦИИСкачать

Экзо- и эндотермические реакции. Тепловой эффект химических реакций. 8 класс.Скачать

4. Химическая реакция и ее признакиСкачать

Самые красивые химические реакции - образование Сu(OH)₂Скачать

Как выучить Химию с нуля за 10 минут? Принцип Ле-ШательеСкачать

Тип реакции Al + Fe2O3 = Al2O3 + FeСкачать

Как отличить реакции обмена от реакций замещенияСкачать