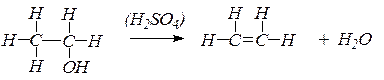В сухую пробирку помещают несколько крупинок песка, 2 капли этилового спирта и 4 капли концентрированной серной кислоты. Закрывают пробирку пробкой с газоотводной трубкой и осторожно нагревают смесь на пламени горелки. Выделяющийся газ поджигают у конца газоотводной трубки — он горит светящимся пламенем.
CНз-СН2ОН + НОSОзН 
Этилсерная кислота — моноэфир неорганической двухосновной кислоты — при нагревании разлагается:
СНз-СН2-OSOзН 
Таким образом, при взаимодействии этилового спирта с серной кислотой происходит дегидратация спирта:
Выделяющийся этилен горит светящимся пламенем:
C2H4 + ЗO2 
Концентрированная серная кислота является окислителем. При нагревании смеси спирта с концентрированной серной кислотой образуется, кроме этилена и следов диэтилового эфира (СзН5)2О, ряд продуктов окисления органических соединений, например СО2, уголь С (обычно смесь в пробирке чернеет). Серная кислота при этом восстанавливается углеродом до сернистого ангидрида:
2H2SO4 + С 
Сернистый ангидрид также может обесцвечивать растворы брома и марганцевокислого калия подобно этилену. Поэтому образующийся этилен промывают раствором щелочи для очистки от SO2. Если реакцию вести в присутствии песка, сульфата алюминия (катализаторы, ускоряющие дегидратацию спирта), почернения смеси не происходит, следовательно, сернистый ангидрид не образуется.
Дегидратация спиртов является общим способом получения непредельных углеводородов.
Присоединение к этилену брома
Не прекращая нагревания пробирки со смесью спирта и серной кислоты (см. опыт 1), опускают конец газоотводной трубки в пробирку с 5 каплями бромной воды. Бромная вода быстро обесцвечивается вследствие присоединения атомов брома по месту двойной связи.
СН2=СН2 + Вг2 
Для алкенов характерны реакции присоединения по месту двойной связи.
Реакция обесцвечивания водного раствора брома служит качественной реакцией на двойную связь.
Отношение этилена к окислителям
Не прекращая нагревания пробирки со смесью спирта и серной кислоты (см. опыт 3.2.1), опускают конец газоотводной трубки в пробирку с 1 каплей раствора марганцевокислого калия и 4 каплями воды. Раствор марганцевокислого калия быстро обесцвечивается. При этом алкен окисляется в двухатомный спирт. Химизм процесса:
СН2=СН2 + [О] + Н-ОН 
Эта реакция является качественной реакцией на двойную связь.
Видео:Окисление органических соединений перманганатом калияСкачать

ПОЛУЧЕНИЕ ЭТИЛЕНА И АЦЕТИЛЕНА
И ИЗУЧЕНИЕ ИХ СВОЙСТВ
Теоретическая часть
Алкенами называются ненасыщенные углеводороды, молекулы которых содержат одну двойную связь. Простейшим представителем алкенов является этилен СН2=СН2.
Этилен — бесцветный газ, почти без запаха, немного легче воздуха, плохо растворим в воде.
1. Этилен в лаборатории получают при нагревании смеси этилового спирта с концентрированной серной кислотой:
2. Углеводороды ряда этилена можно получить также дегидрированием предельных углеводородов:
3. На производстве этилен получают из природного газа и при процессах пиролиза нефти.
4. Углеводороды ряда этилена можно получить при взаимодействии дигалогенопроизводных предельных углеводородов с металлами:
5. При действии спиртовых растворов щелочей на галогенопроизводные отщепляется галогеноводород и образуется углеводород с двойной связью:
Химические свойства этилена и его гомологов в основном определяются наличием в их молекулах двойной связи. Для них характерны реакции присоединения, окисления и полимеризации.
1. Реакции присоединения.
o Этилен и его гомологи взаимодействуют с галогенами. Так, например, они обесцвечивают бромную воду:
H2C = CH2 + Br2 → CН2Br — CH2Br
o Аналогично происходит присоединение водорода (гидрирование этилена и его гомологов):
o В присутствии серной или ортофосфорной кислоты и других катализаторов этилен присоединяет воду (реакция гидратации). Этой реакцией пользуются для получения этилового спирта в промышленности:
o Этилен и его гомологи присоединяют также галогеноводороды. Пропилен и последующие углеводороды ряда этилена реагируют с галогеноводородами согласно правилу В.В.Марковникова.
Водород присоединяется к наиболее, а атом галогена — к наименее гидрированному атому углерода:
H2C = CH2 + НBr → CН3 – CH2Br
2. Реакции окисления.
o Этилен и его гомологи способны гореть на воздухе. С воздухом этилен и его газообразные гомологи образуют взрывчатые смеси:
o Этилен и его гомологи легко окисляются, например кислородом перманганата калия; при этом раствор последнего обесцвечивается:
3. Реакции полимеризации.
При повышенной температуре, давлении и в присутствии катализаторов молекулы этилена соединяются друг с другом вследствие развала двойной связи:

Процесс соединения многих одинаковых молекул в более крупные называется реакцией полимеризации.
Алкинами называются ненасыщенные углеводороды, молекулы которых содержат одну тройную связь. Простейшим представителем алкинов является этин (ацетилен) СН≡СН.
Алкины по своим физическим свойствам напоминают соответствующие алкены. Низшие (до С4) — газы без цвета и запаха, имеющие более высокие температуры кипения, чем аналоги в алкенах. Алкины плохо растворимы в воде, лучше — в органических растворителях. Плохо растворимы в воде.
Способы получения алкинов.
1. Пиролиз метана.
2. Карбидный способ.
а) СаО + 3С → СаС2 + СО
3. Дегидрогалогенирование дигалойдных углеводородов спиртовыми растворами щелочей.
СН3 – СН(Вr) – СН2Br + 2КОН → СН3 – С ≡ СН + 2КВr + 2Н2О
4. Каталитическое дегидрирование этиленовых углеводородов.
1. Реакции присоединения.
a. Ацетилен и его гомологи взаимодействуют с галогенами. Так, например, они обесцвечивают бромную воду:
HC ≡ CH + 2Br2 → CНBr2 — CHBr2
b. Аналогично происходит присоединение водорода (гидрирование этина и его гомологов):
c. Этин и его гомологи присоединяют также галогеноводороды. Пропин и последующие углеводороды ряда этина реагируют с галогеноводородами согласно правилу В.В.Марковникова.
Водород присоединяется к наиболее, а атом галогена — к наименее гидрированному атому углерода:
C2H2 + 2НBr → C2H4Br2
2. Реакции окисления.
a. Этин и его гомологи способны гореть на воздухе. С воздухом этин и его газообразные гомологи горят бледно-голубым пламенем:
b. Этилен и его гомологи легко окисляются, например кислородом перманганата калия; при этом раствор последнего обесцвечивается:
Экспериментальная часть
ЦЕЛЬ РАБОТЫ: получить и изучить свойства этилена и ацетилена.
ОБОРУДОВАНИЕ И РЕАКТИВЫ: штатив с пробирками, пробка с газоотводной трубкой, спиртовка, держатель для пробирок, этиловый спирт, концентрированная серная кислота, бромная вода, раствор перманганата калия, карбид кальция.
ОПЫТ 1. ПОЛУЧЕНИЕ ЭТИЛЕНА И ЕГО ГОРЕНИЕ.
В пробирку налейте 2-3 мл этилового спирта и осторожно добавьте 6-9 мл концентрированной серной кислоты и несколько крупинок песка. Закройте пробирку пробкой с газоотводной трубкой, закрепите ее в штативе и осторожно нагрейте. Подожгите выделяющийся газ.
Какой газ выделяется при нагревании смеси этилового спирта с серной кислотой? Почему этилен горит более светящимся пламенем, чем метан? Напишите уравнение реакции.
ОПЫТ 2. ВЗАИМОДЕЙСТВИЕ ЭТИЛЕНА С БРОМНОЙ ВОДОЙ.
В другую пробирку налейте 2-3 мл бромной воды. Не прекращая нагревания пробирки со смесью спирта и серной кислоты, опустите конец газоотводной трубки в пробирку с бромной водой и пропустите через нее выделяющийся газ.
Что происходит при пропускании газа через бромную воду? Напишите уравнение реакции.
ОПЫТ 3. ОТНОШЕНИЕ ЭТИЛЕНА К ОКИСЛИТЕЛЯМ.
В третью пробирку налейте 2-3 мл разбавленного раствора перманганата калия. Не прекращая нагревания пробирки со смесью спирта и серной кислоты, опустите конец газоотводной трубки в пробирку с раствором перманганата калия и пропустите через нее выделяющийся газ.
Что происходит при пропускании газа через раствор перманганата калия? Напишите уравнение реакции.
ОПЫТ 4. ПОЛУЧЕНИЕ АЦЕТИЛЕНА И ЕГО ГОРЕНИЕ.
В пробирку поместите маленький кусочек карбида кальция и добавьте 2 капли воды. Закройте пробирку пробкой с газоотводной трубкой. Подожгите выделяющийся газ.
Какой газ выделяется? Почему ацетилен горит более светящимся пламенем, чем метан? Напишите уравнение реакции.
ОПЫТ 5. ВЗАИМОДЕЙСТВИЕ АЦЕТИЛЕНА С БРОМНОЙ ВОДОЙ.
В другую пробирку налейте 2-3 мл бромной воды. В пробирку с карбидом кальция добавьте еще 2 капли воды и закройте ее пробкой с газоотводной трубкой. Опустите конец газоотводной трубки в пробирку с бромной водой и пропустите через нее выделяющийся газ.
Что происходит при пропускании газа через бромную воду? Напишите уравнение реакции.
ОПЫТ 6. ОТНОШЕНИЕ АЦЕТИЛЕНА К ОКИСЛИТЕЛЯМ.
В третью пробирку налейте 2-3 мл разбавленного раствора перманганата калия. В пробирку с карбидом кальция добавьте еще 2 капли воды и закройте ее пробкой с газоотводной трубкой. Опустите конец газоотводной трубки в пробирку с бромной водой и пропустите через нее выделяющийся газ.
Что происходит при пропускании газа через раствор перманганата калия? Напишите уравнение реакции.
Задания.
1. Какие углеводороды называются непредельными?
2. Какие углеводороды называются алкенами и алкинами?
4. Какие типы химических реакций характерны для непредельных углеводородов? Приведите примеры.
5. Какие реакции являются качественными реакциями на непредельные углеводороды?
ЛАБОРАТОРНАЯ РАБОТА № 12
СПИРТЫ
Теоретическая часть
Одноатомные спирты – это производные углеводородов, в которых один атом водорода замещен на гидрокси- группу. Общая формула спиртов – CnH2n+1OH.
Низшие и средние члены ряда предельных одноатомных спиртов, содержащие от одного до одиннадцати атомов углерода, — жидкости. Высшие спирты (начиная с С12Н25ОН) при комнатной температуре — твёрдые вещества. Низшие спирты имеют характерный алкогольный запах и жгучий вкус, хорошо растворимы в воде. По мере увеличения углеводородного радикала растворимость спиртов в воде понижается, например октанол уже не смешивается с водой.
1. Самый общий способ получения спиртов, имеющий промышленное значение, — гидратация алкенов. Реакция идет при пропускании алкена с парами воды над фосфорнокислым катализатором:
Из этилена получается этиловый спирт, из пропена — изопропиловый. Присоединение воды идет по правилу Марковникова, поэтому из первичных спиртов по данной реакции можно получить только этиловый спирт.
2. Другой общий способ получения спиртов — гидролиз алкилгалогенидов под действием водных растворов щелочей:
R—Br + NaOH → R—OH + NaBr.
По этой реакции можно получать первичные, вторичные и третичные спирты.
3. Восстановление карбонильных соединений. При восстановлении альдегидов образуются первичный спирты, при восстановлении кетонов — вторичные:
Реакцию проводят, пропуская смесь паров альдегида или кетона и водорода над никелевым катализатором.
5. Этанол получают при спиртовом брожении глюкозы:
Химические свойства спиртов определяются присутствием в их молекулах гидроксильной группы ОН. Связи С-О и О-Н сильно полярны и способны к разрыву. Различают два основных типа реакций спиртов с участием функциональной группы -ОН:
1) Реакции с разрывом связи О-Н: а) взаимодействие спиртов с щелочными и щелочноземельными металлами с образованием алкоголятов; б) реакции спиртов с органическими и минеральными кислотами с образованием сложных эфиров; в) окисление спиртов под действием дихромата или перманганата калия до карбонильных соединений. Скорость реакций, при которых разрывается связь О-Н, уменьшается в ряду: первичные спирты > вторичные > третичные.
2) Реакции сопровождающиеся разрывом связи С-О: а) каталитическая дегидратация с образованием алкенов (внутримолекулярная дегидратация) или простых эфиров (межмолекулярная дегидратация): б) замещение группы -ОН галогеном, например при действии галогеноводородов с образованием алкилгалогенидов. Скорость реакций, при которых разрывается связь С-О, уменьшается в ряду: третичные спирты > вторичные > первичные.
Спирты являются амфотерными соединениями.
Реакции с разрывом связи О-Н.
1. Кислотные свойства спиртов выражены очень слабо. Низшие спирты бурно реагируют со щелочными металлами:
но не реагируют с щелочами. С увеличением длины углеводородного радикала скорость этой реакции замедляется.
В присутствии следов влаги соли спиртов (алкоголяты) разлагаются до исходных спиртов:
Это доказывает, что спирты — более слабые кислоты, чем вода.
2. При действии на спирты минеральных и органических кислот образуются сложные эфиры. Образование сложных эфиров протекает по механизму нуклеофильного присоединения-отщепления:
Отличительной особенностью первой из этих реакций является то, что атом водорода отщепляется от спирта, а группа ОН — от кислоты. (Установлено экспериментально методом «меченых атомов» ).
3. Спирты окисляются под действием дихромата или перманганата калия до карбонильных соединений. Первичные спирты окисляются в альдегиды, которые, в свою очередь, могут окисляться в карбоновые кислоты:
Вторичные спирты окисляются в кетоны. Третичные спирты могут окисляться только с разрывом С-С связей.
Реакции с разрывом связи С-О.
1) Реакции дегидратации протекают при нагревании спиртов с водоотнимающими веществами. При сильном нагревании происходит внутримолекулярная дегидратация с образованием алкенов:
При более слабом нагревании происходит межмолекулярная дегидратация с образованием простых эфиров:
Видео:Реакция этилена с раствором перманганата калияСкачать

Свойства органических соединений (стр. 3 )
 | Из за большого объема этот материал размещен на нескольких страницах: 1 2 3 4 5 6 7 8 9 10 11 12 13 14 |
В школе, при изучении свойств углеводородов, более подробно рассматриваются свойства метана, этилена, ацетилена и бензола.
Учитель заранее готовит к уроку запас посуды и реактивов. Вследствие того, что метан, этилен и ацетилен являются газообразными веществами и опыты с ними проводятся в момент получения, времени для обсуждения каждого свойства после его демонстрации не остается. Поэтому необходимо подготовить учащихся к восприятию всех опытов, быстро провести эти опыты, затем записать соответствующие наблюдения, уравнения реакций и выводы. Такую подготовку учащихся целесообразно провести, зарисовав предварительно на доске таблицу в соответствии с названием того вещества, которое изучается на данном уроке.
Свойства метана (этилена, ацетилена, бензола)
Взаимодействие с окислителями
Взаимодействие с галогенами (aq)
Опыты 1-11. Получение и свойства метана. Свойства гомологов метана. а) В ступке перемешайте смесь обезвоженного ацетата натрия и натронной извести (смеси твердого гидроксида натрия с оксидом кальция) в объемном отношении 1:3. Вместо натронной извести с таким же успехом можно взять перемешанную в ступке смесь из равных объёмов обезвоженного ацетата натрия, гидроксида натрия и карбоната кальция (мела). Полученной смесью заполните большую сухую пробирку на 1/4 часть. Пробирку закройте пробкой с газоотводной трубкой с оттянутым концом, в которую поместите медную спираль и закрепите её в лапке штатива, с небольшим наклоном в сторону пробки (рис. 41).
Рис. 41. Установка для получения метана.
Непосредственно перед получением метана приготовьте 4 стакана объемом 50 мл. Налейте в них, соответственно, 30 мл чистой воды, 30 мл разбавленного раствора перманганата калия (светло-розовый цвет), 30 мл иодной воды (соломенно-желтый цвет), 10 мл пенообразующего раствора (раствор мыла, шампуня, стирального порошка) для пробы на взрывоопасность.
б) Для начала реакции получения метана равномерно прогрейте всю пробирку, а затем сильно нагревайте ту ее часть, где находится основная часть смеси. Сначала из пробирки будет вытесняться воздух, затем начнёт выделяться метан:
CH3COONa + NaOH 
Физические свойства метана. Пропускайте метан с помощью газоотводной трубки, через чистую воду. Наблюдаются пузырьки бесцветного газа – метана. Обычно метан собирают по способу вытеснения воды, что дает ученикам основание предположить, что этот газ нерастворим в воде. Учитель подтверждает это заключение. Доказать, что метан легче воздуха быстрее и нагляднее всего путем наполнения этим газом уравновешенной на весах вверх дном колбы, как это показано на рис. 42.
Рис. 42. Доказательство относительной легкости метана.
Отношение метана к водному раствору перманганата калия и иодной воде. Газоотводную трубку введите в стаканчик с раствором перманганата калия и пропускайте метан в течение нескольких секунд. Затем ту же процедуру проведите с иодной водой. Примечание. В связи с тем, что в числе побочных продуктов реакции получения метана могут быть непредельные углеводороды, не следует слишком долго проводить эти опыты. Растворы не изменяют своей окраски, что свидетельствует о том, что метан при комнатной температуре не взаимодействует с водным раствором перманганата калия и иодной водой.
Проба на взрывоопасность (проверка метана на чистоту). Опустите газоотводную трубку в пенообразующий раствор, так чтобы выделяющийся газ образовал пену. Когда стакан наполнится пеной, уберите газоотводную трубку и поднесите к пене горящую лучинку. Наблюдается воспламенение и быстрое сгорание метана. Если вспышка сопровождается резким звуком, то значит выделяющийся из прибора метан содержит примеси кислорода воздуха. В этом случае поджигать газ у газоотводной трубки опасно. Поэтому проверку на чистоту нужно повторить через некоторое время еще раз. Только чистый метан (как и водород), без примеси воздуха можно поджигать в ходе эксперимента.
Горение метана в воздухе. Подожгите метан у конца газоотводной трубки, он загорится несветящимся голубоватым пламенем:
СН4 + 2О2 → СО2 + 2Н2О.
Если внести в пламя метана фарфоровую чашку, то чёрного пятна от сажи на ней не образуется. Цвет пламени становится оранжевым из-за присутствия ионов натрия в стекле, из которого изготовлена трубка.
Горение метана в хлоре. Заранее в высоком прозрачном сосуде получите хлор. Отверстие сосуда закройте ватным тампоном, смоченным раствором тиосульфата натрия. Для демонстрации взаимодействия метана с хлором замените прямую газоотводную трубку трубкой с изогнутым концом, подожгите газ, и внесите в сосуд с хлором, как показано на рис. 43.
Рис. 43. Горение метана в хлоре.
Весь эксперимент при должной подготовке занимает около 5 минут. После чего проводится обсуждение результатов эксперимента, заполняется таблица и делаются выводы о соответствии свойств метана строению его молекулы.
Свойства гомологов метана. Налейте в пробирку 3 мл воды, добавьте 1 мл гексана (можно взять другой насыщенный углеводород или их смесь). Отметьте физические свойства вещества, его нерастворимость в воде и относительную плотность сравнительно с плотностью воды.
Добавьте в смесь несколько капель раствора перманганата калия и убедитесь в отсутствии взаимодействия. Прилейте к иодной воде (3 мл) немного гексана и встряхните пробирку, отметьте отсутствие взаимодействия углеводорода с галогеном. Однако вследствие лучшей растворимости иода в гексане происходит экстракция галогена в слой углеводорода.
Для демонстрирования горючести гексана налейте несколько капель его в фарфоровую чашку и подожгите длинной горящей лучинкой. Обсудите результаты эксперимента, напишите соответствующие уравнения реакций и сделайте выводы о свойствах гомологов метана, обусловленных строением молекул.
Опыты 12-22. Получение и свойства этилена. Свойства полиэтилена. В пробирку налейте 2–3 мл 96%-го этилового спирта и медленно добавьте 6–9 мл концентрированной серной кислоты. Осторожно перемешайте. Во избежание толчков при кипении туда же добавьте щепотку сухого сульфата кальция или сульфата бария для равномерного кипения. Смесь для получения этилена можно приготовить заранее и хранить длительное время. Пробирку закройте пробкой с газоотводной трубкой, как на рис. 44.
Перед получением этилена приготовьте в четырех стаканах растворы реактивов, как это было рекомендовано выше для демонстрации свойств метана.
Осторожно нагрейте сначала всю пробирку, а затем нагревайте ту ее часть, где находится верхняя граница жидкости. Температура должна быть выше 140 °С.

Рис. 44. Установка для получения этилена.
Физические свойства этилена. С помощью газоотводной трубки пропускайте этилен через чистую воду, опустив трубку до дна стакана. Наблюдаются пузырьки бесцветного газа – этилена. Этилен собирают по способу вытеснения воды, что дает ученикам основание предположить, что этот газ нерастворим в воде. Учитель подтверждает это заключение.
Отношение этилена к водному раствору перманганата калия и иодной воде. Газоотводную трубку опустите до дна стаканчика со светло-розовым раствором перманганата калия. Выделяющийся газ проходит через раствор перманганата калия и постепенно обесцвечивает его:
3Н2С=СН2 + 2KMnO4 + 4Н2O → 2KOH + 2MnO2 + 3CH2(OH)-CH2(OH).
Аналогичным образом пропускайте получаемый этилен через соломенно-желтый раствор иодной воды. Раствор обесцвечивается:
Н2С=СН2 + I2 ® С2Н4I2.
Проба на взрывоопасность (проверка этилена на чистоту). Опустите газоотводную трубку в пенообразующий раствор, так чтобы выделяющийся газ образовал пену. Когда стакан наполнится пеной, уберите газоотводную трубку и поднесите к пене горящую лучинку. Наблюдается воспламенение и быстрое сгорание этилена. Если вспышка сопровождается резким звуком, то значит выделяющийся из прибора газ содержит примеси кислорода воздуха. В этом случае поджигать этилен у газоотводной трубки опасно. Поэтому проверку на чистоту нужно повторить через некоторое время еще раз. Только чистый этилен (как метан и водород), без примеси воздуха можно поджигать в ходе эксперимента.
Горение этилена в воздухе и хлоре. Для этих опытов поднесите пламя горящей лучинки к концу газоотводной трубки. Этилен загорается и горит светящимся пламенем. При внесении в пламя фарфоровой чашки на ней образуется чёрное пятно сажи, появление которой можно объяснить бóльшим содержанием (%) углерода в молекуле этилена и его неполным окислением:
Н2С=СН2 + О2 → СО2; С; Н2О
При внесении изогнутой трубки с горящим этиленом в цилиндр с хлором (см. опыты с метаном), он продолжает гореть с выделением еще большего количества копоти:
С2Н4 + Cl2 = 2С + 4HCl
Весь эксперимент занимает всего несколько минут. После чего проводится обсуждение результатов эксперимента, заполняется таблица и делаются выводы о соответствии свойств этилена строению его молекулы (в сопоставлении со строением и свойствами метана).
Свойства полиэтилена. Изделие из полиэтилена (пробку, трубочку, пленку и т. д.) осторожно нагрейте над пламенем горелки. Отметьте размягчение материала. Измените форму предмета и охладите его; сохраняется новая форма. Как называется это свойство полимера?
🔥 Видео
8 класс. ОВР. Окислительно-восстановительные реакции.Скачать

Взаимодействие этилена с бромной водойСкачать

Взаимодействие этилена с раствором перманганата калияСкачать

Полимеры. Ч.3-3. Полимеризация этилена (элементарно о реакции)Скачать

Опыты по химии. Получение этилена и опыты с нимСкачать

ЭТО ПОМОЖЕТ разобраться в Органической Химии — Алкены, Урок ХимииСкачать

Горение этиленаСкачать

ОКИСЛЕНИЕ АЛКЕНОВ ЕГЭ / жёсткое, мягкое окисление в органике с KMnO4Скачать

Получение этилена из этилового спиртаСкачать

ОВР и Метод Электронного Баланса — Быстрая Подготовка к ЕГЭ по ХимииСкачать

Получение и изучение свойств этилена. Опыт 2Скачать

Взаимодействие этилена с бромной водойСкачать

Окислительно-восстановительные реакции с нуля!| Екатерина Строганова | 100балльный репетиторСкачать

Получение этилена и его горениеСкачать

Реакции присоединения | Химия 10 класс | УмскулСкачать

Химия | Тепловой эффект химической реакции (энтальпия)Скачать

25. Схема реакции и химическое уравнениеСкачать

Реакции присоединения в алкенах | Химия 10 класс | УмскулСкачать