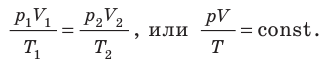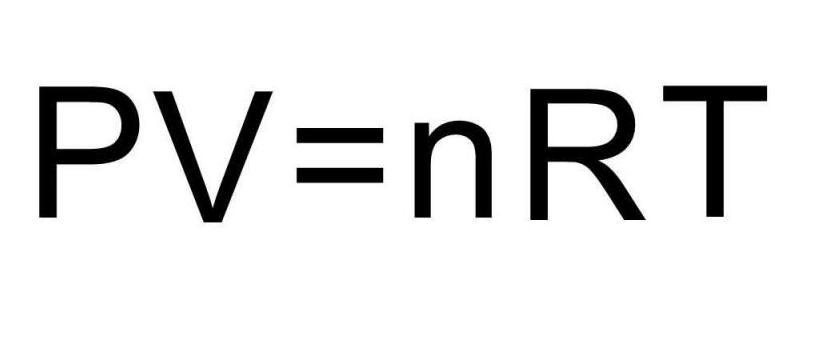Содержание:
Уравнение состояния идеального газа:
Уравнения Клапейрона и Менделеева — клапейрона; законы Шарля, Гей-Люссака, Бойля — Мариотта, Авогадро, Дальтона, — пожалуй, такого количества «именных» законов нет ни в одном разделе физики. за каждым из них — кропотливая работа в лабораториях, тщательные измерения, длительные аналитические размышления и точные расчеты. нам намного проще. Мы уже знаем основные положения теории, и «открыть» все вышеупомянутые законы нам не составит труда.
- Уравнение состояния идеального газа
- Уравнение Клапейрона
- Изопроцессы
- Какой процесс называют изотермическим. Закон Бойля — Мариотта
- Какой процесс называют изобарным. Закон Гей-Люссака
- Закон Гей-Люссака
- Изохорный процесс. Закон Шарля
- Закон Шарля
- Пример №1
- Пример №2
- Уравнение состояния идеального газа и смысл абсолютной температуры
- Газовое состояние вещества
- Идеальный газ
- Закон Клапейрона-Менделеева
- Другие формы записи уравнения
- Закон Бойля-Мариотта
- Законы Шарля и Гей-Люссака
- Абсолютная температура
- Принцип Авогадро и газовые смеси
- Пример решения задачи
- Отличие уравнений клапейрона и клапейрона менделеева
- 📸 Видео
Видео:Физика. МКТ: Уравнение Менделеева-Клапейрона для идеального газа. Центр онлайн-обучения «Фоксфорд»Скачать

Уравнение состояния идеального газа
Давление газа полностью определяется его температурой и концентрацией молекул: p=nkT. Запишем данное уравнение в виде: pV = NkT. Если состав и масса газа известны, число молекул газа можно найти из соотношения
Произведение числа Авогадро 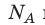
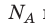
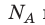
Обратите внимание! Состояние данного газа некоторой массы однозначно определяется двумя его макроскопическими параметрами; третий параметр можно найти из уравнения Менделеева — Клапейрона.
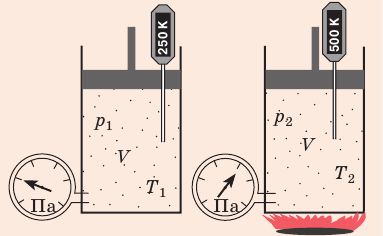
Уравнение Клапейрона
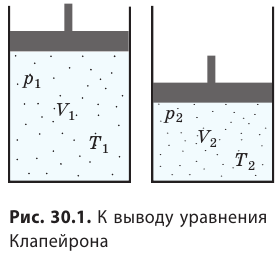
С помощью уравнения Менделеева — Клапейрона можно установить связь между макроскопическими параметрами газа при его переходе из одного состояния в другое. Пусть газ, имеющий массу m и молярную массу М, переходит из состояния (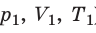
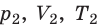
Для каждого состояния запишем уравнение Менделеева — Клапейрона: 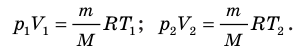
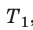
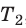
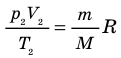
Для данного газа некоторой массы отношение произведения давления на объем к температуре газа является неизменным.
Изопроцессы
Процесс, при котором один из макроскопических параметров данного газа некоторой массы остается неизменным, называют изопроцессом. Поскольку состояние газа характеризуется тремя макроскопическими параметрами, возможных изопроцессов тоже три: происходящий при неизменной температуре; происходящий при неизменном давлении; происходящий при неизменном объеме. Рассмотрим их.
Какой процесс называют изотермическим. Закон Бойля — Мариотта
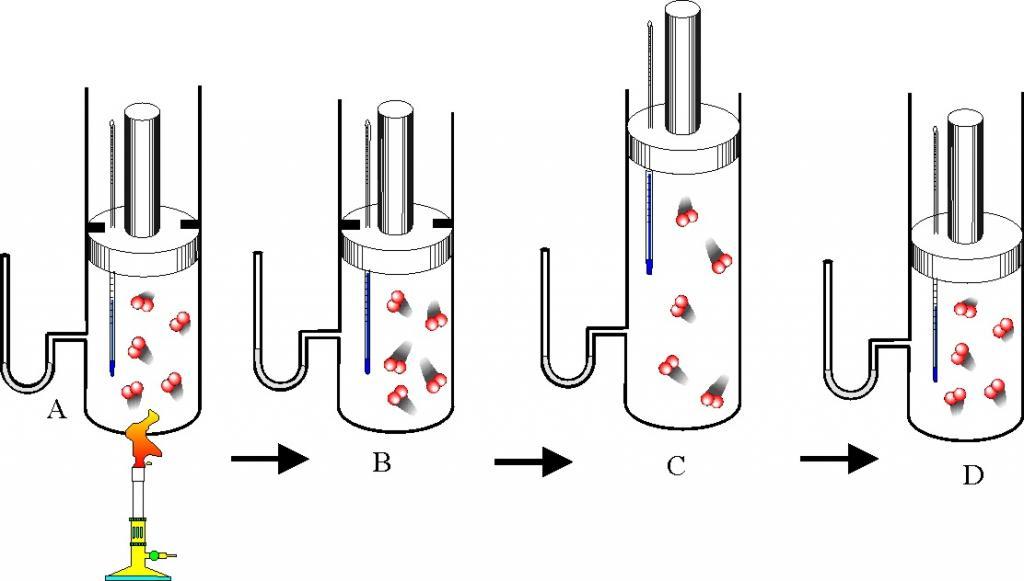
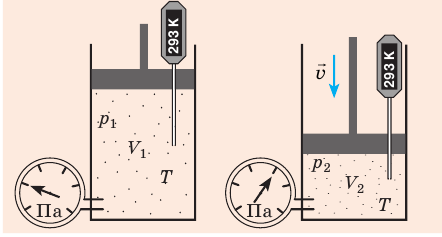
Пузырек воздуха, поднимаясь со дна глубокого водоема, может увеличиться в объеме в несколько раз, при этом давление внутри пузырька падает, поскольку вследствие дополнительного гидростатического давления воды (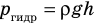
Рис. 30.2. Изотермическое сжатие газа. Если медленно опускать поршень, температура газа под поршнем будет оставаться неизменной и равной температуре окружающей среды. Давление газа при этом будет увеличиваться
Изотермический процесс — процесс изменения состояния данного газа некоторой массы, протекающий при неизменной температуре.
Пусть некий газ переходит из состояния (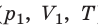
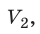
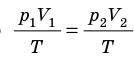
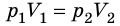
Закон Бойля — Мариотта:
Для данного газа некоторой массы произведение давления газа на его объем остается постоянным, если температура газа не изменяется:
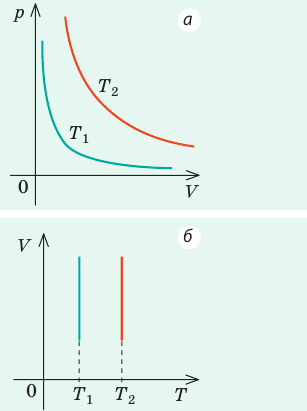
Графики изотермических процессов называют изотермами. Как следует из закона Бойля — Мариотта, при неизменной температуре давление газа данной массы обратно пропорционально его объему: 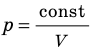
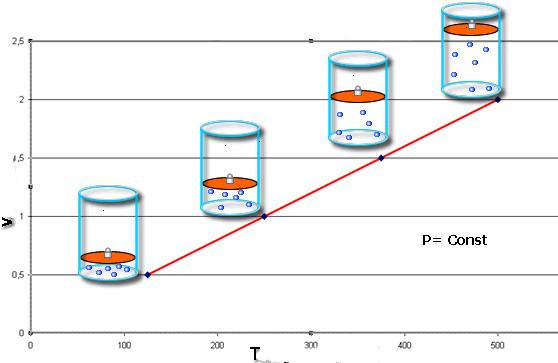
Какой процесс называют изобарным. Закон Гей-Люссака
Изобарный процесс — процесс изменения состояния данного газа некоторой массы, протекающий при неизменном давлении.
Пусть некий газ переходит из состояния (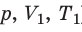
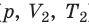
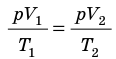
Рис. 30.4. Изобарное расширение газа. Если газ находится под тяжелым поршнем массой M и площадью S, который может перемещаться практически без трения, то при увеличении температуры объем газа будет увеличиваться, а давление газа будет оставаться неизменным и равным p
Закон Гей-Люссака
Для данного газа некоторой массы отношение объема газа к температуре остается постоянным, если давление газа не изменяется:
Графики изобарных процессов называют изобарами. Как следует из закона Гей-Люссака, при неизменном давлении объем газа данной массы прямо пропорционален его температуре: V = const⋅T. График данной зависимости — прямая, проходящая через начало координат (рис. 30.5, а). По графику видно, что с приближением к абсолютному нулю объем идеального газа должен уменьшиться до нуля. Понятно, что это невозможно, поскольку реальные газы при низких температурах превращаются в жидкости. В координатах p, V и p, T изобары перпендикулярны оси давления (рис. 30.5, б, в).
Изохорный процесс. Закон Шарля
Если газовый баллон сильно нагреется на солнце, давление в нем повысится настолько, что баллон может взорваться. В данном случае имеем дело с изохорным нагреванием.
Изохорный процесс — процесс изменения состояния данного газа некоторой массы, протекающий при неизменном объеме.
Пусть некий газ переходит из состояния (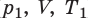
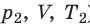
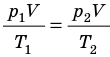
Рис. 30.6. Изохорное нагревание газа. Если газ находится в цилиндре под закрепленным поршнем, то с увеличением температуры давление газа тоже будет увеличиваться. Опыт показывает, что в любой момент времени отношение давления газа к его температуре неизменно:
Закон Шарля
Для данного газа некоторой массы отношение давления газа к его температуре остается постоянным, если объем газа не изменяется:
Графики изохорных процессов называют изохорами. Из закона Шарля следует, что при неизменном объеме давление газа данной массы прямо пропорционально его температуре: p T = ⋅ const . График этой зависимости — прямая, проходящая через начало координат (рис. 30.7, а). В координатах p, V и V, T изохоры перпендикулярны оси объема (рис. 30.7, б, в).
Пример №1
В вертикальной цилиндрической емкости под легкоподвижным поршнем находится 2 моль гелия и 1 моль молекулярного водорода. Температуру смеси увеличили в 2 раза, и весь водород распался на атомы. Во сколько раз увеличился объем смеси газов?
Анализ физической проблемы. Смесь газов находится под легкоподвижным поршнем, поэтому давление смеси не изменяется: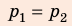
Решение:
Воспользуемся уравнением состояния идеального газа: pV = νRT. Запишем это уравнение для состояний смеси газов до и после распада: 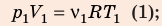
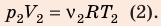
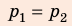
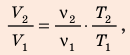
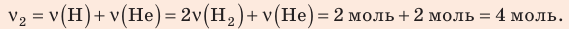
Ответ: примерно в 2,7 раза.
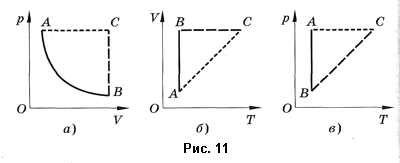
Пример №2
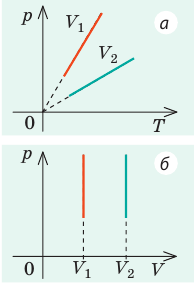
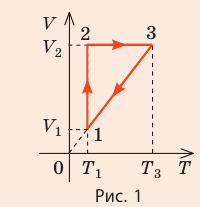
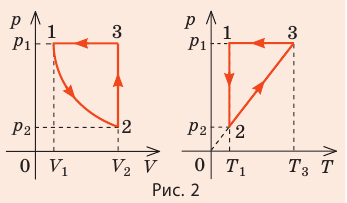
На рис. 1 представлен график изменения состояния идеального газа неизменной массы в координатах V, T. Представьте график данного процесса в координатах p, V и p, T.
Решение:
1. Выясним, какой изопроцесс соответствует каждому участку графика (рис. 1).
Зная законы, которым подчиняются эти изопроцессы, определим, как изменяются макроскопические параметры газа. Участок 1–2: изотермическое расширение; T = const, V ↑, следовательно, по закону Бойля — Мариотта p ↓. Участок 2–3: изохорное нагревание; V = const, T ↑, следовательно, по закону Шарля p ↑ . Участок 3–1: изобарное охлаждение; p = const , T ↓, следовательно, по закону Гей-Люссака V ↓ .
2. Учитывая, что точки 1 и 2 лежат на одной изотерме, точки 1 и 3 — на одной изобаре, а точки 2 и 3 на одной изохоре, и используя результаты анализа, построим график процесса в координатах p, V и p, T (рис. 2)
- Из соотношения p=nkT можно получить ряд важных законов, большинство из которых установлены экспериментально.
- Уравнение состояния идеального газа (уравнение Менделеева — Клапейрона):
— универсальная газовая постоянная.
- Уравнение Клапейрона:
- Законы, которым подчиняются изопроцессы, то есть процессы, при которых один из макроскопических параметров данного газа некоторой массы остается неизменным:
| Рекомендую подробно изучить предметы: |
|
| Ещё лекции с примерами решения и объяснением: |
- Температура в физике
- Парообразование и конденсация
- Тепловое равновесие в физике
- Изопроцессы в физике
- Абсолютно упругие и неупругие столкновения тел
- Механизмы, работающие на основе правила моментов
- Идеальный газ в физике
- Уравнение МКТ идеального газа
При копировании любых материалов с сайта evkova.org обязательна активная ссылка на сайт www.evkova.org
Сайт создан коллективом преподавателей на некоммерческой основе для дополнительного образования молодежи
Сайт пишется, поддерживается и управляется коллективом преподавателей
Whatsapp и логотип whatsapp являются товарными знаками корпорации WhatsApp LLC.
Cайт носит информационный характер и ни при каких условиях не является публичной офертой, которая определяется положениями статьи 437 Гражданского кодекса РФ. Анна Евкова не оказывает никаких услуг.
Видео:Задачи на уравнение Менделеева-Клапейрона. Ч.1. Краткая теория + решение задачиСкачать

Уравнение состояния идеального газа и смысл абсолютной температуры
Каждый человек в течение своей жизни сталкивается с телами, которые находятся в одном из трех агрегатных состояний вещества. Самым простым для изучения агрегатным состоянием является газ. В статье рассмотрим концепцию идеального газа, приведем уравнение состояния системы, а также уделим некоторое внимание описанию абсолютной температуры.
Видео:Физика 10 класс: Уравнение Клапейрона-МенделееваСкачать

Газовое состояние вещества
Каждый школьник хорошо представляет, о каком состоянии материи идет речь, когда слышит слово «газ». Под этим словом понимают тело, которое способно занимать любой предоставленный ему объем. Оно не способно сохранять форму, поскольку не может сопротивляться даже самому незначительному внешнему воздействию. Также газ не сохраняет и объем, что его отличает не только от твердых тел, но и от жидкостей.

Как и жидкость, газ является текучей субстанцией. В процессе движения твердых тел в газах последние препятствуют этому движению. Появившуюся силу называют сопротивлением. Ее величина зависит от скорости движения тела в газе.
Яркими примерами газов является воздух, природный газ, который используется для отопления домов и приготовления пищи, инертные газы (Ne, Ar), которыми заполняют рекламные трубки тлеющего разряда, или которые используют для создания инертной (неагрессивной, защитной) среды при сварке.
Видео:Уравнение состояния идеального газа | Физика 10 класс #33 | ИнфоурокСкачать

Идеальный газ

Прежде чем переходить к описанию газовых законов и уравнения состояния, следует хорошо разобраться с вопросом, что собой представляет идеальный газ. Это понятие вводится в молекулярно-кинетической теории (МКТ). Идеальным называется любой газ, который удовлетворяет следующим характеристикам:
- Образующие его частицы не взаимодействуют друг с другом за исключением непосредственных механических столкновений.
- В результате столкновения частиц со стенками сосуда или между собой их кинетическая энергия и количество движения сохраняются, то есть столкновение считается абсолютно упругим.
- Частицы не имеют размеров, но обладают конечной массой, то есть подобны материальным точкам.
Естественно, что любой газ является не идеальным, а реальным. Тем не менее, для решения многих практических задач указанные приближения являются вполне справедливыми и ими можно пользоваться. Существует общее эмпирическое правило, которое гласит: независимо от химической природы, если газ имеет температуру выше комнатной и давление порядка атмосферного или ниже, то его с высокой точностью можно считать идеальным и применять для его описания формулу уравнения состояния идеального газа.
Видео:62. Уравнение Клапейрона-МенделееваСкачать

Закон Клапейрона-Менделеева
Переходами между различными агрегатными состояниями вещества и процессами в рамках одного агрегатного состояния занимается термодинамика. Давление, температура и объем являются тремя величинами, которые однозначно определяют любое состояние термодинамической системы. Формула уравнения состояния идеального газа объединяет в единое равенство все три указанные величины. Запишем эту формулу:
Здесь P, V, T — давление, объем, температура, соответственно. Величина n — это количество вещества в молях, а символом R обозначена универсальная постоянная газов. Это равенство показывает, что чем больше произведение давления на объем, тем больше должно быть произведение количества вещества на температуру.
Формула уравнения состояния газа называется законом Клапейрона-Менделеева. В 1834 году французский ученый Эмиль Клапейрон, обобщив экспериментальные результаты его предшественников, пришел к этому уравнению. Однако Клапейрон пользовался рядом констант, которые Менделеев впоследствии заменил одной — универсальной газовой постоянной R (8,314 Дж/(моль*К)). Поэтому в современной физике это уравнение названо по фамилиям французского и русского ученых.
Видео:Успеть за 300 секунд, #3: Уравнение Клапейрона-МенделееваСкачать

Другие формы записи уравнения
Выше мы записали уравнение состояния идеального газа Менделеева-Клапейрона в общепринятом и удобном виде. Однако в задачах по термодинамике часто может потребоваться несколько иной вид. Ниже записаны еще три формулы, которые непосредственно следуют из записанного уравнения:
Эти три уравнения также являются универсальными для идеального газа, только в них появляются такие величины, как масса m, молярная масса M, плотность ρ и число частиц N, которые составляет систему. Символом kB здесь обозначена постоянная Больцмана (1,38*10-23 Дж/К).
Видео:Уравнение состояния идеального газа. 10 класс.Скачать

Закон Бойля-Мариотта
Когда Клапейрон составлял свое уравнение, то он основывался на газовых законах, которые были открыты экспериментально несколько десятилетий ранее. Одним из них является закон Бойля-Мариотта. Он отражает изотермический процесс в закрытой системе, в результате которого изменяются такие макроскопические параметры, как давление и объем. Если положить T и n постоянными в уравнении состояния идеального газа, газовый закон тогда примет вид:
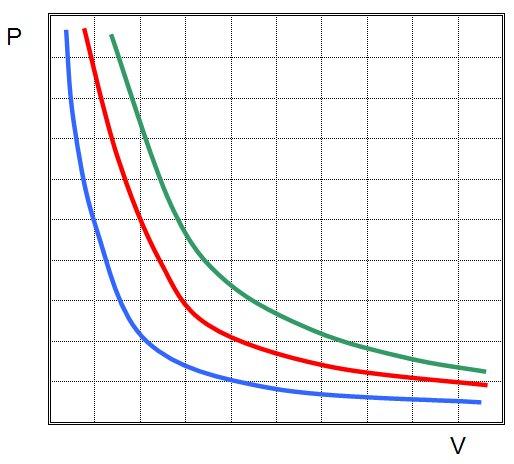
Это и есть закон Бойля-Мариотта, который говорит о том, что произведение давление на объем сохраняется во время произвольного изотермического процесса. При этом сами величины P и V изменяются.
Если изображать график зависимости P(V) или V(P), то изотермы будут представлять собой гиперболы.
Видео:Урок 156. Уравнение состояния идеального газа. Квазистатические процессыСкачать

Законы Шарля и Гей-Люссака
Эти законы математически описывают изобарный и изохорный процессы, то есть такие переходы между состояниями газовой системы, при которых сохраняются давление и объем, соответственно. Закон Шарля математически можно записать следующим образом:
V/T = const при n, P = const.
Закон Гей-Люссака записывается так:
P/T = const при n, V = const.
Если оба равенства представить в виде графика, то мы получим прямые линии, которые под некоторым углом наклонены к оси абсцисс. Такой вид графиков говорит о прямой пропорциональности между объемом и температурой при постоянном давлении и между давлением и температурой при постоянном объеме.
Отметим, что все три рассмотренных газовых закона не принимают во внимание химический состав газа, а также изменение его количества вещества.
Видео:Уравнение Менделеева-Клапейрона.Все виды задач на ЕГЭ.52 задачиСкачать

Абсолютная температура
В быту мы привыкли пользоваться температурной шкалой Цельсия, поскольку она является удобной для описания окружающих нас процессов. Так, вода кипит при температуре 100 oC, а замерзает при 0 oC. В физике эта шкала оказывается неудобной, поэтому применяют так называемую абсолютную шкалу температур, которая была введена лордом Кельвином в середине XIX века. В соответствии с этой шкалой температура измеряется в Кельвинах (К).
Считается, что при температуре -273,15 oC не существует никаких тепловых колебаний атомов и молекул, прекращается полностью их поступательное движение. Этой температуре в градусах Цельсия соответствует абсолютный ноль в Кельвинах (0 К). Из этого определения следует физический смысл абсолютной температуры: она является мерой кинетической энергии составляющих материю частиц, например, атомов или молекул.
Помимо приведенного выше физического смысла абсолютной температуры, существуют другие подходы к пониманию этой величины. Одним из них является упомянутый газовый закон Шарля. Запишем его в следующей форме:
Последнее равенство говорит о том, что при определенном количестве вещества в системе (например, 1 моль) и определенном давлении (например, 1 Па) объем газа однозначно определяет абсолютную температуру. Иными словами, возрастание объема газа при указанных условиях возможно только за счет увеличения температуры, а уменьшение объема свидетельствует об уменьшении величины T.
Напомним, что в отличие от температуры по шкале Цельсия, абсолютная температура не может принимать отрицательные значения.
Видео:Уравнение Менделеева - Клапейрона за 10 минут | Физика с Никитой АрхиповымСкачать

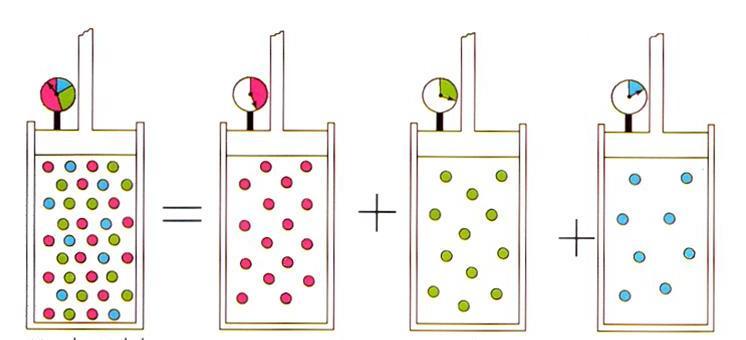
Принцип Авогадро и газовые смеси
Помимо изложенных выше газовых законов, уравнение состояния для идеального газа также приводит к открытому Амедео Авогадро в начале XIX века принципу, который носит его фамилию. Этот принцип устанавливает, что объем любого газа при постоянных давлении и температуре определяется количеством вещества в системе. Соответствующая формула выглядит так:
n/V = const при P, T = const.
Записанное выражение приводит к известному в физике идеальных газов закону Дальтона для газовых смесей. Этот закон гласит, что парциальное давление газа в смеси однозначно определяется его атомной долей.
Видео:Урок 158. Задачи на газовые законы - 1Скачать

Пример решения задачи
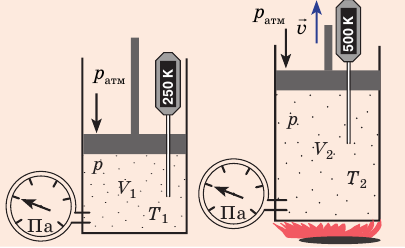
В закрытом сосуде с жесткими стенками, содержащем идеальный газ, в результате нагревания давление увеличилось в 3 раза. Необходимо определить конечную температуру системы, если ее начальное значение было равно 25 oC.
Сначала переведем температуру из градусов Цельсия в Кельвины, имеем:
T = 25 + 273,15 = 298,15 К.
Поскольку стенки сосуда являются жесткими, то процесс нагревания можно считать изохорным. Для этого случая применим закон Гей-Люссака, имеем:
Таким образом, конечная температура определяется из произведения отношения давлений и начальной температуры. Подставляя в равенство данные, получаем ответ: T2 = 894,45 К. Эта температура соответствует 621,3 oC.
Видео:Газовые законы. Изопроцессы | Физика 10 класс #34 | ИнфоурокСкачать

Отличие уравнений клапейрона и клапейрона менделеева
Физика → Методика → Экзамены → Ответы на билеты устных экзаменов → 8. Уравнение состояния идеального газа (уравнение Менделеева—Клапейрона). Изопроцессы
Состояние данной массы газа полностью определено, если известны его давление, температура и объем. Эти неличины называют параметрами состояния газа. Уравнение, связывающее параметры состояния, называют уравнением состояния.
Для произвольной массы газа состояние газа описывается уравнением Менделеева—Клапейрона:
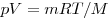
где 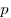
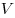
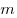
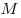
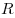
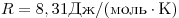
Уравнение Менделеева—Клапейрона показывает, что возможно одновременное изменение трех параметров, характеризующих состояние идеального газа. Однако многие процессы в газах, происходящие в природе и осуществляемые в технике, можно рассматривать приближенно как процессы, в которых изменяются лишь два параметра. Особую роль в физике и технике играют три процесса: изотермический, изохорный и изобарный.
Изопроцессом называют процесс, происходящий с данной массой газа при одном постоянном параметре — температуре, давлении или объеме. Из уравнения состояния как частные случаи получаются законы для изопроцессов.
Изотермическим называют процесс, протекаю-щий при постоянной температуре: 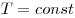
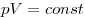
Изохорным называют процесс, протекающий при постоянном объеме: 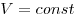
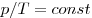
Изобарным называют процесс, протекающий при постоянном давлении. Уравнение этого процесса имеет вид 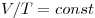
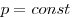
Реальные газы удовлетворяют уравнению состоя ния идеального газа при не слишком высоких давлениях (пока собственный объем молекул пренебрежимо мал по сравнению с объемом сосуда, в котором находится газ) и при не слишком низких температуpax (пока потенциальной энергией межмолекулярного взаимодействия можно пренебречь по сравнению с кинетической энергией теплового движения молекул), т. е. для реального газа это уравнение и его следствия являются хорошим приближением.
📸 Видео
Урок 2.Уравнение Менделеева-Клапейрона. Решение задач. База. ЕГЭСкачать

🔴 ЕГЭ-2023 по физике. Уравнение Менделеева-Клапейрона. Закон ДальтонаСкачать

Решение графических задач на тему Газовые законыСкачать

Урок 157. Изопроцессы и их графики. Частные газовые законыСкачать

Вывод уравнения состояния Клапейрона—МенделееваСкачать

Задачи на уравнение Менделеева-Клапейрона. Ч.2. Решение задач.Скачать

Идеальный газ. Основное уравнение молекулярно-кинетической теории газов. 10 класс.Скачать

68 учеников этого НЕ ЗНАЮТ! Таблица Менделеева — Как пользоваться?Скачать

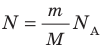
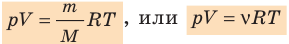
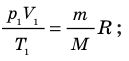
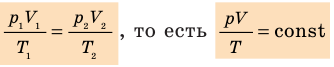
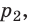
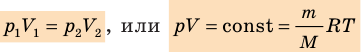

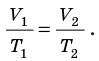
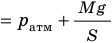
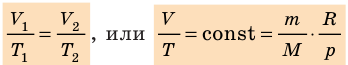
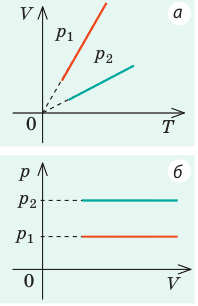

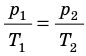
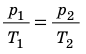
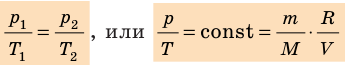

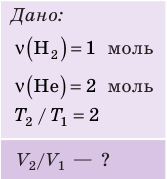
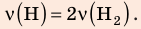

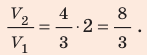
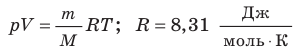 — универсальная газовая постоянная.
— универсальная газовая постоянная.