Молекулярно-кинетическая теория (МКТ) – это учение, которое объясняет тепловые явления в макроскопических телах и внутренние свойства этих тел движением и взаимодействием атомов, молекул и ионов, из которых состоят тела. В основе МКТ строения вещества лежат три положения:
- Вещество состоит из частиц – молекул, атомов и ионов. В состав этих частиц входят более мелкие элементарные частицы. Молекула – наименьшая устойчивая частица данного вещества. Молекула обладает основными химическими свойствами вещества. Молекула является пределом деления вещества, то есть самой маленькой частью вещества, которая способна сохранять свойства этого вещества. Атом – это наименьшая частица данного химического элемента.
- Частицы, из которых состоит вещество, находятся в непрерывном хаотическом (беспорядочном) движении.
- Частицы вещества взаимодействуют друг с другом – притягиваются и отталкиваются.
Эти основные положения подтверждаются экспериментально и теоретически.
- Состав вещества
- Хаотическое движение частиц
- Взаимодействие частиц
- Основные положения МКТ
- Основные положения молекулярно кинетической теории строения вещества
- Опытное обоснование основных положений молекулярно кинетической теории
- Броуновское движение
- Агрегатные состояния веществ
- Кинетическая модель идеального газа
- Основные положения молекулярно-кинетической теории и их опытное обоснование
- Молекулярно-кинетическая теория – это совокупность воззрений, используемых для описания наблюдаемых и измеряемых свойств вещества на основе изучения свойств атомов и молекул данного вещества, их взаимодействия и движения.
- Основные положения молекулярно-кинетической теории
- Краткие итоги
- Основные положения молекулярно-кинетической теории
- Возникновение молекулярно-кинетической теории
- Доказательства положений МКТ
- Что мы узнали?
- 📸 Видео
Видео:Физика. МКТ: Основные положения МКТ и их опытное обоснование. Центр онлайн-обучения «Фоксфорд»Скачать

Состав вещества
Современные приборы позволяют наблюдать изображения отдельных атомов и молекул. С помощью электронного микроскопа или ионного проектора (микроскопа) можно получить изображения отдельных атомов и оценить их размеры. Диаметр любого атома имеет порядок d = 10 -8 см (10 -10 м). Размеры молекул больше размеров атомов. Поскольку молекулы состоят из нескольких атомов, то чем больше количество атомов в молекуле, тем больше её размер. Размеры молекул лежат в пределах от 10 -8 см (10 -10 м) до 10 -5 см (10 -7 м).
Видео:Основные положения молекулярно-кинетической теории газов и ее опытное обоснование. 10 класс.Скачать

Хаотическое движение частиц
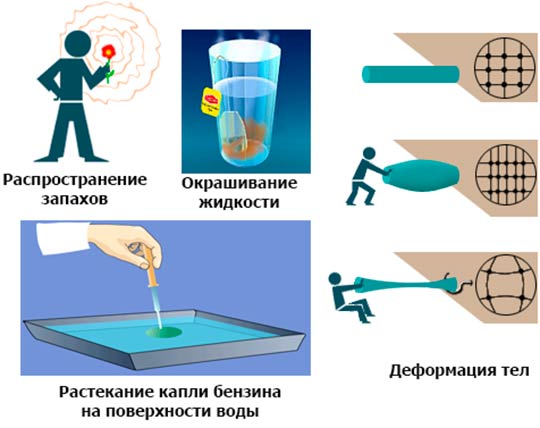
Непрерывное хаотическое движение частиц подтверждается броуновским движением и диффузией. Хаотичность движения означает, что у молекул не существует каких-либо предпочтительных путей и их движения имеют случайные направления. Это означает, что все направления равновероятны.
Диффузия (от латинского diffusion – растекание, распространение) – явление, когда в результате теплового движения вещества происходит самопроизвольное проникновение одного вещества в другое (если эти вещества соприкасаются).
Взаимное перемешивание веществ происходит по причине непрерывного и беспорядочного движения атомов или молекул (или других частиц) вещества. С течением времени глубина проникновения молекул одного вещества в другое увеличивается. Глубина проникновения зависит от температуры: чем выше температура, тем больше скорость движения частиц вещества и тем быстрее протекает диффузия.
Диффузия наблюдается во всех состояниях вещества – в газах, жидкостях и твёрдых телах. Примером диффузии в газах служит распространение запахов в воздухе при отсутствии прямого перемешивания. Диффузия в твёрдых телах обеспечивает соединение металлов при сварке, пайке, хромировании и т.п. В газах и жидкостях диффузия происходит намного быстрее, чем в твёрдых телах.
Видео:Урок 139. Основные положения МКТ.Скачать

Взаимодействие частиц
Существование устойчивых жидких и твёрдых тел объясняется наличием сил межмолекулярного взаимодействия (сил взаимного притяжения и отталкивания). Этими же причинами объясняется малая сжимаемость жидкостей и способность твёрдых тел сопротивляться деформациям сжатия и растяжения.
Силы межмолекулярного взаимодействия имеют электромагнитную природу – это силы электрического происхождения. Причиной этого является то, что молекулы и атомы состоят из заряженных частиц с противоположными знаками зарядов – электронов и положительно заряженных атомных ядер. В целом молекулы электрически нейтральны. По электрическим свойствам молекулу можно приближённо рассматривать как электрический диполь.
Силы притяжения принято считать отрицательными, а силы отталкивания – положительными, хотя это деления является условным.
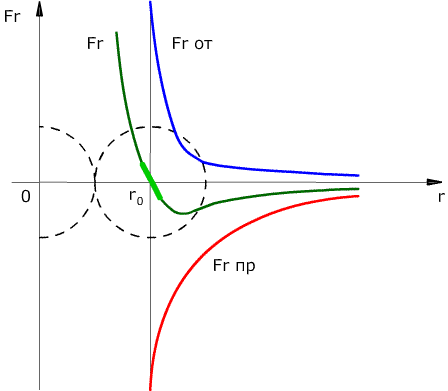
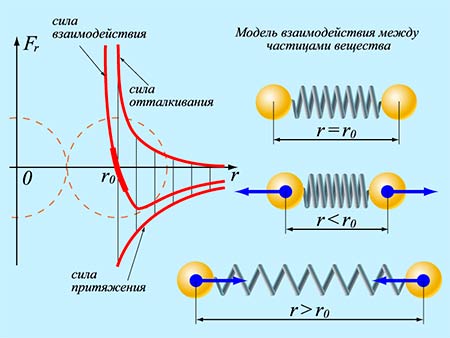
Сила взаимодействия между молекулами имеет определённую зависимость от расстояния между молекулами. Эта зависимость изображена на рис. 1.1. Здесь показаны проекции сил взаимодействия на прямую, которая проходит через центры молекул.
Рис. 1.1. Зависимость межмолекулярных сил от расстояния между взаимодействующими атомами.
Как видим, по мере уменьшения расстояния между молекулами r сила притяжения Fr пр увеличивается (красная линия на рисунке). Как уже было сказано, силы притяжения принято считать отрицательными, поэтому по мере уменьшения расстояния кривая уходит вниз, то есть в отрицательную зону графика.
Силы притяжения действуют по мере сближения двух атомов или молекул, пока расстояние r между центрами молекул находится в районе 10 -9 м (2-3 диаметра молекул). По мере увеличения этого расстояния силы притяжения ослабевают. Силы притяжения являются короткодействующими силами.
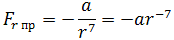 | (1.1) |
где a – коэффициент, зависящий от вида сил притяжения и строения взаимодействующих молекул.
При дальнейшем сближении атомов или молекул на расстояниях между центрами молекул порядка 10 -10 м (это расстояние сравнимо с линейными размерами неорганических молекул) появляются силы отталкивания Fr от (синяя линия на рис. 1.1). Эти силы появляются за счёт взаимного отталкивания положительно заряженных атомов в молекуле и убывают с увеличением расстояния r ещё быстрее, чем силы притяжения (что видно на графике – синяя линия более «круто» стремится к нулю, чем красная).
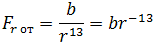 | (1.2) |
где b – коэффициент, зависящий от вида сил отталкивания и строения взаимодействующих молекул.
На расстоянии r = r0 (это расстояние примерно равно сумме радиусов молекул) силы притяжения уравновешивают силы отталкивания, а проекция результирующей силы Fr = 0. Этому состоянию соответствует наиболее устойчивое расположение взаимодействующих молекул.
В общем случае результирующая сила равна:
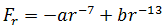 | (1.3) |
При r > r0 притяжение молекул превосходит отталкивание, при r
Видео:Идеальный газ. Основное уравнение молекулярно-кинетической теории газов. 10 класс.Скачать

Основные положения МКТ
Молекулярно-кинетическая теория – это учение о строении и свойствах вещества, основанное на представлении о существовании атомов и молекул, как наименьших частиц химических веществ.
Видео:Физика 10 класс (Урок№18 - Основное уравнение МКТ.)Скачать

Основные положения молекулярно кинетической теории строения вещества
Основные положения молекулярно-кинетической теории молекулы:
- Все вещества могут быть в жидком, твердом и газообразном состоянии. Они образуются из частиц, которые состоят из атомов. Элементарные молекулы могут иметь сложное строение, то есть иметь в своем составе несколько атомов. Молекулы и атомы – электрически нейтральные частицы, которые в определенных условиях приобретают дополнительный электрический заряд и переходят в положительные или отрицательные ионы.
- Атомы и молекулы движутся непрерывно.
- Частицы с электрической природой силы взаимодействуют друг с другом.
Основные положения мкт и их примеры были перечислены выше. Между частицами имеется малое гравитационное воздействие.
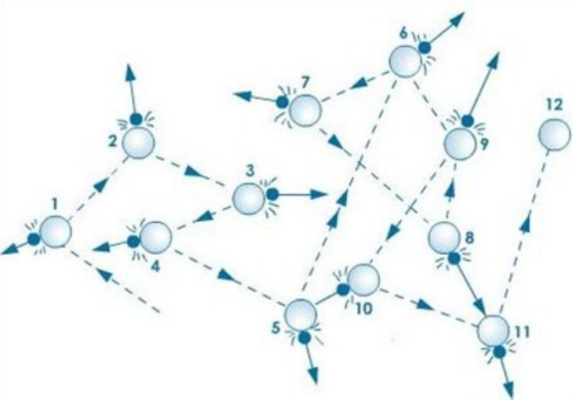
Рисунок 3 . 1 . 1 . Траектория Броуновской частицы.
Броуновское движение молекул и атомов подтверждает существование основных положений молекулярно кинетической теории и опытно обосновывает его. Данное тепловое движение частиц происходит с взвешенными в жидкости или газе молекулами.
Видео:Молекулярно-кинетическая теория | ЕГЭ по физике 2023 | Снежа Планк из ВебиумСкачать

Опытное обоснование основных положений молекулярно кинетической теории
В 1827 году Р. Броун открыл это движение, которое было обусловлено беспорядочными ударами и перемещениями молекул. Так как процесс происходил хаотично, то удары не могли уравновесить друг друга. Отсюда вывод, что скорость броуновской частицы не может быть постоянной, она постоянно меняется, а движение направления изображается в виде зигзага, показанное на рисунке 3 . 1 . 1 .
О броуновском движении говорил еще А. Эйнштейн в 1905 году. Его теория нашла подтверждение в опытах Ж. Перрена 1908 — 1911 гг.
Следствие из теории Эйнштейна: квадрат смещения r 2 > броуновской частицы относительно начального положения, усредненное по многим броуновским частицам, пропорционален времени наблюдения t .
Выражение r 2 > = D t объясняет диффузионный закон. По теории имеем, что D монотонно возрастает с увеличением температуры. Беспорядочное движение проглядывается при наличии диффузии.
Диффузия – это определение явления проникновения двух или нескольких соприкасающихся веществ друг в друга.
Данный процесс происходит быстро в неоднородном газе. Благодаря примерам диффузии с разными плотностями можно получить однородную смесь. При нахождении в одном сосуде кислорода O 2 и водорода H 2 с перегородкой то при ее удалении газы начинают смешиваться, образую опасную смесь. Процесс возможен при нахождении вверху водорода, а внизу кислорода.
Процессы взаимопроникновения также протекают в жидкостях, но намного медленней. Если растворить твердое тело, сахар, в воде, то получим однородный раствор, который является наглядным примером диффузионных процессов в жидкостях. При реальных условиях смешивание в жидкостях и в газах замаскировано быстрыми процессами перемешивания, к примеру, при возникновении конвекционных потоков.
Диффузия твердых тел отличается своей замедленной скоростью. Если поверхность взаимодействия металлов очистить, то можно увидеть, что с течением большого периода времени в каждом из них появятся атомы другого металла.
Диффузия и броуновское движение считаются родственными явлениями.
При взаимопроникновении частиц обоих веществ движение беспорядочно, то есть, наблюдается хаотичное тепловое перемещение молекул.
Видео:Физика 10 класс (Урок№16 - Основные положения МКТ. Броуновское движение.)Скачать

Броуновское движение
Силы, действующие между двумя молекулами, зависят от расстояния между ними. Молекулы имеют в своем составе положительные и отрицательные заряды. При больших расстояниях преобладают силы межмолекулярного притяжения, при небольших – силы отталкивания.
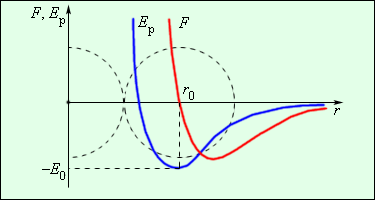
Рисунок 3 . 1 . 2 показывает зависимость результирующей силы F и потенциальной энергии E р взаимодействия между молекулами от расстояния между их центрами. На расстоянии r = r 0 сила взаимодействия обращается в ноль. Данное расстояние условно принимается в качестве диаметра молекулы. При r = r 0 потенциальная энергия взаимодействия минимальная.
Чтобы отдалить две молекулы с расстоянием r 0 , следует сообщить E 0 , называемую энергией связи или глубиной потенциальной ямы.
Рисунок 3 . 1 . 2 . Сила взаимодействия F и потенциальная энергия взаимодействия E р двух молекул. F > 0 – сила отталкивания, F 0 – сила притяжения.
Так как молекулы имеют малые размеры, то простые одноатомные могут быть не более 10 – 10 м . Сложные могут достигать размеров в сотни раз больше.
Беспорядочное хаотичное движение молекул называют тепловым движением.
При возрастании температуры увеличивается кинетическая энергия теплового движения. При пониженных температурах средняя кинетическая энергия, в большинстве случаев, оказывается меньше значения глубины потенциальной ямы E 0 . Данный случай показывает, что молекулы перетекают в жидкое или твердое вещество со средним расстоянием между ними r 0 . Если температура повышается, то средняя кинетическая энергия молекулы превышает E 0 , тогда они разлетаются и образуют газообразное вещество.
В твердых телах молекулы двигаются беспорядочно около фиксированных центров, то есть, положений равновесий. В пространстве может быть распределены нерегулярным образом (у аморфных тел) или с образованием упорядоченных объемных структур (кристаллических тел).
Видео:Основные положения молекулярно-кинетической теории | Физика 10 класс #24 | ИнфоурокСкачать

Агрегатные состояния веществ
Свобода теплового движения молекул просматривается в жидкостях, так как у них нет привязки к центрам, что позволяет производить перемещения по всему объему. Этим объясняется ее текучесть.
Если молекулы располагаются близко, то могут образовывать упорядоченные структуры с несколькими молекулами. Данное явление получило название ближнего порядка. Дальний порядок характерен для кристаллических тел.
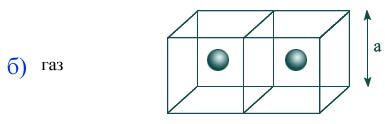
Расстояние в газах между молекулами намного больше, поэтому действующие силы малы, а их движения идут вдоль прямой, ожидая очередного соударения. Значение 10 – 8 м является средним расстоянием между молекулами воздуха в нормальных условиях. Так как взаимодействие сил слабое, газы расширяются и могут заполнять любой объем сосуда. Когда их взаимодействие стремится к нулю, то говорят о представлении идеального газа.
Видео:Основные положения МКТ и их опытное обоснование. Размеры и масса молекулСкачать

Кинетическая модель идеального газа
В мкт количество вещества считается пропорциональным числу частиц.
Моль – это количество вещества, содержащее столько частиц (молекул), сколько содержится атомов в 0 , 012 к г углерода C 12 . Молекула углерода состоит из одного атома. Отсюда следует, что 1 моль вещества имеет одно и то же количество молекул. Данное число называется постоянной Авогадро N А : N А = 6 , 02 ċ 1023 м о л ь – 1 .
Формула определения количества вещества ν записывается отношением N числа частиц на постоянную Авогадро N A : ν = N N A .
Массой одного моля вещества называют молярную массу М . Она фиксируется в виде формулы M = N А ċ m 0 .
Выражение молярной массы производится в килограммах на моль ( к г / м о л ь ) .
Если вещество имеет в составе один атом, тогда имеет место говорить об атомной массе частицы. Единица атома – это 1 12 массы изотопа углерода C 12 , называется атомной единицей массы и записывается как (а. е. м.): 1 а . е . м . = 1 , 66 ċ 10 – 27 к г .
Данная величина совпадает с массой протона и нейтрона.
Отношение массы атома или молекулы данного вещества к 1 12 массы атома углерода называют относительной массой.
Видео:Формулы по молекулярной физике #умскул #10класс #МКТ #ЕГЭ #подготовка #физикаСкачать

Основные положения молекулярно-кинетической теории и их опытное обоснование
Нас окружают разнообразные предметы. Мы можем увидеть, что это либо твердые тела, либо жидкости, либо газы. Возникает масса вопросов обо всем, что нас окружает. Ответы на многие вопросы дает молекулярно-кинетическая теория.
Молекулярно-кинетическая теория – это совокупность воззрений, используемых для описания наблюдаемых и измеряемых свойств вещества на основе изучения свойств атомов и молекул данного вещества, их взаимодействия и движения.
Основные положения молекулярно-кинетической теории
Все тела состоят из частиц – атомов, молекул, ионов.
Все частицы находятся в непрерывном хаотическом тепловом движении.
Между частицами любого тела существуют силы взаимодействия – притяжения и отталкивания.
Таким образом, в молекулярно-кинетической теории объектом исследования является система, состоящая из большого количества частиц – макросистема. Для объяснения поведения такой системы законы механики не применимы. Поэтому основным методом исследования является статистический метод изучения свойств вещества.
Для объяснения и предсказания явлений важно знать основные характеристики молекул:
Оценка размера молекулы может быть сделана как размер кубика a в котором содержится одна молекула, исходя из плотности твердых или жидких веществ и массы одной молекулы:
- Масса молекул
Отношение массы вещества m к числу молекул N в данном веществе:
- Относительная молекулярная масса
Отношение массы молекулы (или атома) данного вещества к 1/12 массы атома углерода:
- Количество вещества
Количество вещества равно отношению числа частиц N в теле (атомов – в атомарном веществе, молекул – в молекулярном) к числу молекул в одном моле веществаNА:
- Постоянная Авогадро
Количество молекул, содержащихся в 1 моль вещества.
- Молярная масса
Молярной массой вещества называют массу вещества, взятого в количестве 1 моля.
В Международной системе единиц молярная масса вещества выражается в кг/моль.
- Взаимодействие (количественно на основе опытов)
Для взаимодействия молекул характерно одновременно и притяжение, и отталкивание: на расстояниях r r0 – притяжение, причем оно быстро убывает. На расстоянии r0 система двух молекул обладает минимумом потенциальной энергии (сила взаимодействия равна нулю) – это состояние устойчивого равновесия
Молекулярно-кинетическая теория дает возможность понять, почему вещество может находиться в газообразном, жидком и твердом состояниях. С точки зрения МКТ агрегатные состояния различаются по значению среднего расстояния между молекулами и характеру движения молекул друг относительно друга.
Основные положения молекулярно-кинетической теории неоднократно подтверждались различными физическими экспериментами. Например, исследованием:
Б) Броуновского движения
Видео:Все формулы молекулярной физики, МКТ 10 класс, + преобразования и шпаргалкиСкачать

Краткие итоги
Молекулярно-кинетическая теория объясняет строение и свойства тел на основе движения и взаимодействия атомов, молекул и ионов. В основе МКТ лежат три положения, которые полностью подтверждены экспериментально и теоретически:
1) все тела состоят из частиц – молекул, атомов, ионов;
2) частицы находятся в непрерывном хаотическом тепловом движении;
3) между частицами любого тела существуют силы взаимодействия – притяжения и отталкивания.
Молекулярное строение вещества подтверждается непосредственным наблюдением молекул в электронных микроскопах, а также растворением твердых веществ в жидкостях, сжимаемостью и проницаемостью вещества. Тепловое движение – броуновским движением и диффузией. Наличие межмолекулярного взаимодействия прочностью и упругостью твердых тел, поверхностным натяжением жидкостей.
Видео:Жумагулова А.К. Основные положения молекулярно-кинетической теории газов и ее опытное обоснование"Скачать
Основные положения молекулярно-кинетической теории

Средняя оценка: 4.4
Всего получено оценок: 80.
Средняя оценка: 4.4
Всего получено оценок: 80.
Одним из видов энергии в природе является внутренняя тепловая энергия. Природа этой энергии изучается в рамках теории, которая называется молекулярно-кинетической (МКТ). Познакомимся с основными положениями молекулярно-кинетической теории.
Видео:Тема 1. Основные положения молекулярно-кинетической теории (МКТ) и их опытное обоснование. МассаСкачать

Возникновение молекулярно-кинетической теории
Первые представления о том, что тепло — это движение мельчайших неделимых частиц вещества, высказывались еще в античности. В учении Левкиппа и Демокрита движение атомов являлось причиной всего сущего.

Однако античные взгляды были в основном умозрительны и не основывались на исследованиях и опытах. Первые научные эксперименты, послужившие основой будущей теории, были проведены в начале эпохи Возрождения, а окончательную научную форму МКТ начала принимать лишь в XVIII в.
Вначале была популярна идея об особом «тепловом флюиде», флогистоне или теплороде, который содержится в горючих веществах и высвобождается при горении. Флогистон рассматривался как одна из составляющих вещества. Составлялись специальные таблицы, описывающие движение флогистона. То, что масса вещества при горении увеличивается, приписывалось отрицательной массе флогистона.
Однако результаты исследований Г. Кавендиша, А. Лавуазье, М. Ломоносова полностью опровергли теорию флогистона и положили начало молекулярной теории тепла. Согласно М. Ломоносову, все вещества состоят из мельчайших частиц-молекул, а тепло — это вращательное движение этих частиц.
В конце концов, в результате исследований строения вещества основные положения молекулярно-кинетической теории приняли современный вид. Эти положения гласят:
- вещество состоит из мельчайших частиц-молекул;
- молекулы находятся в хаотическом движении;
- тепловые явления — это результат взаимодействия молекул.

Видео:Урок 145. Идеальный газ. Основное ур-ние МКТ ид. газа - 1Скачать

Доказательства положений МКТ
Первоначально опытные обоснования утверждений МКТ были косвенными. Например, конечность растекания масла по поверхности воды говорит о том, что можно оценить размер молекул, зная объем капли масла и площадь максимального растекания.
Диффузные явления (самопроизвольное смешивание газов и жидкостей) также можно объяснить лишь тем, что частицы вещества находятся в постоянном движении, и это движение связано с температурой, поскольку диффузия при увеличении температуры ускоряется.
Наконец, был открыт закон постоянных отношений Д. Дальтона, который говорит, что отношения масс элементов, участвующих в химических реакциях, всегда имеют целые значения. Его также можно объяснить, только если предположить, что вещества состоят из молекул, каждая из которых имеет строго определенное количество атомов элементов.
Но прямое доказательство положений МКТ было получено в 1827 г. английским ботаником Р. Броуном. Он наблюдал под микроскопом взвесь пыльцы растений и обнаружил, что частицы находятся в постоянном хаотическом движении, зависящем от температуры.
Броуновское движение доказывает сразу все три положения МКТ. Движение броуновских частиц возможно, только если предположить, что они окружены мельчайшими частицами жидкости, которые способны двигаться и взаимодействовать, передавая механический импульс броуновским частицам и друг другу. При этом, поскольку интенсивность броуновского движения увеличивается с температурой, то скорость молекул также зависит от температуры, и ее можно оценить, используя специальные формулы.
Видео:Идеальный газ в молекулярно-кинетической теории | Физика 10 класс #28 | ИнфоурокСкачать

Что мы узнали?
Основные положения молекулярно-кинетической теории гласят: все вещества состоит из мельчайших частиц-молекул, которые находятся в постоянном хаотичном движении и при этом взаимодействуют друг с другом. Все тепловые явления — это результат такого взаимодействия. Главным доказательством этого является броуновское движение.
📸 Видео
Физика. 10 класс. Основные положения молекулярно-кинетической теории газов /16.11.2020/Скачать

Основные положения МКТ и их опытное обоснование. Физика 10 классСкачать

Физика. МКТ: Основное уравнение МКТ. Центр онлайн-обучения «Фоксфорд»Скачать