Осмотическое давление растворов биополимеров.
Уравнение Галлера
Для растворов полимеров, как и для растворов низкомолекулярных веществ, характерны коллигативные свойства: осмос, диффузия. Отличительной особенностью растворов полимеров является то, что экспериментально определенное осмотическое давление для раствора ВМС заданной концентрации значительно превышает вычисленное по закону Вант-Гоффа. Это связано с тем, что макромолекула благодаря большим размерам и гибкости цепи ведет себя в растворе как несколько более коротких молекул. Поэтому роль кинетического элемента играет не вся макромолекула, а отдельные ее сегменты, обладающие относительной подвижностью. Число подвижных сегментов взрастает с увеличением гибкости цепи макромолекулы и с ростом концентрации ВМС в растворе. Для расчета осмотического давления растворов ВМС используют уравнение Галлера:
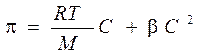
где С – массовая концентрация ВМС в растворе, г/л; М – средная молярная масса ВМС, г/моль; β – коэффициент, учитывающий гибкость и форму макромолекулы.
При небольших концентрациях полимера ( 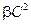
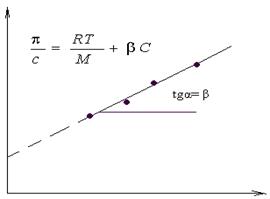
Экспериментальное изучение влияние концентрации ВМС в растворе на его осмотическое давление позволяет с помощью графической зависимости величины π/C от С определить значение средней молекулярной массы полимера М и коэффициента β, который численно равен тангенсу угла наклона прямой в координатах π/C=f(С).
В сложных биологических системах, содержащих неэлектролиты, электролиты и белки, каждый из этих компонентов вносит свой вклад в суммарное осмотическое давление. Вклад, обусловленный наличием белков, называется онкотическим давлением.
|
|
Рис 2 Определение средней молекулярной массы полимера.
Вопрос 6. Устойчивость растворов биополимеров: высаливание, застудневание, коацервация и их роль в
застудневание. В результате ограниченного набухания ВМС или частичного испарения растворителя из раствора ВМС образуются студни. Студень можно рассматривать или как ограниченно набухший полимер или концентрированный раствор полимера. В достаточно концентрированных растворах за счет сцепления макромолекул между собой могут образовываться постоянные пространственные сетки, благодаря чему раствор превращается в студень. На процесс застудневания влияют:
1. концентрация растворов (с увеличением концентрации раствора застудневание ускоряется);
2. форма частиц или молекул (линейные молекулы застудневают легче, чем клубкообразные);
3. температура (с понижением температуры застудневание облегчается).
4. действие электролитов и ПАВ (небольшие концентрации электролитов способствуют ускорению застудневания);
5. время (от нескольких минут до недель);
При старении студней происходит самопроизвольное выделение жидкости, сопровождающееся уплотнением пространственной сетки и возникновением и упрочнением новых контактов между макромолекулами. Такой процесс называется синерезисом. Пример синерезиса – отделение сыворотки при свертывании крови.
Студни, в отличие от гелей, не обладают тиксотропией – способностью восстанавливать свою структуру во времени после ее разрушения. Это означает, что образование геля из золя обратим (золь↔гель), тогда как получение раствора ВМС из студня невозможен.
В студнях, как и в растворах, могут протекать химические реакции. Скорость диффузии ионов и молекул в студнях зависит от концентрации студня. В 1886 г. Р. Лизеганг наблюдал образование осадка Ag2Cr2O7 в студне желатина, пропитанного раствором К2Cr2O7. Если в центр пластины желатина ввести раствор AgNO3, то реакция между бихромат-ионами и ионами серебра будет протекать не только в месте введения раствора, а по всей пластине. При этом наблюдается чередование полос: красноватые кольца бихромата серебра и неокрашенные кольца геля. По мере удаления от места введения реагента растет ширина неокрашенных колец, а интенсивность окраски уменьшается. Наблюдается периодическая реакция.
Для образования осадка серебра бихромата необходимо достижение насыщения раствора этим веществом. При выпадении осадка ближайшее пространство обедняется ионами серебра больше, чем бихромат-ионами согласно стехиометрии ионной реакции. Поэтому ионы Cr2O7 2– продолжают диффундировать по студню, не находя достаточного количества Ag + , и осадок не образуется. Таким образом, за окрашенным кольцом следует неокрашенное.
Периодические (колебательные) реакции лежат в основе ряда биологических процессов: генерации нервных импульсов, мышечного сокращения, генерации биоритмов, образовании почечных и других камней.
Высаливание.Под высаливанием ВМС понимают выделение полимера из раствора при введении электролитов и неэлектролитов. Снижение устойчивости раствора ВМС происходит при уменьшении лиофильности полимера, что может быть достигнуто при введении не только добавлением хорошо гидратируемых ионов (рассмотрено выше), но и растворителя-неэлектролита, в котором полимер растворим хуже, чем в воде. Например, желатин, растворенный в воде, будет высаливаться при добавлении этанола.
В случае разбавленных растворов молекулы полимеров не связаны друг с другом. В концентрированных растворах макромолекулы могут взаимодействовать за счет возникновения водородных связей, электростатических сил и образовывать рои или ассоциаты. С увеличением концентрации и понижением температуры размеры и длительность существования ассоциатов макромолекул увеличивается. При определенных условиях ассоциаты становятся настолько большими и прочными, что их можно рассматривать как новую фазу, в результате чего раствор расслаивается, что может проявиться в коацервации – выделении новообразовавшейся фазы в виде мельчайших капель, обогащенных полимером. В результате одна из фаз системы – раствор ВМС в растворителе, а другая – раствор растворителя в ВМС. Если растворителем является полярная жидкость, например вода, то мельчайшие капельки могут приобретать электрический заряд (это доказывается их способностью к электрофорезу), что придает этим термодинамически неравновесным системам некоторую устойчивость. Такие системы, называемые коацерватами, близки по свойствам к типичным эмульсиям и играют важную роль в живых организмах. Согласно одной из теорий происхождения жизни на земле (А.И. Опарин) коацерваты являются зародышами древних форм жизни. Обычно при длительном стоянии системы, в которой произошла коацервация, образуются два гомогенных жидких слоя, состоящих из фаз с различным содержанием ВМС. Коацервацию используют при микрокапсулировании лекарств. Для этого лекарственное вещество диспергируют в растворе полимера, а затем, изменяя температуру или рН среды, испаряя часть растворителя или вводя высаливатель, выделяют из раствора фазу, обогащенную полимером. Мелкие капли этой фазы отлагаются на поверхности капсулированных частиц, образуя сплошную оболочку. Микрокапсулирование лекарств обеспечивает устойчивость, пролонгирует действие, маскирует неприятный вкус лекарств. В научных исследованиях микрокапсулы могут использоваться как модели живой клетки.
Дата добавления: 2016-11-04 ; просмотров: 6146 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Видео:3 6 Осмос Коллигативные свойства растворовСкачать

Осмотическое давление растворов ВМС. Уравнение Галлера
Экспериментально определенное осмотическое давление для растворов многих ВМС данной концентрации значительно превышает вычисленное по уравнению Вант-Гоффа: p = СRT, причина в высокой подвижности фрагментов ВМС, одна макромолекула по влиянию на осмотическое давление ведет себя как несколько молекул меньшего размера. Для расчета осмотического давления растворов ВМС применяют уравнение Галлера:
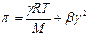 , где , где | γ – массовая концентрация раствора ВМС, г/л; М – молярная масса ВМС, г/моль; b – коэффициент, учитывающий гибкость и форму макромолекул в растворе. |
Осмометрический метод применяется при определении молярной массы полимеров.
14. Онкотическое давление плазмы крови. Онкотическое давление крови – часть осмотического давления, создаваемая растворенными в ней белками (альбумины, глобулины). Доля онкотического давления составляет 0,5% от суммарного осмотического давления. В артериальной части капилляров гидростатическое давление больше онкотического, в венозной меньше (рис. 7 ).
Рис. 4. Осмотическое равновесие
В артериальной части тканевых капилляров гидростатическое давление крови способствует, а онкотическое давление крови препятствует выходу воды из крови. В венозной части капилляров происходит осмос воды из ткани в кровь. Онкотическое давление способствует, а гидростатическое давление препятствует вхождению воды в кровь.
15. Изоэлектрическая точка и методы ее определения ИЭТ или pI.
Полиэлектролиты. Полиамфолиты. Изоэлектрическое состояние.
| R ¾ NH3 + ï СООН | -Н ® +Н | R ¾ NH3 + ï СОО — | -Н ® +Н | R ¾ NH2 ï СОО — |
| рН ИЭТ | ||||
| макрокатион | макромолекула | макроанион |
Рис.5. Полиамфолиты в разных средах.
Методы определения ИЭТ:
Прямые методы – электрокинетические методы, например электрофорез. При этом определяют рН раствора белка, при котором электрофоретическая подвижность частиц минимальна. Изоэлектрическая точка большинства белков меньше 7: для желатина ИЭТ равна 4,7, для казеина — 4,6, для глобулина — 5,4, для пепсина – 1, что говорит о преобладании кислых аминокислот.
 | 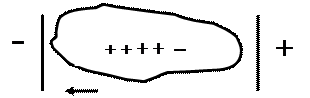 | |||||||||||
| рН > ИЭТ макроанион | рН
равновесие Доннана описывается уравнением:
17. Высаливание биополимеров из раствора.Лиотропные ряды: Li > Na K > Rb > Cs > Mg 2+ > Ca 2+ > Sr 2+ > Ba 2+ Видео:Осмос и осмотическое давлениеСкачать  Глава V. Физико-химия растворов биополимеровФИЗИКО-ХИМИЯ РАСТВОРОВ БИОПОЛИМЕРОВ В состав организмов входят различные высокомолекулярные природные соединения (ВМС), называемые биополимерами. К ним относятся белки, нуклеиновые кислоты и полисахариды. Белки – важнейший класс биологически активных веществ. Они играют ключевую роль в клетке, присутствуют в виде главных компонентов в любых формах живой материи, будь то микроорганизмы, животные или растения. Относительная молекулярная масса белков варьирует в пределах от 5 000 до 1 000000 и более. Сравнительно небольшие молекулы белковой природы с относительной молекулярной массой до 5000 называются пептидами. Главной функцией белков-ферментов является катализ биохимических реакций. Ферменты участвуют в тысячах превращений, происходящих в живой клетке и составляющих основу ее метаболизма. Из гормонов-белков в первую очередь следует назвать инсулин, паратирин, гормон роста, пролактин, гонадотропин, лютеинизирующий и фолликулостимулирующий гормоны, тиреотропин. Значительное количество известных гормонов представляют собой пептиды. К ним относятся окситоцин, вазопрессин, адренокортикотропный гормон, глюкагон, гастрин, секретин, холецистокинин, кальцитонин, брадикинин, ангиотензин и т. д. Большую группу составляют так называемые транспортные белки, т. е. белки, участвующие в переносе различных веществ, ионов и т. п. К ним относятся цитохром С (участвует в транспорте электронов), гемоглобин (переносит кислород), сывороточный альбумин (осуществляет транспорт жирных кислот в крови), b-липопротеин (транспорт липидов), церулоплазмин (транспорт меди в крови) и т. д. Так называемые защитные белки объединяют вещества белковой природы, помогающие организму преодолевать патологические состояния или бороться с возбудителями заболеваний. Это иммуноглобулины, лимфокины, монокины. В эту группу можно включить и белки, вызывающие свертывание крови (фибриноген, фибрин, тромбин). Из рецепторных белков следует, безусловно, упомянуть родопсин зрительного аппарата животных, способный воспринимать и преобразовывать световые сигналы. В настоящее время интенсивно изучаются рецепторы различных гормонов, факторов роста, нейромедиаторов и т. д. Среди структурных белков необходимо прежде всего отметить макромолекулы, составляющие остов многих тканей и органов и определяющие их механические свойства: коллаген соединительных тканей, костей и суставов, эластин связок, a — кератин кожи, волос, ногтей. Родственный класс составляют так называемые “двигательные” белки. Из них наиболее известны белки сократительного аппарата мышц – актин и миозин. Наконец, следует сказать о группе запасных белков. В ее состав входят овальбумин яичного белка, казеин молока, глиадин пшеницы, а также ферритин («депо» железа в селезенке) и др. Нуклеиновые кислоты – важнейшие биополимеры, осуществляющие хранение и передачу генетической информации в живой клетке. Существуют два различных типа нуклеиновых кислот – дезоксирибонуклеиновые кислоты (ДНК) и рибонуклеиновые кислоты (РНК). В эукариотических клетках основная масса ДНК располагается в клеточном ядре. Что же касается РНК, то в клетках имеются матричные (мРНК), рибосомные (рРНК) и транспортные (тРНК) РНК. Молекулы РНК переводят генетический текст в определенную аминокислотную последовательность белка. Полисахариды (гликаны), также как белки и нуклеиновые кислоты, являются биополимерами, образующими макромолекулярную основу живых систем. Это наиболее распространенные в природе органические соединения. В растительном организме они осуществляют главным образом опорную функцию (целлюлоза) и, кроме того, образуют резервные вещества (крахмал, инулин), а в животном организме служат основными резервными веществами (гликоген) и также выполняют ряд специфических функций. Вместе с тем известны смешанные биополимеры, например, гликопротеиды (белки, содержащие ковалентно связанный углеводный компонент), липопротеиды (надмолекулярные структуры, в которых белковый и липидный компоненты соединены нековалентно), липополисахариды (полисахариды, содержащие ковалентно связанные жирные кислоты). Высокомолекулярные соединения широко применяются в самых различных областях техники, в быту, в медицине. В частности, они используются при изготовлении протезов искусственных сосудов, клапанов сердца, хрусталиков, биологических клеев, диализных мембран, перевязочных и тампонажных материалов. Создание полимеров медико-биологического назначения – важное направление в современной химии полимеров. Для развития этого направления требуется самое тесное сотрудничество специалистов в области материаловедения, клинической медицины и различных фундаментальных биологических наук. Биополимеры вызывают интерес главным образом благодаря их реакциям в животных организмах, где они выполняют свои специфические функции как вещества, растворенные в воде. Поэтому в данном пособии рассматриваются водные растворы биополимеров. Классификация и химическое строение ВМС К высокомолекулярным соединениям относятся полимерные соединения, молекулы которых состоят из большого числа повторяющихся, одинаковых или различающихся, атомных группировок (мономерных звеньев), соединенных ковалентными связями в цепи. Относительная молекулярная масса ВМС колеблется в пределах от нескольких тысяч до многих миллионов. Поэтому их молекулы часто называют макромолекулами. По строению цепи их делят на полимеры с линейной структурой (полистирол, полиамиды, целлюлоза), разветвленные (амилопектин крахмала, гликоген, декстран, желатин и др.) и пространственные (сетчатые) полимеры (резины, фенолформальдегидные смолы, пластмассы и др.). По происхождению все высокомолекулярные вещества можно разделить на синтетические, искусственные и природные. Синтетические – получают путём синтеза из низкомолекулярных веществ (полиэтилен, полистирол, бутадиеновый каучук, хлоропреновый каучук и т. д.). Искусственные получают путём переработки природных ВМС (эфиры целлюлозы и др.). Природные ВМС представляют собой вещества растительного и животного происхождения (целлюлоза, натуральный каучук, белки, нуклеиновые кислоты, полисахариды). Медиков, в первую очередь, интересуют такие природные ВМС, как нуклеиновые кислоты, белки и полисахариды, часто называемые биополимерами. Нуклеиновые кислоты состоят из нуклеотидов, соединенных фосфорно-диэфирной связью. Каждый нуклеотид в свою очередь состоит из остатков гетероциклического основания, углевода и фосфорной кислоты. пурин аденин гуанин пиримидин урацил тимин цитозин Аденин и гуанин входят в состав ДНК и РНК, тимин и цитозин — в состав ДНК, урацил и цитозин — в состав РНК. Указанные гетероциклические основания образуют с D-рибозой и 2-дезокси-D-рибозой посредством гликозидной связи нуклеозиды (N-гликозид) : Эта связь устанавливается между атомом углерода С-1 рибозы или дезоксирибозы (атом углерода, ранее входивший в состав карбонильной группы) и атомом азота гетероциклического кольца (N-9 – в пуринах либо N-1 в пиримидинах). В зависимости от природы углеводного остатка различают рибонуклеозиды и дезоксирибонуклеозиды. Фосфорная кислота, этерифицируя гидроксил при С-5 или С-3 в остатке рибозы (рибонуклеозиды) или дезоксирибозы (дезоксирибонуклеозиды), образует нуклеотид. Последний является мономерной единицей полимерных молекул ДНК и РНК. Мономерные нуклеотидные звенья связываются между собой через фосфатную группу, которая образует две сложноэфирные связи: с С-3 предыдущего и с С-5 последующего нуклеотидных звеньев: Каркас простой полинуклеотидной цепи состоит из чередующихся пентозных и фосфатных остатков, а гетероциклические основания являются “боковыми” группами, присоединенными к пентозным остаткам. Нуклеотид со свободной 5 – ОН группой называется 5-концевым, нуклеотид со свободной 3–ОН группой – 3-концевым. Принцип построения цепи РНК такой же, как у ДНК, за исключением двух особенностей: пентозным остатком в РНК служит D-рибоза, а в наборе гетероциклических оснований используется не тимин, а урацил. Первичная структура нуклеиновых кислот определяется последовательностью нуклеозидных звеньев, ковалентно связанных в непрерывную цепь полинуклеотида. Вторичная структура представляет собой пространственную организацию полинуклеотидной цепи. Согласно модели Уотсона-Крика, молекула ДНК состоит из двух полинуклеотидных цепей, правозакрученных вокруг общей оси в виде двойной спирали. Причем пуриновые и пиримидиновые основания направлены внутрь спирали. Двойная спираль стабилизируется водородными связями (полинуклеотид имеет сахаро-фосфатный остов). Белки представляют собой биополимеры, структурными звеньями которых являются a-аминокислоты. Для последних характерно следующее строение: Белковая цепь формируется путем поликонденсации аминокислот: при соединении двух аминокислотных звеньев образуется пептидная связь –СО–NH– и выделяется молекула воды. Все белки в природе состоят из 20 аминокислот. Последовательность аминокислотных остатков в цепи называется первичной структурой белка: Конструкция полипептидной цепи у всех белков одинакова. Эта цепь имеет неразветвленное строение и состоит из чередующихся пептидных (амидных) –СО–NH– и метиновых (СН) групп. Один конец цепи, на котором находится аминокислота со свободной NH2–группой называют N–концом, другой, на котором находится аминокислота со свободной СООН–группой, С–концом. Важнейшими ионогенными группами в белках являются амино — и карбоксильные группы. В зависимости от соотношения числа этих групп в составе белка, его заряд в нейтральной среде может быть положительным (если число NH2 – групп больше, чем СООН– групп) или отрицательным (если число NH2 — групп меньше, чем СООН– групп). В кислой среде белок заряжается положительно, в щелочной – отрицательно: Так как заряд макромолекулы белка зависит от концентрации ионов водорода в растворе, то при определенной их концентрации число ионизированных кислотных групп может быть равно числу ионизированных основных групп. Такое состояние белка называется изоэлектрическим состоянием, а значение рН среды, которое соответствует изоэлектрическому состоянию, называется изоэлектрической точкой белка (рJ или ИЭТ). В средах, где рН pJ, то молекула белка заряжается отрицательно. Полисахариды – это ВМС, образующиеся при поликонденсации моносахаридов. По химическому составу полисахариды подразделяются на: 1) гомополисахариды (состоят из структурных единиц одного типа) 2) гетерополисахариды (из структурных единиц разных типов) 3) сложные полисахариды (кроме сахаридных составляющих, содержат также несахаридные — белки, липиды). Рассмотрим только гомополисахариды – целлюлозу, крахмал и гликоген, состоящих из остатков глюкозы. Целлюлоза – полисахарид (цепь не имеет разветвлений) природного происхождения, в котором остатки b-D-глюкопиранозы связаны b-(1®4)-гликозидной связью: Крахмал представляет собой смесь двух полисахаридов, построенных из a-D-глюкопиранозы: амилозы %) и амилопектина %). В амилозе D-глюкопиранозные остатки связаны a-(1®4)-гликозидными связями. Цепь амилозы неразветвленная, включает от 200 до 1000 глюкозных остатков, ее относительная молекулярная масса Амилопектин, в отличие от амилозы, имеет разветвленное строение. В цепи D–глюкопиранозные остатки связаны a–(1®4)–гликозидными связями, а в точках разветвления a-(1®6)–гликозидными связями: Относительная молекулярная масса амилопектина варьирует в пределах от 1до 6 Гликоген – полисахарид животного происхождения. Он является аналогом растительного крахмала; по химической структуре напоминает амилопектин, но имеет еще более разветвленные цепи. Между нуклеиновыми кислотами и белками, с одной стороны, и полисахаридами, с другой, существует фундаментальное различие. Нуклеиновые кислоты и белки являются информационными молекулами. Каждая молекула нуклеиновой кислоты построена из четырех типов мононуклеотидов, располагающихся в специфической последовательности, несущей определенную информацию. Точно также белковая молекула представляет собой последовательность 20 различных аминокислот, несущая специфическую информацию. Полисахариды же не являются информационными молекулами; они построены либо из совершенно идентичных повторяющихся строительных блоков (крахмал, гликоген, целлюлоза), либо из чередующихся блоков двух типов. Структуры биополимеров. Первичной структурой полимера, состоящего из различных мономеров, является последовательность ковалентно связанных мономеров, например, последовательность аминокислот в белке или нуклеотидов — в нуклеиновой кислоте. В качестве ковалентного скелета в белках выступает система пептидных связей, в нуклеиновых кислотах – система фосфорно-диэфирных связей. Однако необходимо подчеркнуть, что для первичной структуры полимера характерна не только сама система этих ковалентных связей, но и порядок чередования мономерных единиц вдоль полимерной цепи. Вторичная, «или локальная структура» полимерной цепи формируется при вращении атомов ее небольшого отрезка вокруг ковалентных связей за счет сил взаимодействия двух соседних структурных элементов макромолекулы (силы близкодействия). Иными словами, межатомные взаимодействия во вторичной структуре представляют собой взаимодействия только ближайших соседей; взаимодействия атомов, располагающихся вдоль цепи далеко, обуславливать формирование структуры не могут. Ближние взаимодействия приводят к образованию в белках a-спиралей и b-структур (складчатый лист), в нуклеиновых кислотах – спиралей. Формирование a-спирали означает, что плоские пептидные связи у a-углеродного атома вращаются от плоскости к плоскости постоянно. Это можно продемонстрировать следующим образом. Углы всех карт колоды прокалывают острым стержнем, а затем каждую из них поворачивают вокруг стрежня на определенный угол по отношению к карте, лежащей снизу. Образование b-структуры обусловливается вытягиванием двух участков полипептидной цепи (в некоторых случаях двух различных цепей) в линию рядом друг с другом и удерживаемых вместе водородными связями. В полинуклеотидах нуклеотидные основания, располагаясь одно над другим, несколько поворачиваются. В ДНК каждая из двух полинуклеотидных цепей вытянута вследствие межплоскостного взаимодействия и связаны между собой водородными связями в виде двойной спирали. Вторичная структура белков и нуклеиновых кислот стабилизируется нековалентными внутримолекулярными взаимодействиями, преимущественно водородными связями. Третичная структура обуславливается расположением всех атомов полимерной цепи, отдельные отрезки которой имеют свою локальную вторичную структуру и специфическим образом упакованы в пространстве. Эта структура образуется благодаря дальним взаимодействиям. В частности, у глобулярных белков основной вклад в ее формирование вносят гидрофобные взаимодействия между неполярными боковыми радикалами аминокислотных остатков. Четвертичную структуру обусловливают несколько объединенных полипептидных цепей (субъединиц), функционирующих как единое целое, не связанных между собой ковалентно и обладающих аналогичной структурой. Четвертичная структура указывает и на взаимное пространственное расположение этих субъединиц, связывающихся друг с другом посредством нековалентных межмолекулярных взаимодействий. Примером белков с четвертичной структурой является гемоглобин, состоящий из 4 субъединиц (двух a — и двух b — полипептидных цепей). Понятие о нативных и денатурированных структурах. Термин «нативная структура» общепринят, но ему трудно дать определение. Он может означать либо структуру макромолекулы в том виде, в котором она существует в природе, либо структуру макромолекулы, в которой она выделена, при условии сохранения ее способности выполнять определенную биологическую функцию (например, ферментативную активность). «Денатурированная структура» – это столь же неопределенное понятие, обычно означающее такую форму молекулы, в которой по сравнению с нативной молекулой изменена пространственная структура. С молекулярно-биологических позиций можно дать следующее определение денатурации. Денатурация – это конформационное изменение биологической макромолекулы, обуславливающее необратимую или обратимую утрату ее способности выполнять определенную биологическую функцию. В качестве денатурирующих агентов могут выступать ионы тяжелых металлов, растворы кислот и оснований, органические растворители, ионизирующие излучения, ультразвук и т. д. До середины 30-х годов ХIХ века существовали различные точки зрения на природу растворов ВМС. Одни исследователи считали, что растворы ВМС –истинные растворы, другие утверждали, что эти растворы являются типичными коллоидами, т. е. дисперсными системами. Разногласия объяснялись тем, что растворы ВМС обладают свойствами не только истинных растворов (самопроизвольность образования раствора, его термодинамическая устойчивость, молекулярная дисперсность, гомогенность), но и свойствами коллоидных растворов (неспособность молекул полимера проникать через полупроницаемую мембрану, низкое осмотическое давление, малые скорости диффузии молекул, светорассеяние). Когда же прояснился вопрос о размерах молекул ВМС, разногласия были исчерпаны. Оказалось, что свойства растворов ВМС, общие с коллоидными растворами, обусловлены соизмеримостью молекул полимеров и коллоидных частиц. Полимеры, подобно низкомолекулярным веществам, в зависимости от условий получения раствора (природа полимера и растворителя, температура и др.) могут образовывать как коллоидные, так и истинные растворы. В связи с этим принято говорить о коллоидном или истинном состоянии вещества в растворе. Мы не будем касаться систем «полимер – растворитель» коллоидного типа. Рассмотрим только растворы полимеров молекулярного типа. Следует отметить, что вследствие больших размеров молекул и особенностей их строения, растворы ВМС обладают рядом специфических свойств: 1. Равновесные процессы в растворах ВМС устанавливаются медленно. 2. Процессу растворения ВМС, как правило, предшествует процесс набухания. 3. Растворы полимеров не подчиняются законам идеальных растворов, т. е. законам Рауля и Вант-Гоффа. 4. При течении растворов полимеров возникает анизотропия свойств (неодинаковые физические свойства раствора в разных направлениях) за счет ориентации молекул в направлении течения. 5. Высокая вязкость растворов ВМС. 6. Молекулы полимеров, благодаря большим размерам, проявляют склонность к ассоциации в растворах. Время жизни ассоциатов полимеров более длительное, чем ассоциатов низкомолекулярных веществ. Термодинамика растворения ВМС. С термодинамической точки зрения растворение полимера, как любой самопроизвольный процесс, должен протекать с уменьшением свободной энергии системы (DG 0 (увеличение энтропийного фактора). Растворение полярного полимера в полярном растворителе (неполярного – в неполярном) чаще всего сопровождается уменьшением внутренней энергии системы, так как растворение идет с выделением теплоты (DН 0). В макромолекулах полярных ВМС, обычно обладающих жесткими цепями (поливиниловый спирт, белки), число возможных конформаций в растворе уменьшается, вследствие чего для этих полимеров возрастает значение энтальпийного фактора, т. е гидратация макромолекул. Из выше сказанного следует, что образование растворов ВМС сопровождается уменьшением свободной энергии Гиббса. Следовательно, процесс растворения в данном случае идёт самопроизвольно и образующийся раствор будет термодинамически устойчив. Набухание и растворение полимеров. Процесс растворения ВМС протекает самопроизвольно, но в течение длительного времени, и ему часто предшествует набухание полимера в растворителе. Полимеры, макромолекулы которых имеют симметричную форму, могут переходить в раствор, предварительно не набухая. Например, гемоглобин, печеночный крахмал – гликоген при растворении почти не набухают, а растворы этих веществ не обладают высокой вязкостью даже при сравнительно больших концентрациях. В то время, как вещества с сильно асимметрическими вытянутыми молекулами при растворении очень сильно набухают (желатин, целлюлоза, натуральный и синтетические каучуки). Набухание – это увеличение массы и объема полимера за счет проникновения молекул растворителя в пространственную структуру ВМС. Причиной набухания является большая разница в размерах молекул растворяемого вещества и растворителя и, как следствие этого, большое различие в скоростях их диффузии. Поэтому при набухании вначале происходит практически односторонняя диффузия молекул растворителя в пространственную сетку полимера, имеющая ту же природу, что и осмос растворителя в осмотическую ячейку через поры полупроницаемой мембраны. Оба процесса вызываются стремлением системы к выравниванию концентраций компонентов. Механизм набухания сводится к проникновению молекул растворителя в ближайшие слои полимера и сольватации соответствующих участков полимерной цепи. В результате этого макромолекулы «разрыхляются», что облегчает дальнейшее проникновение молекул растворителя и увеличение массы и объема полимера. Различают два вида набухания: неограниченное, заканчивающееся полным растворением ВМС (например, набухание желатины в воде, каучука в бензоле, нитроцеллюлозы в ацетоне) и ограниченное, приводящее к образованию набухшего полимера – студня (например, набухание целлюлозы в воде, желатина в холодной воде, вулканизованного каучука в бензоле). Студень представляет собой пространственную сетку, состоящую из связанных между собой макромолекул полимера и заполненную молекулами растворителя. Степень ограниченности процесса набухания и возможность самопроизвольного растворения определяются соотношением энергии связи в решетке полимера и энергии сольватации полимерной цепи с учетом энтропийного фактора. Весь процесс набухания и растворения ВМС можно условно разделить на ряд стадий (рис. 43). Рис 43. Последовательные стадии (а – г) растворения ВМС в низкомолекулярной жидкости На начальной стадии (рис.43а) система состоит из двух компонентов: полимера и низкомолекулярной жидкости. Переход а®б характеризуется интенсивным проникновением молекул низкомолекулярной жидкости в структуру полимера и сольватацией полимерной цепи, сопровождающийся выделением теплоты (DН Na+ > K+ > Rb+ > Cs+ Подобный же ряд анионов имеет вид: SO42–> CH3COO– > Cl– > NO3– > Br– > I– > CNS– Следует отметить, что обычно более сильный высаливающий эффект вызывают анионы. Высаливание полимера путем добавления неэлектролитов принципиально не отличается от выделения ВМС из раствора электролитом. Обычно это жидкость, которая растворяет полимер хуже, чем растворитель. Например, для белка – это спирт, а для каучука – ацетон. Высаливание является одним из методов фракционирования высокомолекулярных веществ, поскольку способность этих соединений выделяться из раствора весьма сильно зависит от их химической природы и резко возрастает с увеличением относительной молекулярной массы. Особенно широкое применение фракционирование с помощью высаливания приобрело для разделения белков. Чаще всего для высаливания белков используется сульфат аммония. Эта соль отличается хорошей растворимостью, мало изменяющейся при понижении температуры. Применяя водные растворы сульфата аммония разной концентрации, добиваются фракционированного осаждения белков: белки с большей относительной молекулярной массой осаждаются при добавлении растворов сульфата аммония малых концентраций и наоборот. При этом высаливание электролитом часто сочетают с введением в систему неэлектролита и охлаждением раствора. Высаливание белков целесообразно проводить при значении pH среды, близком к изоэлектрической точке. При значениях рН больше или меньше ИЭТ возрастает заряд, вследствии чего молекулы растворителя активнее разрыхляют полимерную сетку, увеличивая устойчивость системы. Застудневание. Ранее указывалось, что при ограниченном набухании образуется студень, который представляет собой пространственную сетку из макромолекул полимера, заполненную молекулами растворителя. Однако, может происходить и обратный процесс, когда раствор полимера переходит в состояние студня. Этот процесс называется застудневанием или желатинированием. Сетчатые (пространственные) структуры формируются в студнях в результате возникновения водородных связей, электростатических взаимодействий или более прочных химических связей между различными участками макромолекул. Если эти связи в студне являются водородными или электростатическими, то прочность его мала и он легко разрушается. Примером таких систем служат студни желатины и агар-агара. Процесс застудневания протекает в течение определенного промежутка времени не только при комнатной температуре, но и при более низких температурах. Время, необходимое для формирования рыхлых сетчатых структур студней, называется периодом созревания. На процесс застудневания существенно влияют размеры и разветвленность макромолекул полимеров. Особенно легко образуют студни высокомолекулярные соединения, у которых длина макромолекул достигает несколько тысяч ангстрем и в тысячи раз превышает их поперечные размеры. Более концентрированные растворы ВМС при прочих равных условиях легче дают студни, чем разбавленные. Например, растворы желатины с массовой долей ее 2% и более легко превращаются в студни при комнатной температуре. Растворы с меньшей массовой долей (0,5–1%) образуют не устойчивые студни, которые плохо сохранят форму; а еще более разбавленные не желатинируются вовсе. Зависимость процесса образования студня от концентрации объясняется тем, что в более концентрированных растворах уменьшается расстояние между макромолекулами и поэтому увеличивается число их столкновений и облегчается образование структур за счет их сцепления активными центрами. Повышение температуры способствует усилению поступательного и колебательного движения макромолекул и благоприятствует разрыву связей между ними, что затрудняет застудневание. При понижении температуры ускоряется агрегация макромолекул полимера и процесс застудневания идет легче. Поэтому растворы, не застудневающие при комнатной температуре, в случае ее понижения образуют твердые студни. Электролиты по-разному влияют на скорость застудневания: одни – ускоряют, другие – замедляют, а некоторые – даже исключают возможность перехода ВМС в студень. На застудневание главным образом влияют анионы. Экспериментально установлено, что соли серной и уксусной кислот ускоряют процесс застудневания, хлориды и иодиды замедляют, а роданиды приостанавливают его. По мере уменьшения действия анионов на процесс застудневания они располагаются в следующий ряд: Различия в указанных свойствах электролитов объясняются степенью их гидратации, которая уменьшается у анионов слева направо в этом ряду. Замедляющее действие анионов на процесс застудневания наблюдается, начиная с хлорид-иона. Застудневание лучше всего протекает при рН раствора, соответствующем изоэлектрической точке белка. Студни являются гомогенными системами, которые обладают упругими свойствами, нетекучи и способны сохранять форму. Упругость студней определяяется прочностью и гибкостью макромолекулярной сетки, а также свойствами ориентированных слоев молекул растворителя. Особенно характерно это для полярных макромолекул в водной среде. Гидратные оболочки, окружающие полярные группы, создают упругую водную сетку. Таким образом, жидкость, заполняющую сетку студня, можно условно разделить на две части: “свободную” и “связанную”, входящую в состав сольватных оболочек. Связанная вода обладает особыми свойствами: большей плотностью, пониженной температурой замерзания (до –150), потерей растворяющей способности и т. д. Связанная вода студней играет большую роль в нашей жизни, по-скольку присутствие ее в почве, растениях, во всех живых организмах обеспечивает морозоустойчивость, поддерживает “водные запасы”, определяет морфологические структуры клеток и тканей. При старении студни теряют гомогенность. Это явление называют синерезисом. Он сопровождается уплотнением пространственной структурной сетки и уменьшением объема студня за счет выделения жидкой фазы. Примеры синерезиса – отделение сыворотки при свертывании крови, при скисании молока и др. Студни не способны восстанавливать свою структуру. Из-за наличия пространственной сетки в студнях отсутствует перемешивание. Поэтому в них реагирующие вещества соприкасаются в результате медленной диффузии и химические реакции имеют свои особенности, в частности, специфически протекают реакции осаждения. Например, если в студень желатины заранее ввести некоторое количество дихромата калия, а затем добавить более концентрированный раствор нитрата серебра, то возникает окрашенный осадок дихромата серебра: K2Cr2O7 + 2AgNO3 ® Ag2Cr2O7¯ + 2KNO3 При стоянии в результате диффузии нитрата серебра осадок распространяется в глубь студня, но не сплошной массой: возникают периодические зоны осадка, отделенные друг от друга совершенно прозрачными промежутками. Эти реакции получили название периодических. Их впервые наблюдал немецкий химик Р. Лизенганг (1886). Периодическими реакциями объясняют сложное распределение окраски многих минералов, генерацию нервных импульсов, мышечные сокращения, сложное строение камней, образующихся в почках, печени и желчном пузыре. Коацервация. При нарушении устойчивости раствора белка или полисахарида возможно образование коацервата – новой жидкой фазы, обогащенной биополимером. Коацерват может выделяться в виде капель или образовывать сплошной слой, что приводит к расслаиванию системы на две фазы. Одна из фаз представляет собой раствор ВМС в растворителе, а другая – раствор растворителя в высокомолекулярном веществе. Коацервацию можно вызвать изменением температуры, pH среды или введением низкомолекулярных веществ. Наиболее изучена коацервация белков и полисахаридов в водных растворах. считал, что коацерваты сыграли большую роль в процессах происхождения жизни на Земле. Коацервацию используют при микрокапсулировании лекарственных веществ. Для этого лекарственное вещество диспергируют в растворе полимера. В результате на поверхности лекарственного вещества формируется оболочка из адсорбированных капелек коацервата полимера. Эти капельки сливаются в сплошной слой на поверхности частиц лекарственного вещества и специальной обработкой переводятся в твердое состояние. Образовавшаяся твердая оболочка обеспечивает устойчивость, увеличивает длительность действия и устраняет неприятный вкус лекарственного вещества. Методы измерения ИЭТ белков Свойства белков в изоэлектрической точке изменяются по сравнению с их обычным состоянием, что используется для измерения ИЭТ белка. В условиях ИЭТ вязкость растворов белков, их растворимость, степень гидратации и набухания становятся минимальными, а сами белки утрачивают электрофоретическую подвижностью. В ИЭТ белковые растворы подвергаются наибольшей коагуляции и имеют самую высокую скорость желатинирования. Изоэлектрическую точку белков определяют прямыми и косвенными методами. К первым относятся методы, при которых определяется рН раствора белка, когда подвижность частичек в постоянном электрическом поле равна нулю (электрофоретические методы). Косвенные методы основаны на установлении рН раствора, при котором наблюдаются минимальные значения вязкости и степени набухания или максимальные значения скоростей желатинирования и коагуляции белка. Основные вопросы темы 1. Понятие о ВМС. Их классификация и химическое строение. Значение биополимеров. 2. Образование и свойства растворов ВМС. Отличие растворов ВМС от коллоидных растворов. Общие свойства растворов ВМС и коллоидных растворов. Специфические свойства растворов ВМС. 3. Термодинамика образования растворов ВМС. 4. Механизм набухания и растворения ВМС. Ограниченное и неограниченное набухание. Влияние различных факторов на набухание и растворение ВМС. Степень набухания. Медико-биологическое значение процессов набухания. 5. Устойчивость растворов ВМС и способы выделения биополимеров из их растворов. Денатурация. 6. Осмотическое давление растворов ВМС. Осмометрический метод определения молярной массы ВМС. Уравнение Галлера. 7. Вязкость растворов ВМС. Вискозиметрический метод определения относительной молекулярной массы ВМС. Уравнение Штаудингера. Уравнение Марка –Хаувинка – Куна. 8. Значение определения вязкости для медико-биологических исследований. 9. Белки как полиэлектролиты. Методы определения изоэлектрической точки белков. Работа 1. Изучение физико-химических свойств биополимеров Цель работы: экспериментально подтвердить зависимость степени набухания ВМС от природы растворителя и рН среды; научиться определять изоэлектрическую точку белка; изучить влияние электролитов на растворимость белков. Задание 1. Определить степень набухания резины в воде, бензине и скипидаре. Взвесьте три кусочка резины (каждый отдельно) и опустите один в бюкс с водой, другой – в бюкс с бензином, третий – в бюкс со скипидаром. Через 30 минут выньте кусочки из растворителей, отожмите между листами фильтровальной бумаги и взвесьте. Рассчитайте степень набухания по формуле (27). Полученные данные оформите в виде следующей таблицы. Сделайте вывод о зависимости набухания резины от природы полимера и растворителя. Задание 2. Определить степень набухания желатины при различных значениях рН среды. Внесите в сухие мерные пробирки на 10 мл по 0,5 мл порошка желатины и добавьте до верхней метки следующие растворы: в первую – 0,1М раствор соляной кислоты, во вторую – буферный раствор с рН 4,7, в третью – дистиллированную воду, в четвертую – 0,1М раствор гидроксида натрия. Содержимое пробирок перемешайте палочкой, которую после каждого перемешивания промывайте дистиллированной водой. Через 30 минут определите объем набухшей желатины и рассчитайте степень набухания по формуле (27). Полученные данные оформите в виде следующей таблицы. 0,1М раствор HCl 0,1М раствор NaOH Постройте график зависимости степени набухания от рН среды и сделайте вывод о влиянии рН среды на набухание желатины. Задание3. Определить изоэлектрическую точку белка. В каждую из пяти центрифужных пробирок налейте по 1 мл ацетатного буфера с рН 3,2; 4,1; 4,7; 5,3; 6,2. Добавьте по 0,5 мл раствора белка (желатины) с массовой долей его от 0,5 до 1% и по 1 мл ацетона. Содержимое пробирок тщательно перемешайте, на темном фоне отметьте степень мутности проб и качественно оцените ее по пятибалльной шкале. В случае слабо выраженной мутности в каждую пробирку внесите еще по 0,5 мл ацетона. Максимум мутности соответствует максимальной коагуляции белка, которая наблюдается в пробирке с раствором, рН которого равен ИЭТ белка. Для более четкого обнаружения максимальной коагуляции белка поместите пробирки в центрифугу и отцентрифугируйте их в течение 2–3 минут при скорости вращения 3000 об/мин. На дне пробирок появятся осадки. Надосадочную жидкость слейте быстрым опрокидыванием пробирок. К осадку добавьте по 2 мл биуретова реактива (смесь растворов сульфата меди и натрия-калия тартрата). Интенсивность фиолетовой окраски в пробах пропорциональна количеству выпавшего белка. Интенсивность окраски оцените визуально по пятибалльной шкале или измерьте оптическую плотность растворов с помощью фотоколориметра (используйте кювету с толщиной слоя 10 мм и желтый светофильтр). Результаты запишите в виде таблицы по указанному образцу. (по пятибалльной шкале или оптическая плотность в D) На основании проделанной работы определите изоэлектрическую точку желатины. Задание 4. Провести осаждение желатины из раствора методом высаливания. К раствору белка в пробирке прилейте насыщенный раствор сульфата аммония до выпадения белка в осадок. Затем, добавляя в пробирку воду, добейтесь полного растворения осадка. В выводе проанализируйте механизмы, объясняющие выпадение белка в осадок и его растворение. Работа 2. Определение относительной молекулярной массы полиглюкина вискозиметрическим методом Цель работы: определить относительную молекулярную массу полиглюкина вискозиметрическим методом. Приборы и реактивы: вискозиметр, секундомер, растворы полигюкина с его массовыми долями соответственно 0,03, 0,04, 0,05, 0,06, вода.
Полиглюкин является продуктом кислотного гидролиза нативного декстрана (С6Н10О5)n – полисахарида бактериального происхождения. Раствор полиглюкина с его массовой долей 0,06 и относительной молекулярной массой в пределах от 40 до 60 тысяч в физиологическом растворе хлорида натрия используют в качестве кровезаменителя. Порядок выполнения работы сводится к следующему. Высушенный вискозиметр Оствальда установите строго вертикально в водяном термостате при определенной температуре. В широкое колено (1) вискозиметра налейте 10 мл дистиллированной воды (растворитель). С помощью резиновой груши переведите воду в узкое колено (2) на 1–2 см выше верхней метки (3), и дайте воде свободно перейти в широкое колено вискозиметра. Как только уровень воды опустится до верхней метки, включите секундомер. Когда уровень воды опустится до нижней метки (4), выключите секундомер и запишите время истечения воды через капилляр (5). Измерение повторите не менее трех раз. Затем воду вылейте через широкое колено и вискозиметр ополосните наиболее разбавленным раствором полиглюкина. Определите время истечения через капилляр вискозиметра растворов полиглюкина, начиная с раствора наименьшей концентрации. Для каждого раствора измерения повторить не менее трех раз. Для расчетов берите среднее время истечения, рассчитанное по трем измерениям. Рассчитайте относительную, удельную и приведенную вязкости растворов по формулам (45; 34; 35). Постройте график зависимости hуд./С от концентрации С. Отрезок, отсекаемый прямой на оси ординат, отвечает характеристической вязкости [h] – см рис.49. Рассчитайте относительную молекулярную массу полиглюкина, подставляя найденное значение [h] в уравнение Марка–Хаувинка–Куна (38). Для водных растворов полиглюкина константы К и a соответственно равны 9,66×10–2 см3/г и 0,5. Все результаты измерений и расчетов запишите в виде следующей таблицы. Время истечения, с В выводе отметьте возможность применения раствора полиглюкина в качестве кровезаменителя, опираясь на найденное значение относительной молекулярной массы. 1. Укажите, какие ВМС являются биополимерами: а) белки б) крахмал в) натуральный каучук г) гликоген 2. Укажите факторы, от которых зависит заряд молекулы белка: а) концентрация ионов водорода Н+ в растворе; б) число карбоксильных и аминных групп; в) природа растворителя; г) степень ионизации функциональных групп. 3. В изоэлектрической точке белок имеет минимальные значения: а) электрофоретической подвижности; б) суммарного заряда макромолекул; в) степени гидратации; г) степени набухания. 4. Раствор белка в изоэлектрической точке имеет максимальные значения: а) осмотического давления б) вязкости в) скорости коагуляции г) скорости желатинирования 5. Укажите свойства, общие как для коллоидных растворов, так и для растворов ВМС: а) небольшая величина осмотического давления; в) растворы образуются самопроизвольно; 6. Процесс образования растворов ВМС сопровождается: а) ограниченным набуханием; б) неограниченным набуханием; в) уменьшением свободной энергии Гиббса; г) увеличением свободной энергии Гиббса. 7. Укажите, какие факторы увеличивают степень набухания: а) добавление в раствор белка сульфата натрия; б) добавление в раствор белка роданида натрия; в) уменьшение температуры; г) изменение рН раствора по отношению к ИЭТ белка 8. Укажите, какие факторы ускоряют процесс застудневания (желатинирования) раствора полимера: а) повышение температуры; б) понижение температуры; в) увеличение концентрации полимера в растворе; г) добавление в раствор полимера йодида калия. 9. Укажите, какие методы используют для очистки и выделения белков: а) денатурация; б) высаливание; в) электрофорез; г) гель-фильтрация. 10. Укажите факторы, от которых зависит значение вязкости раствора ВМС: б) концентрация ВМС; в) относительная молекулярная масса полимера; г) форма и объем макромолекулы полимера 11. Укажите методы определения относительной молекулярной массы ВМС: а) криоскопический; б) метод светорассеяния; в) осмометрический; г) вискозиметрический. 12. Укажите, какие уравнения используются для определения относительных молекулярных масс полимеров: а) Вант-Гоффа; б) Галлера; в) Штаудингера; г) Марка – Хаувинка – Куна 13. Укажите, какое допущение сделал Штаудингер при выводе своего уравнения: а) линейные макромолекулы ведут себя в растворе как жесткие б) макромолекулы в растворе свертываются в клубок; в) гибкие макромолекулы в растворе по форме приближаются г) приведенная вязкость не зависит от концентрации раствора ВМС. 14. Укажите факторы, от которых зависит характеристическая вязкость: а) природа полимера; б) относительная молекулярная масса полимера; в) концентрация полимера в растворе; г) скорость взаимного перемещения слоев жидкости. 15. Укажите, какая вязкость позволяет судить о конформационных изменениях макромолекулы ВМС: а) удельная; б) приведенная; в) характеристическая; г) относительная. Задачи и упражнения 1. Время истечения воды в вискозиметре Оствальда равно 50 с., а раствора полиглюкина с его массовой долей 2% – 72 с. Рассчитайте приведенную вязкость раствора. 2. Время истечения в вискозиметре раствора полимера с массовой долей его 1% в два раза больше, чем чистого растворителя. Вычислите относительную молекулярную массу полимера, если постоянная К в уравнении Штаудингера равна 2∙10-3 см3/г (макромолекулы полимера в растворе представляют собой жесткие палочки). 3. Вычислите относительную молекулярную массу белка миоглобина, если его характеристическая вязкость в водном растворе равна 3,1см3/г. Константы К и a в уравнении Марка–Хаувинка–Куна равны соответственно 2,32×10-2 см3/г и 0,5. 4. ИЭТ трех белков равны 3,8, 4,6 и 5,1. Какой из этих белков будет сильнее набухать в буферном растворе с рН 4,7 , а какой меньше всего? Ответ поясните. 5. В каком из растворов следующих солей – NaI, Na2SO4, NaCN, NaCl – при равной их молярной концентрации степень набухания биополимеров будет наибольшая, в каком – наименьшая? Почему? 6. Пять навесок белка с ИЭТ 5,1 залили растворами, рН которых соответственно равен 1,0; 4,0; 5,0; 6,5; 8,0. Постройте графическую зависимость степени набухания данного белка от рН среды. 7. Миозин мышц с ИЭТ 5,0 помещен в раствор, в котором концентрация Н+–ионов в 100 раз больше, чем в чистой воде. Какой заряд имеет белок в этом растворе? 8. К какому электроду будут передвигаться частицы белка при электрофорезе, если его ИЭТ 4,0, а рН раствора 5,0 ? 9. Пепсин желудочного сока с ИЭТ 2,0 растворен в буферных растворах с рН 1,9: 4,75 и 9,24. При каком значении рН устойчивость раствора белка наибольшая? 10. В четыре пробирки, содержащие по 10 мл раствора желатины, добавили равные объемы 1М растворов СН3СООNa, NaCNS, Na2SO4 и NaNO3. Объясните какой из электролитов будет оказывать наибольшее высаливающее действие, какой – наименьшее. 11. В пять пробирок, содержащих по 1 мл аммиачного буфера с рН 8,2: 9,1; 9,7; 10,3 и 11,2, добавили по 1 мл раствора белка с изоэлектрической точкой 9,2 и одинаковый объем ацетона. В какой из пробирок и почему произойдет максимальная коагуляция белка? 12. В четыре пробирки, содержащие одинаковый объем раствора белка добавили равные объемы растворов KI, CH3COOK, KCNS и K2SO4 с одинаковой концентрацией. В какой из пробирок желатинирование раствора белка протекает быстрее всего? Видео:Понятие о растворах. Коллигативные свойства растворовСкачать  Эталоны решения задачЗадача 1. Рассчитайте относительную молекулярную массу поливинилового спирта, если постоянные в уравнении Марка–Хаувинка–Куна для раствора поливинилового спирта в воде равны: К=4,53×10-5 см3/г, a=0,74; характеристическая вязкость [h]=0,15 см3/г. Подставляем значения К, a и [h] в уравнение (38) М0,74= Логарифмируем это равенство: 0,74 lgM=lg3311. Значение lg3311 находим по таблице логарифмов. lgM = Задача 2. Постоянные Штаудингера в уравнении Марка–Хаувинка–Куна для раствора амилозы в диметил-сульфоксиде равны: К= 1,32∙10-2 см3/г, a= 0,68. Используя следующие экспериментальные данные, рассчитайте относительную молекулярную массу амилозы. Рассчитываем удельную и приведенную вязкости по формулам (34, 35).Затем строим график зависимости hуд./С от концентрации. Путем экстраполяции прямой на ось ординат получаем отрезок, соответствующий предельному значению приведенной вязкости [h] (см. рис.49). Результаты расчетов сводим в таблицу по ниже приведенному образцу. Рассчитываем относительную молекулярную массу амилозы по уравнению (38). 56 = 1,32×10-2 М0,68, или М0,68=56/1,32×10-2=4242 Логарифмируем последнее равенство: 0,68 lgM=lg4242. Значение lg4242 находим по таблице логарифмов. lgM =3,63/0,68, т. е. lgM = 5,34. По таблице антилогарифмов находим значение М. М = 218776. Задача 3.Рассчитайте относительную молекулярную массу белка миоглобина, если постоянные в уравнении Марка–Хаувинка–Куна для раствора данного белка в воде равны: К= 2,32×10-2 см3/г, a = 0,5; характеристическая вязкость [h] = 3,1 см3/г. Для расчетов используем уравнение (38): М0,5 = Возводим обе части равенства в квадрат и получаем относительную молекулярную массу: М = (133,6)2 = 17849. Задача 4. В четыре пробирки с 1М растворами СН3СООК, КCNS, К2SO4 и KCl поместили по 0,5 г полярного полимера. В каком из растворов электролита набухание полимера максимально, в каком – минимально и почему? Действие ионов электролитов на набухание ВМС связано с их способностью к гидратации. По способности уменьшать набухание анионы располагаются в ряд (при одном и том же катионе): CNS– > J– > Br– > Поскольку, ионы CNS– усиливают набухание, а ионы Задача 5. Изоэлектрическая точка пепсина желудочного сока находится при рН 2,0. Каков будет знак заряда макромолекулы фермента при помещении его в буферный раствор с рН 8,5. При помещении пепсина в раствор с рН среды большей ИЭТ подавляется диссоциация аминогрупп и макромолекулы фермента приобретают отрицательный заряд. Задача 6. Желатина помещена в буферный раствор с рН 3. Определите знак заряда частиц желатины, если изоэлектрическая точка белка равна 4,7.
При помещении желатины в раствор с рН среды, меньшим ИЭТ, подавляется диссоциация карбоксильных групп и частицы желатины приобретают положительный заряд: Задача 7. Изоэлектрическая точка белка альбумина равна 4,9. Белок помещен в буферную смесь с концентрацией водородных ионов 10–6 моль/л. Определите направление движения частиц белка при электрофорезе. Если концентрация ионов водорода 10–6 моль/л, то рН среды равен 6, так как рН= –lg[H+]. Поскольку рН среды > ИЭТ (6 > 4,9), то согласно следующему уравнению белок приобретает отрицательный заряд и при электрофорезе перемещается к аноду: 💥 ВидеоОсмос и осмотическое давлениеСкачать  I Осмотическое давление IСкачать 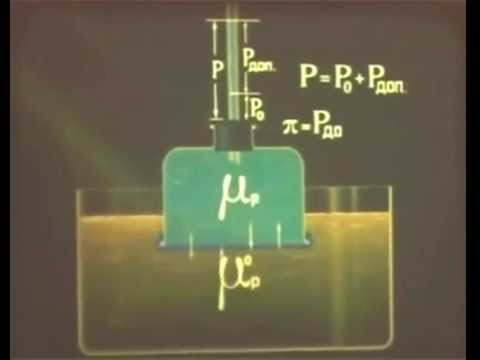 Закон Вант-ГОФФАСкачать  Коллигативные свойства растворов. Законы РауляСкачать  Осмотическое давление.Скачать  Лекция 5Скачать  Экзамен по химии | ВМССкачать  Осмотическое давлениеСкачать  Коллигативные свойства растворовСкачать  задачи на коллигативные свойстваСкачать  Коллигативные свойства растворов. Растворы и их свойства.Скачать  Коллигативные свойства растворовСкачать  Коллигативные свойства растворов неэлектролитовСкачать  1.2. Растворы высокомолекулярных соединенийСкачать  Практ.зан. Коллигативные свойства растворов (часть I)Скачать  Лекция 6 Физико химические свойства растворовСкачать  Дисперсные системы (образование, свойства и устойчивость коллоидных растворов)Скачать  |
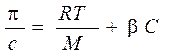
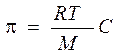














 > CH3COO– > Cl– > N
> CH3COO– > Cl– > N  > Br– > J– > CNS–
> Br– > J– > CNS– Сущность работы сводится к точному определению времени истечения равных объемов чистого растворителя (воды) и исследуемых растворов в вискозиметре. На основании экспериментальных и расчетных данных определяют относительную молекулярную массу полиглюкина.
Сущность работы сводится к точному определению времени истечения равных объемов чистого растворителя (воды) и исследуемых растворов в вискозиметре. На основании экспериментальных и расчетных данных определяют относительную молекулярную массу полиглюкина. ×105=3,311×10-2×105=3,311×103, т. е. М0,74=3311.
×105=3,311×10-2×105=3,311×103, т. е. М0,74=3311. = 4,757, т. е. lgM = 4,757. По таблице антилогарифмов находим значение М. Оно равно 57150.
= 4,757, т. е. lgM = 4,757. По таблице антилогарифмов находим значение М. Оно равно 57150. = 1,336×102 = 133,6, т. е. М0,5 = 133,6.
= 1,336×102 = 133,6, т. е. М0,5 = 133,6. > Cl– > CH3COO– >
> Cl– > CH3COO– > 
 ИЭТ = 4,7
ИЭТ = 4,7