Именные реакции в органической химии очень часто носят имя исследователя, который открыл или исследовал такую реакцию. Нередко реакции называются двойными именами учёных.
Такое случалось, когда автор первого издания впервые открыл и исследовал реакцию, а второй учёный одновременно опубликовал точно такие же материалы.
Ниже приведён список именных химических реакций, которые чаще всего встречаются на экзаменах.
- Именные реакции в органической химии для подготовки к ЕГЭ
- Реакция Вюрца
- Реакция Вюрца-Фиттига
- Реакция Дюма
- Реакция Кольбе
- Синтез Густавсона
- Синтез Лебедева
- Реакция Бутлерова
- Реакция Коновалова
- Эффект Хараша
- Реакция Вагнера
- Реакция Кучерова
- Реакция Зелинского
- Реакция Зинина
- Реакция Фриделя-Крафтса
- Реакция Зелинского–Казанского
- Реакция Прилежаева
- Органическая химия в уравнениях реакций
- Просмотр содержимого документа «Органическая химия в уравнениях реакций»
- Органическая химия уравнения реакций 9 класс
- Алгоритм № 2. Вычисление объема вещества по известной массе другого вещества, участвующего в реакции.
- Алгоритм № 3. Расчет по химическому уравнению объемных отношений газов
- Алгоритм № 4. Вычисление относительной плотности газа по другому газу
- Алгоритм № 5. Вычисление массовой доли вещества в растворе
- Алгоритм № 6. Вычисление массы вещества в растворе по массе раствора и массовой доле растворенного вещества.
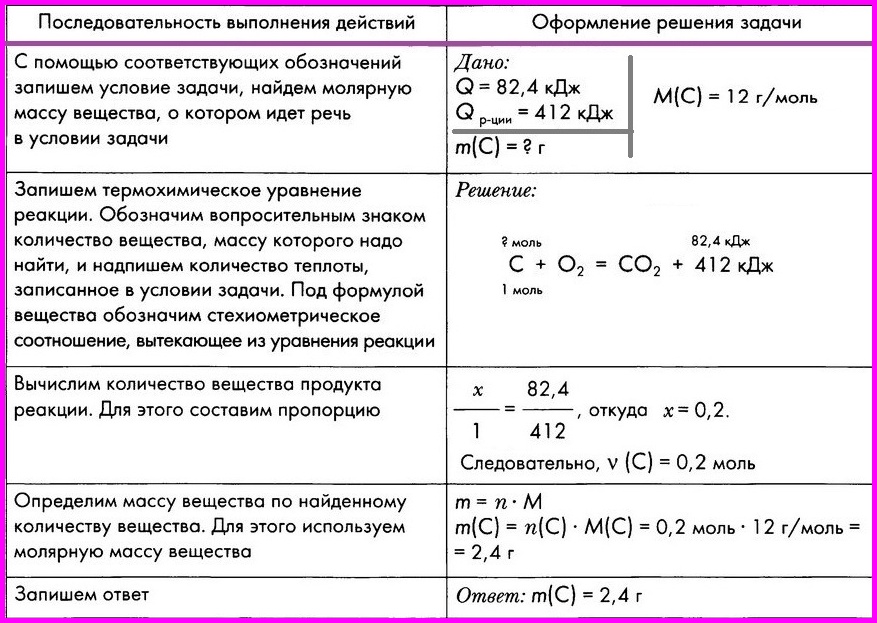
- Алгоритм № 7. Расчеты по термохимическим уравнениям. Вычисление количества теплоты по известной массе вещества.
- Алгоритм № 8. Расчеты по термохимическим уравнениям. Вычисление массы вещества по известному количеству теплоты.
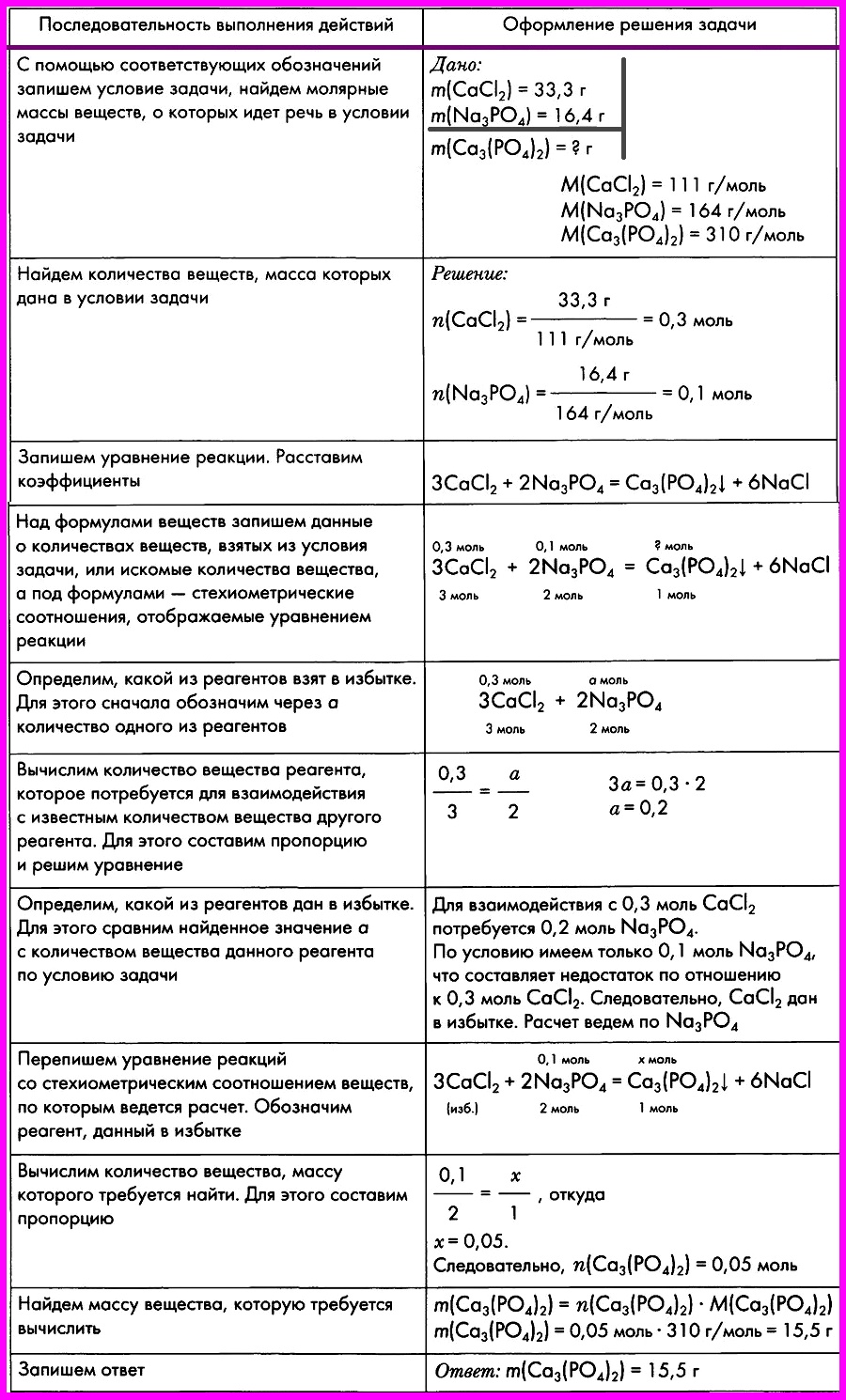
- Алгоритм № 9. Расчеты по химическим уравнениям, если одно из реагирующих веществ дано в избытке.
- 🌟 Видео
Видео:Составление уравнений реакций. 1 часть. 9 класс.Скачать

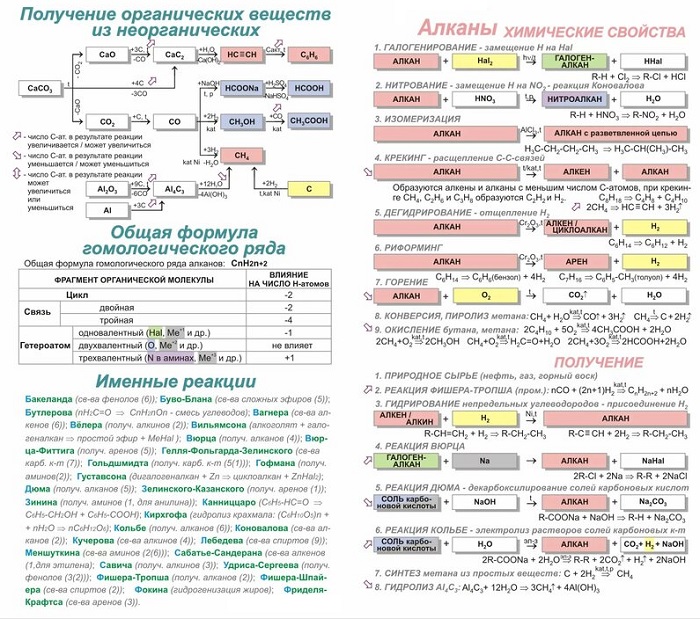
Именные реакции в органической химии для подготовки к ЕГЭ
Абитуриенту, поступающему на химический факультет, необходимо знать ряд именных реакций. Далее рассмотрим таблицу всех необходимых реакций для подготовки к сдаче ЕГЭ.
Реакция Вюрца
Основана на методе, в котором проходит синтез симметричных насыщенных углеводородов, в которых воздействует металлический натрий на моногалогенопроизводные углеводородов (чаще всего разновидность бромидов или иодидов). В результате получаем удвоенный углеродный скелет.
Реакция считается подходящей для получения симметричных алканов:
Реакция Вюрца-Фиттига
Разновидностью предыдущей реакции считается реакция Вюрца-Фиттига, в результате которой образуются ароматические углеводороды:
Реакция Дюма
Нагревание смеси соли карбоновой кислоты и гидроксида Na, при котором происходит отщепление группы COONa от молекулы соли:
Реакция Кольбе
Получение насыщенных углеводородов путём электролиза водных растворов калиевых или натриевых солей карбоновых кислот:
Синтез Густавсона
Результат отщепления двух атомов галогена от дигалогеналканов:
Магний возможно заменять цинком.
Синтез Лебедева
Процесс получения бутадиена из этанола:
Реакция Бутлерова
Процесс получения моносахаридов из формальдегида в слабощелочном водном растворе при наличии ионов металлов, к примеру кальция:
Реакция Коновалова
Механизм нитрования алифатического, алициклического и жирноароматического соединения разбавленного НNО3:
Эффект Хараша
Процесс присоединения бромоводорода при наличии перекиси. Реакция проходит вопреки правилу Марковникова:
Реакция Вагнера
Взаимодействие перманганата калия и холодного раствора воды – процесс мягкого окисления алкенов (образуется диол). Уравнение выглядит следующим образом:
Реакция Кучерова
Механизм, при котором получаются карбонильные соединения из алкинов при наличии соли ртути (II) в кислой водной среде. В результате гидратации получается енол, изомеризующийся в разновидность альдегида или кетона.
Реакция Зелинского
Способ тримеризации ацетилена. Процесс проходит во время пропускания ацетилена над активированным углем. Получается раствор бензола:
Реакция Зинина
Образование ароматического амина путем восстановления нитросоединений в растворах в щелочной и нейтральной среде:
Реакция Фриделя-Крафтса
Процесс алкилирования или ацилирования ароматического соединения при наличии катализатора кислотного характера, минеральной кислоты, окислов, катионообменной смолы.
Агентами алкилирования являются алкилгалогенид, олефин, спирт, сложный эфир; ацилирования — карбоновая кислота, её галогенангидрид и ангидрид.
Общий вид процесса:
C₆H₆ + R-Hal = [AlCl₃] => C₆H₅-R + Hhal.
Реакция Зелинского–Казанского
Получение бензола из циклогексана при температуре 420-480 0 С:
Реакция Прилежаева
Каталитическое окисление этилена с получением эпоксида. Автор реакции российский химик органик Н. А. Прилежаев.
Реакция происходит при температуре 200 0 С:
Видео:Как составлять ХИМИЧЕСКИЕ УРАВНЕНИЯ | 4 лайфхака - 95 ВСЕХ РЕАКЦИЙ в химии!Скачать

Органическая химия в уравнениях реакций
«Шпаргалки. Химия» — это краткие изложения основных вопросов по курсу органической химии за 10 класс , которые можно использовать для повторения и закрепления пройденного материала по органической химии при подготовке к ЕГЭ Весь материал можно распечатать в виде шпаргалок.
Просмотр содержимого документа
«Органическая химия в уравнениях реакций»
Реакции к основным темам курса 10 класса (для запоминания), проф. класс.
2. р. нитрования – р. Коновалова (р. замещения, радик. мех-зм): R-Н +НО – NО2(разб) −→R—NО2 +Н2 внимание: замещение атомов водорода у третичного атома (—с—) проходит легче, чем у вторичного атома(—с—) и тем более первичного атома (с—).
. р. окисления метана ( +[О]) даёт продукты, в зависимости от условий:
2. р. замещения – аналогично алканам (циклы с 6 и атомами углерода);
5. Алкины (непредельные). Общая формула – СпН2п-2. М (СпН2п-2)= (14п-2) г/моль, σ- и 2π-связи, SP-гибридизация, линейное строение обладают слабыми кислотными свойствами
только ацетилен СН≡СН + НОН →СН3-СНО — альдегид
при нагревании, в присутствии катализатора – Pt, Pd продолжение см дальше
5.слабые кислотные свойства у алкинов с «концевой» кратной связью:
6
в) алкилирование — р. Фриделя-Крафтса – удлинение цепи атомов углерода
помнить: у гомологов бензола замещение в цикле атомов водорода происходит с равной вероятностью в положении 2, 4, 6 относительно имеющегося радикала в присутствии катализаторов FeBr3 и H2SO4.
б
в
Наличие гидроксогруппы — ОН в молекулах спиртов проявляется в слабых кислотных и основных свойств.
2. слабые основные свойства, возрастающие от первичных к третичным спиртам:
3. р. этерификации – взаимодействие с кислотами и образование сложных эфиров:
а) при t 150 0 С – внутримолекулярная (Н2О отрывается от 1 молекулы):
б) при t 0 С – межмолекулярная (Н2О отрывается от 2 молекул):
Различные классы спиртов дегидратируются при различных условиях:
7. качественные реакции на: а) предельные одноатомные спирты – CuO, t
1. подвижность атома водорода и выраженные кислотные свойства –
3. р. электрофильного замещения протекают легче, чем у аренов:
а) реакция с раствором бромной воды – 1-я качественная реакция на фенолы
в) получение фенолформальдегидной смолы – р. поликонденсации
4. реакция с раствором FeCl3 – 2-я качественная реакция на фенолы
Внимание: водород легко присоединяется по связи С=С и очень трудно – по связи С=О. LiAlH4 восстанавливает связи С=О до С – ОН, не затрагивая связь С=С.
1. Химические свойства отличаются от свойств альдегидов:
а) менее активны в реакциях нуклеофильного присоединения, чем альдегиды (с цианидом водорода в присутствии цианида калия) R – С=О + НСN − KCN → R – C (OH) – C ≡ N;
б) присоединение реактива Гриньяра – R – MqBr с образованием третичного спирта
г) окисление с трудом, не взаимодействуют с соединениями серебра и меди
2. Иодоформный тест – если карбонильная группа связана со 2-ым атомом углерода от конца углеродной цепи (со щелочным раствором иода)
1. Диссоциируют, т.е. являются донором катиона водорода – слабые электролиты, самая сильная из них – муравьиная НСООН
R – СООН ↔ R – СОО — + Н +, сл-но, характерны свойства, типичные для кислот – взаимодействие с Ме, основными оксидами, основаниями и солями слабых кислот.
2. р.замещения группы ОН на хлор, взаимодействие с хлоридом Р(V)
R – СООН + Н – О – СО – R — Р2О5 → R – СО – О – СО — R + Н2О (ангидрид к-ты),
остаток кислоты ↓ остаток спирта
5. получение амидов в реакциях с раствором аммиака, при нагревании
6. р. замещения атома водорода у α–атома (С) на атом брома, в присутствии Ркр
7. р. дегидратации и гидрирование, в присутствии LiAlH4 (см. «альдегиды»)
8.Внимание: муравьиная кислота – самая сильная из органических кислот и сильный восстановитель,
9. Получение: а) из спиртов (окисление, т.е. + [О])
R – СН2 – ОН + [О] → R – СНО (альдегид) и дальше + [О] → R – СООН (кислота);
б) из альдегидов – р. «серебряного и медного зеркала»
6. Сложные эфиры карбоновых кислот. Общая формула – R-С = О
р. гидролиза с Н2О идёт медленно, её катализируют (ускоряют) кислоты и щёлочи
2. р. восстановления, в присутствии LiAlH4 с образованием 2-х спиртов:
особенность: медленная реакция, обратимая, с низким выходом.
Хлорангидриды и ангидриды кислот
Эти два вида производных карбоновых кислот химически очень активны. Хлорангидриды даже более активны, чем ангидриды, и более летучи, что делает обращение с ними очень трудным. Они вступают в быструю реакцию на холоде с водой, аммиаком и с их производными, спиртами и аминами. В каждом случае атом водорода реагирующей молекулы замещается ацильной группой – это реакции ацилирования, а хлорангидриды и ангидриды кислот-ацилирующие агенты. С хлорангидридами:
↑ этот атом водорода замещается на ацильную группу.
С ангидридами кислот:
2. р. восстановления до многоатомных спиртов:
3. синее окрашивание с Си(ОН)2, как у многоатомных спиртов;
4. р. межмолекулярной дегидратации со спиртами: → простые эфиры;
5. р. этерификации с альдегидами → сложные эфиры;
1. Амины обладают основными свойствами, поэтому, как основания,
3. Р. нитрирования (с НО – NО) проходит по-разному:
9. Азотсодержащие соединения – аминокислоты …β α Мr (к-ты) = (14п+75)
Общая формула – R – СН — СООН
1.Аминокислоты обладают амфотерными свойствами, поэтому реагируют:
4. Получение: α- аминокислоты из α-хлорзамещенных карбоновых кислот
Окислительно – восстановительные реакции в органической химии.
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Органическая химия уравнения реакций 9 класс
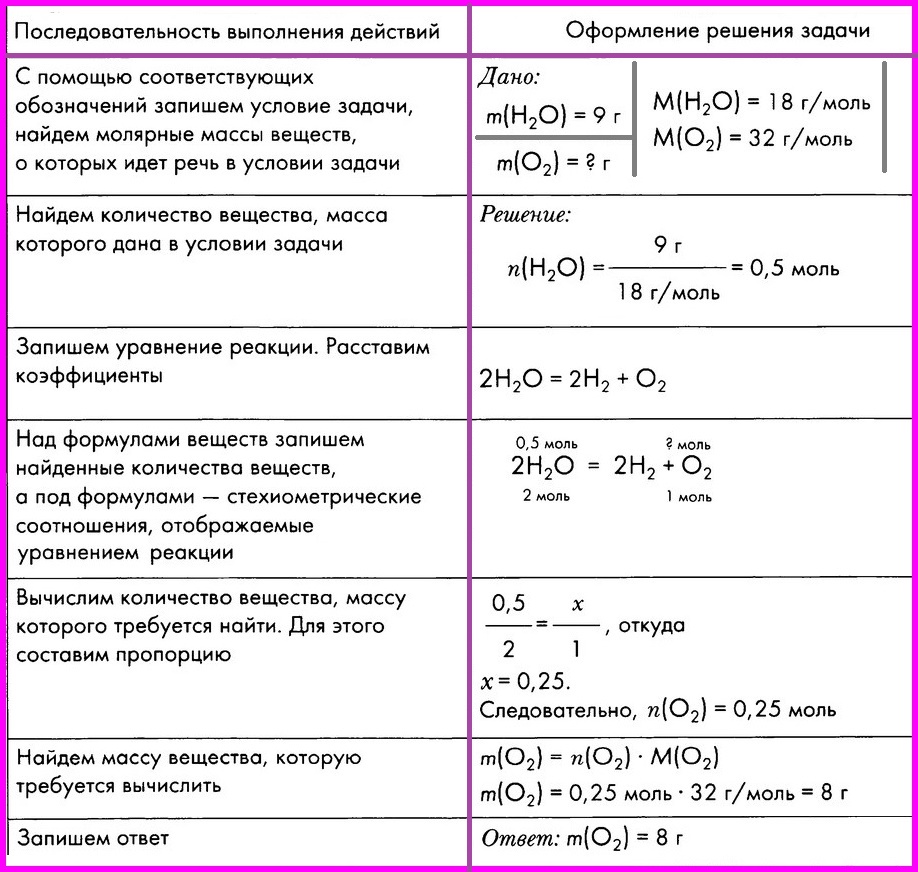
ЗАДАЧА: Вычислите массу кислорода, выделившегося в результате разложения порции воды массой 9 грамм.
Алгоритм № 2. Вычисление объема вещества по известной массе другого вещества, участвующего в реакции.
ЗАДАЧА: Вычислите объем кислорода (н.у.), выделившегося в результате разложения
порции воды массой 9 г.
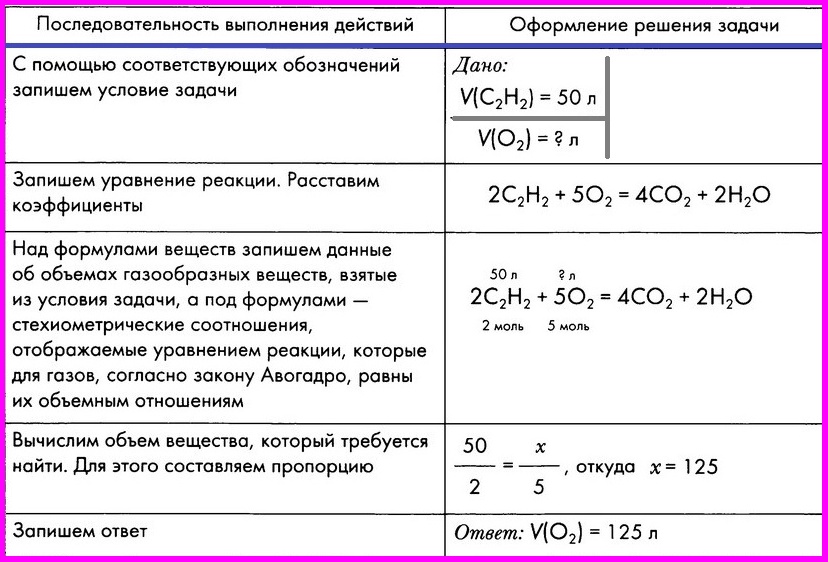
Алгоритм № 3. Расчет по химическому уравнению объемных отношений газов
ЗАДАЧА: Вычислите объем кислорода, необходимого для сжигания порции ацетилена объемом 50 л.
Алгоритм № 4. Вычисление относительной плотности газа по другому газу
ЗАДАЧА: Вычислите плотность кислорода а) по водороду; 6) по воздуху.
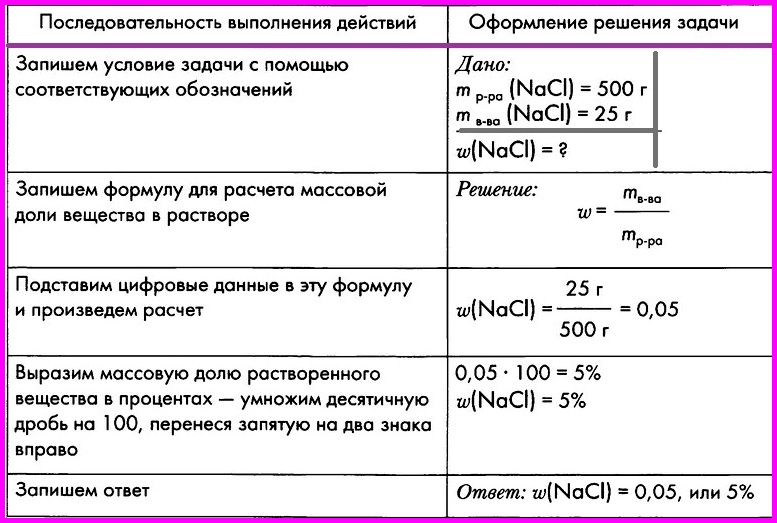
Алгоритм № 5. Вычисление массовой доли вещества в растворе
ЗАДАЧА: При выпаривании раствора массой 500 г образовалось 25 г кристаллической соли — хлорида натрия. Вычислите массовую долю соли в исходном растворе.
Алгоритм № 6. Вычисление массы вещества в растворе по массе раствора и массовой доле растворенного вещества.
ЗАДАЧА: Вычислите массу гидроксида натрия, необходимого для приготовления 400 г 20%-ного раствора гидроксида натрия.
Алгоритм № 7. Расчеты по термохимическим уравнениям. Вычисление количества теплоты по известной массе вещества.
ЗАДАЧА: По термохимическому уравнению 2Сu + O2 = 2СuO + 310 кДж вычислите количество теплоты, выделившейся в результате окисления порции меди массой 16 г.
Алгоритм № 8. Расчеты по термохимическим уравнениям. Вычисление массы вещества по известному количеству теплоты.
ЗАДАЧА: По термохимическому уравнению С + O2 = СO2 + 412 кДж вычислите массу сгоревшего угля, если количество теплоты, выделившееся в результате реакции, составляет 82,4 кДж .
Алгоритм № 9. Расчеты по химическим уравнениям, если одно из реагирующих веществ дано в избытке.
ЗАДАЧА: Смешали два раствора, один из которых содержал 33,3 г хлорида кальция, а другой — 16,4 г фосфата натрия. Вычислите массу образовавшегося фосфата кальция.
Вы смотрели Справочник по химии «Алгоритмы решения типовых задач». Выберите дальнейшее действие:
🌟 Видео
Химические уравнения - Как составлять уравнения реакций // Составление Уравнений Химических РеакцийСкачать

Органическая химия с нуля | Химия ЕГЭ 2023 | УмскулСкачать

Уравнения химический реакций на ОГЭ: как составлять без ошибок?Скачать

Как БЫСТРО понять Химию? Органическая Химия с нуляСкачать

Как решать ОРГАНИЧЕСКИЕ ЦЕПОЧКИ? Основные типы химических реакцийСкачать

Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Типы Химических Реакций — Химия // Урок Химии 8 КлассСкачать

Органическая Химия — Алканы и Цепь из АтомовСкачать

Решаем два варианта Добротина за 2 часаСкачать

РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Органика. Учимся составлять и читать химические уравнения в органической химии.Скачать

ХИМИЧЕСКИЕ УРАВНЕНИЯ | Как составлять уравнения реакций | Химия 8 классСкачать

Расстановка Коэффициентов в Химических Реакциях // Подготовка к ЕГЭ по ХимииСкачать

Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

ВСЕ ПРО АЛКАНЫ за 8 минут: Химические Свойства и ПолучениеСкачать

Химия 9 класс (Урок№28 - Органическая химия. Углеводороды. Предельные (насыщенные) углеводороды.)Скачать

Химия 9 класс (Урок№2 - Тепловой эффект химических реакций. )Скачать