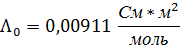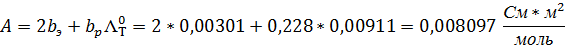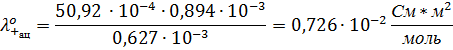ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Измерения электрической проводимости растворов производят с помощью приборов, называемых кондуктометрами. Методика выполнения измерений описана в инструкции, прилагаемой к используемому прибору.
Любые исследования, основанные на измерении электрической проводимости, объединяются под названием кондуктометрии. Кондуктометрические методы применяются для изучения свойств как сильных, так и слабых электролитов.
РАБОТА № 1
ИЗМЕРЕНИЕ УДЕЛЬНОЙ ЭЛЕКТРОПРОВОДНОСТИ РАСТВОРОВ СИЛЬНЫХ ЭЛЕКТРОЛИТОВ
Цель работы:определение предельной молярной проводимости и коэффициентов проводимости сильных электролитов.
Электролит: CH3COONa
| Молярная концентрация раствора C, моль/м 3 |  | Удельная проводимость σ* 10 4 ,См/м | Эквивалентная проводимость Λ*10 4 , См*м 2 /моль | Λ0 |  | A |
| 0,196 | ||||||
| 0,01 | 0,1 | 0,5535 | 55,35 | 0,00911 | 0,6076 | 0,0358 |
| 0,1 | 0,3162 | 1,439 | 14,39 | 0,1580 | 0,0243 | |
| 8,059 | 8,059 | 0,0885 | 0,0083 | |||
| 3,1623 | 51,65 | 5,165 | 0,0567 | 0,0027 | ||
| 270,5 | 2,705 | 0,0297 | 0,0009 |
1. Постройте график 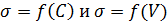
2. Рассчитайте эквивалентную электрическую проводимость каждого раствора:
3. Постройте график 

4. Рассчитайте значение 
5. Сравните Λ0 найденное графически, с теоретическим.
6. Рассчитайте коэффициент проводимости для каждого раствора fΛ=Λ/Λ0
7. Сделайте вывод о влиянии концентрации на взаимодействие между ионами.
В растворах слабых электролитов, чем выше концентрация, тем ниже коэффициент проводимости.
По теории Дебая — Онзагера снижение эквивалентной электрической проводимости при переходе от бесконечно разбавленного раствора к растворам конечных концентраций связано с уменьшением скоростей движения ионов. Это объясняется появлением эффектов торможения движения ионов, возникающих за счет сил электростатического взаимодействия между ионом и его ионной атмосферой.
8. Установите область концентрации, для которой применимо уравнение Кольрауша.
Уравнение Кольрауша, в соответствии с графиком, применимо к области концентраций от 0,01 моль/м 3 до 0,1 моль/м 3
9. Найдите значение предельной электропроводности электролита и коэффициента А по уравнению Кольрауша.
y = -0,0005x + 0,0079

10. Результаты измерений занесите в таблицу.
11. Рассчитайте значение углового коэффициента в уравнении Дебая-Хюккеля-Онзагера, если ε=78,25; η=0,894*10 -3 Па*с;
Уравнение Дебая-Хюккеля-Онзагера (1,1 – электролит)
Подставив значения, получим (q = 1/2, так как электролит симметричен):
12. Сравните значения полученных угловых коэффициентов:
A (графическая) = 0,0005
А (аналитическая) = 0,008097
13. Определите подвижность катиона и аниона, если число переноса аниона дано в таблице.
14. Предельную электрическую подвижность катиона в водном растворе.
15. Скорость движения катиона при градиенте поля 100 В/м.
16. Стоксов радиус иона (для воды η = 0,894 * 
17. Подвижность катиона при бесконечном разведении в ацетоне и нитрометане, вязкости которых при этой температуре соответственно равны 0,310∙ 

Работа №2
ИЗМЕРЕНИЕ УДЕЛЬНОЙ ЭЛЕКТРОПРОВОДНОСТИ РАСТВОРОВ СЛАБЫХ ЭЛЕКТРОЛИТОВ
Цель работы:определение степени диссоциации слабых электролитов при разных концентрациях и константы диссоциации.
Электролит: CH3COOH
| Молярная концентрация раствора C, моль/м 3 | 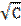 | Удельная проводимость σ*10 4 ,См/м | Эквивалентная проводимость Λ*10 4 , См*м 2 /моль | Степень диссоциации α | Ка |
| 1,61 | 1,6116 | 0,004125 | 1,7086*10 -5 | ||
| 2,2361 | 3,56 | 0,7119 | 0,001822 | 1,6629*10 -5 | |
| 3,1623 | 5,13 | 0,5130 | 0,001313 | 1,7262*10 -5 | |
| 4,4721 | 7,2 | 0,3602 | 0,000922 | 1,7017*10 -5 | |
| 7,0711 | 11,37 | 0,2273 | 0,000582 | 1,6946*10 -5 |
1. Рассчитать эквивалентную проводимость растворов.
2. Построить графики зависимости 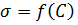

3. Пользуясь величинами предельных подвижностей ионов, по закону независимого движения ионов рассчитайте предельную молярную проводимость электролита.
4. Рассчитайте степень диссоциации слабого электролита в каждом исследуемом растворе.
5. Постройте график зависимости α от концентрации раствора.
6. По закону разбавления Оствальда рассчитайте константу диссоциации для каждого раствора и найдите ее среднее значение.
7. По графикам в координатах 

8. Сравните найденное значение константы диссоциации с табличным значением.
К(найденное) = 2,24*10 -7
К(табличное) = 1,8*10 -5
9. Сделайте вывод о влиянии концентрации раствора на величины α и Ка
У слабых электролитов степень и константа диссоциации понижаются с повышением концентрации раствора.
- Определите графически константы уравнения кольрауша
- ПРЕДИСЛОВИЕ
- ВОПРОСЫ И ЗАДАЧИ
- ПО ФИЗИЧЕСКОЙ ХИМИИ
- Лабораторные работы и задачи по физической химии (стр. 5 )
- Работа 2.4. Определение коэффициента распределения третьего компонента между двумя жидкими фазами.
- Тема 3. Кондуктометрия
- Вопросы для самоподготовки.
- Решение типовых задач.
- Задачи для самостоятельного решения.
- РАБОТА 3.1.
- Определение константы и степени диссоциации (ионизации) слабых электролитов в водных растворах.
- Устройство кондуктометра и принцип его действия
- 🎥 Видео
Видео:Электрическая проводимость растворов электролитов. Кондуктометрия.Скачать

Определите графически константы уравнения кольрауша
(ЧАСТЬ 3) Методические указания по физической химии для самостоятельной работы студентов инженерно-экологического факультета специальностей 240100 «Химическая технология и биотехнология», 240502 «Технология переработки пластических масс и эластомеров», 280202 «Инженерная защита окружающей среды», 261201 «Технология и дизайн упаковочного производства»
Екатеринбург Печатается по рекомендации методической комиссии ИЭФ.
Протокол № 2 от 27 сентября 2010 г.
Рецензент – д-р хим. наук Б.Н. Дрикер Редактор Е.Л. Михайлова Оператор компьютерной верстки Г.И. Романова Подписано в печать 18.05.2011 Поз. Плоская печать Формат 60х84 1/16 Тираж 140 экз.
Заказ Печ.л. 2,32 Цена 12 руб. 40 коп.
Редакционно-издательский отдел УГЛТУ Отдел оперативной полиграфии УГЛТУ
Видео:Уравнения и графики механических гармонических колебаний. 11 класс.Скачать

ПРЕДИСЛОВИЕ
Физическая химия служит теоретической основой повседневной практической деятельности современного химика. Физическая химия – наука о закономерностях химических процессов и физических явлений. Она изучает химические процессы в неразрывной связи с сопровождающими их физическими явлениями. Инженер-химик и химик-технолог должны не только знать физико-химические законы, но и уметь применять их для решения конкретных задач. Решение задач помогает студенту усвоить и глубже понять теоретические положения курса.
Сформировать физико-химическое мышление, привить навыки решения конкретных физико-химических задач, научить доводить решение до конечного числового результата, привить ответственность за результат расчета – вот важнейшее и весьма трудное в преподавании физической химии. Успех в этом не может быть достигнут без систематической самостоятельной работы студентов.
Прослушав лекции, изучив соответствующий раздел по учебнику, студент должен показать на практике, как им усвоен теоретический материал, выполнив самостоятельно свой вариант по соответствующему разделу. Каждый вариант включает 2-3 теоретических вопроса и 2-3 задачи. Для облегчения решения задач в конце методических указаний приводится приложение, в котором имеются справочные материалы, требующиеся студенту при решении конкретных задач по соответствующим разделам.
В данных методических указаниях приводятся теоретические вопросы и задачи по следующим разделам: «Растворы электролитов», «Электродные потенциалы. ЭДС гальванического элемента», «Химическая кинетика и катализ».
Растворы электролитов Вариант 1. В каком растворителе воде или бензоле степень диссоциации слабого электролита больше и почему?
2. Можно ли для измерения сопротивления растворов электролитов использовать постоянный электрический ток? Поясните.
3. Две двухосновные органические кислоты при одинаковой концентрации имеют разные степени диссоциации: первая 0,01, вторая – 0,02.
Константа диссоциации какого электролита больше и во сколько раз?
4. Для эквивалентной электропроводности электролита при различных концентрациях получены следующие значения:
С, моль/л …………… 0,03 0,015 0,00375 4 2 — 10, Смм моль …. 1,017 1,446 2,89 351, Рассчитать среднее значение константы диссоциации электролита.
5. Рассчитать среднюю ионную активность водного раствора серной кислоты, если концентрация ее равна 0,5 моль на 1 кг воды.
Вариант 1. В чем причина различной подвижности ионов? Показать аналитически.
2. Что такое активность и коэффициент активности? В чем их смысл?
3. Изменится ли константа диссоциации слабого электролита, если в качестве растворителя вместо воды взять ацетон? Если да, то как? Если нет, то почему?
4. Рассчитать рН и эквивалентную электропроводность для 0,01 молярного раствора уксусной кислоты. Необходимые данные взять из справочника.
5. Абсолютные скорости ионов серебра и ионов нитрата при бесконечном разведении равны соответственно 0,57710-7 и 0,6310-7 м2с-1В-1.
Удельная электропроводность 0,1 молярного раствора нитрата серебра равна 0,947 Смм-1. Определить отношение эквивалентных электропроводностей при данном и бесконечном разведении.
Вариант 1. В чем причина аномальной подвижности и какие ионы ей обладают? Объяснить.
2. Как выражается предельный закон Дебая и Гюккеля для сильных электролитов? Для какого диапазона концентраций растворов этот закон выполняется?
3. Есть ли разница между величинами ионной силы растворов хлорида и сульфата лантана одинаковой концентрации? Если да, то в каком случае эта величина больше? Если нет, то почему?
4. Эквивалентная электропроводность водного раствора муравьиной кислоты с разведением 128 л/моль равна 59,210-4 Смм2моль-1. Рассчитать степень диссоциации кислоты в этих условиях, если эквивалентная электропроводность НСООК при бесконечном разведении 128,110-4 Смм2моль-1. Предельные подвижности ионов калия и водорода соответственно равны 73,510- и 349,810-4 Смм2моль-1.
5. Эквивалентная электропроводность раствора нитрата серебра имеет следующие значения:
Найти графически значение эквивалентной электропроводности при бесконечном разведении.
Вариант 1. Что такое числа переноса ионов? Кто ввел это понятие? Одинаково ли число переноса в различных соединениях? Привести примеры.
2. Что такое ионная сила раствора? Определить ионную силу раствора смеси электролитов: 0,01 моль/л сульфата калия; 0,001 моль/л хлорида калия и 0,002 моль/л фосфата калия.
3. Одинаково ли значение рН воды при 0 и при 100 0С? Если да, то почему оно равно? Если нет, то почему?
4. Рассчитать эквивалентную электропроводность 0,05 н водного раствора бензойной кислоты. Необходимые сведения взять из справочника.
5. Подвижность ионов натрия 44,410-4, а ионов водорода 31510-4 Смм2моль-1. Значения эквивалентной электропроводности при бесконечном разведении соли ацетата натрия 78,110-4 Смм2моль-1. Найти значение предельной эквивалентной электропроводности для уксусной кислоты и ее степень диссоциации при концентрации 0,001 моль/л, если при этом удельная электропроводность кислоты 4,110-3 Смм-1.
Вариант 1. Дать вывод уравнения Кольрауша. Что такое подвижность иона?
2. На чем основан кондуктометрический метод анализа? Какой вид имеет кривая титрования щелочи сильной кислотой? Объяснить.
3. Для какого из растворов сульфата натрия или хлорида лантана одинаковой концентрации, ионная сила больше и во сколько раз?
4. Константа диссоциации уксусной кислоты в воде 1,7610-5. Для 0,1 н раствора рассчитать концентрацию ионов водорода и эквивалентную электропроводность, если при бесконечном разведении она 390,710-4 Смм2моль-1.
5. Вычислить значение эквивалентной электропроводности 30 % раствора КОН плотностью 1,2905 г/см3, имеющего удельную электропроводность 0,539 Смсм-1.
Вариант 1. Что такое постоянная (константа) сосуда? Что она учитывает и для чего необходимо ее определять?
2. Как записывается уравнение Кольрауша – Онзагера, для каких электролитов оно применимо? Дать графическое решение этого уравнения, что при этом можно определить и как?
3. Эквивалентная электропроводность при бесконечном разведении для водных растворов уксусной кислоты и ацетата натрия составляет соответственно 0,035 и 0,0078 Ом-1м2моль-1. В чем причина столь больших различий?
4. Константа диссоциации уксусной кислоты в воде равна 1,7610-5.
Чему будут равны концентрация ионов водорода и рН раствора, если к 1 л 1 н раствора этой кислоты добавить 16,4 г ацетата натрия?
5. Раствор слабой кислоты при разведении 128 л/моль имеет эквивалентную электропроводность 0,0018 Смм2моль-1, а при бесконечном разведении она равна 0,0389 Смм2моль-1. Рассчитать концентрацию ионов водорода в этом растворе и константу диссоциации кислоты.
Вариант 1. Дать схему и объяснить принцип действия моста Кольрауша.
2. Дать понятие эквивалентной электропроводности. Для проводников какого рода вводится это понятие и почему? Какова связь между эквивалентной и удельной электропроводностями?
3. Что учитывает фактор геометрии сосуда в константе сосуда при измерении сопротивления раствора электролита? Пояснить.
4. Определить числа переноса ионов в разбавленном растворе нитрата калия, зная, что абсолютные скорости таковы: у иона калия 7,6110-4, у иона нитрата 7,410-4 см2с-1В-1.
5. Удельная электропроводность насыщенного водного раствора хлорида серебра 2,410-6, а удельная электропроводность воды 1,1610-6 Ом-1см-1.
Эквивалентные электропроводности при бесконечном разведении нитрата серебра, хлорида натрия и нитрата натрия соответственно равны 116, 109 и 105,2 Ом-1см2моль-1. Определить растворимость хлорида серебра и произведение растворимости.
Вариант 1. Что такое изотонический коэффициент Вант-Гоффа и каков его физический смысл?
2. Проводники первого и второго рода: что между ними общего и в чем различие?
3. Раствор, содержащий 1,632 г трихлоруксусной кислоты в 100 г бензола, кристаллизуется при температуре на 0,35 0С ниже, чем чистый бензол. Определить, происходит ли диссоциация или ассоциация кислоты в бензольном растворе. Молярное понижение температуры кристаллизации бензола равно 5,16 кгК/моль.
4. Эквивалентная электропроводность раствора малоновой кислоты при разведении 1024 л/моль равна 269,910-4 Смм2моль-1; предельная эквивалентная электропроводность при диссоциации по первой ступени 38210-4 Смм2моль-1.
Найти степень диссоциации и константу диссоциации этой кислоты.
5. Вычислить средний ионный коэффициент активности для ионов соли хлорида бария, если моляльная концентрация раствора 0,001 при 298 К.
Вариант 1. Что такое ионогенные и ионоформные соединения? В чем отличие механизма диссоциации этих веществ?
2. Какова связь между константой диссоциации и степенью диссоциации слабого электролита?
3. Водный 7,5 % (вес.) раствор хлорида кальция кипит при давлении 1013,3 гПа и 374 К. Вычислить изотонический коэффициент раствора. Давление пара воды при этой температуре 1050 гПа.
4. Эквивалентная электропроводность борной кислоты при разведении 22,2 л/моль составляет 3,910-6 Смм2моль-1. Определить степень диссоциации и константу диссоциации, если предельная эквивалентная электропроводность борной кислоты при диссоциации по первой ступени равна 34610-4 Смм2моль-1.
5. Определить молярность раствора НСl, если 100 мл его титруется кондуктометрически 8 н раствором едкого натра. Результаты титрования приведены ниже:
Вариант 1. Какой физический смысл имеет удельная электропроводность? Как она зависит от концентрации для растворов слабых и сильных электролитов?
2. В чем состоит суть основных положений теории электролитической диссоциации Аррениуса? В чем ее недостатки?
3. Вычислить температуру замерзания раствора, содержащего 7,308 г хлорида натрия в 0,25 кг воды, если при 291 К осмотическое давление этого раствора 21077 гПа, плотность 1 г/мл, теплота плавления воды 333,48 кДж/кг.
4. Определить числа переноса ионов в разбавленном растворе НСl, зная, что абсолютные скорости таковы: у иона водорода – 36,210-4, у иона хлора – 7,9210-4 см2с-1В-1.
5. Вычислить удельную электропроводность насыщенного раствора труднорастворимой соли хромата бария, имеющего произведение растворимости 2,310-10, а предельная эквивалентная электропроводность 126,410-4 Смм2моль-1. Удельная электропроводность воды 4,410-8 Ом-1см-1.
Вариант 1. Зависит ли радиус ионной атмосферы от концентрации раствора сильного электролита? Если да, то как? Если нет, то почему?
2. Выразить константу полной диссоциации фосфорной кислоты через степень диссоциации и общую концентрацию электролита.
3. Давление пара раствора, содержащего 2,21 г хлорида кальция и 0,1 кг воды, при 293 К равно 2319,8 Па, а давление пара воды при той же температуре 2338,5 Па. Вычислить кажущуюся молекулярную массу и кажущуюся степень диссоциации этой соли.
4. Водный раствор слабой кислоты при разведении 64 л/моль имеет эквивалентную электропроводность 11,110-4 Ом-1м2моль-1, а при бесконечном разведении 386,610-4. Определить концентрацию ионов водорода в этом растворе и константу диссоциации кислоты.
5. Вычислить значение эквивалентной электропроводности 20 % раствора едкого натра удельным весом 1,225 г/см3, имеющего удельную электропроводность 0,327 Ом-1см-1.
Вариант 1. Что называется абсолютной скоростью движения иона в растворе?
В каких единицах измерения она выражается?
2. Зависит ли радиус ионной атмосферы от величины эаряда иона? Если да, то как? Если нет, то почему?
3. Определить процентную концентрацию раствора глицерина, если давление пара этого раствора равно давлению пара раствора, содержащего 0,0089 кг нитрата натрия в 1 кг воды. Кажущаяся степень диссоциации соли равна 64,9 %.
4. Пользуясь справочными данными, рассчитать рН 0,01 молярного водного раствора соляной кислоты при 298 К.
5. Удельная электропроводность водного раствора уксусной кислоты при разведении 20 л/моль и температуре 298 К составляет 0,0362 Ом-1м-1.
Рассчитать степень диссоциации и рН раствора. Необходимые данные взять из справочника.
Вариант 1. Радиус ионной атмосферы в миллимолярном растворе бинарного электролита при 298 К равен 6 нм. Изменится ли радиус ионной атмосферы при увеличении концентрации раствора? Если да, то как? Если нет, то почему?
2. Понижение температуры замерзания растворов электролитов. Чем оно отличается от понижения температуры растворов молекулярных? Привести примеры. Как рассчитать молярное понижение температуры замерзания растворителя?
3. Как растворимость малорастворимой соли зависит от добавления в раствор одноименных с малорастворимой солью ионов? Объяснить.
4. Исследовать применимость закона разведения Оствальда по данным электропроводности азотной кислоты в метаноле и этаноле:
5. Удельная электропроводность насыщенного раствора бромистого таллия 2,15810-4, а удельная электропроводность воды 0,04410-6 Ом-1см-1.
Вычислить растворимость данной соли. Предельная эквивалентная электропроводность бромистого таллия 138,3 Ом-1см2моль-1.
Вариант 1. Как меняется удельная электропроводность раствора электролита при увеличении разведения?
2. Подвижность иона в растворе зависит от его кристаллографического радиуса? Если да, то как? Если нет, то почему?
3. Раствор, содержащий 0,001 моль хлорида цинка в 1 кг воды, замерзает при 273,1545 К, а раствор 0,0819 моль в 1 кг воды при 272,7746 К.
Вычислить изотонический коэффициент. Криоскопическая константа воды 1,86 кгК/моль.
4. Пользуясь справочными данными, рассчитать рН водного раствора соляной кислоты с моляльной концентрацией 0,1 при 298 К.
5. Абсолютные скорости движения ионов К и ClO 4 в воде при 293 К и бесконечном разведении соответственно равны 6,610-8 и 6,110-8 м2/(Вс).
Определить предельные эквивалентные электропроводности и числа переноса ионов, а также эквивалентную электропроводность КСlО4 при бесконечном разведении.
Вариант 1. Дать графическую зависимость удельной электропроводности от концентрации для сильного и слабого электролитов и объяснить ход кривых.
2. Осмотическое давление растворов. В чем суть явления осмоса ионогенных растворов?
3. Определить кажущуюся степень диссоциации НIО3 в растворе, содержащем 0,506 г кислоты в 22,48 г этанола. Раствор кипит при 351,624 К, чистый спирт кипит при 351,46 К, эбуллиоскопическая постоянная спирта 1,19 кгК/моль.
4. Удельная электропроводность водного раствора аммиака при концентрации 0,011 моль/л равна 0,0122 Смм-1. Рассчитать эквивалентную электропроводность и рН раствора. Необходимые данные взять из справочника.
5. Рассчитать рН раствора, содержащего 0,01 моль на 1 кг воды НСl и 0,02 моль на 1 кг воды серной кислоты при 298 К.
Вариант 1. Эквивалентная электропроводность водного миллимоляльного раствора хлорида кальция составляет 0,01304, а децимоляльного 0,01025 Смм2моль-1.
Объяснить причину уменьшения электропроводности.
2. Какой вид имеет зависимость сопротивление раствора – объем кислоты при кондуктометрическом титровании щелочи сильной кислотой?
Одинаковы ли углы наклона у восходящей и нисходящей ветвей этой зависимости? Доказать.
3. Есть ли разница между величинами ионной силы водных растворов нитрата и сульфата натрия одинаковой концентрации? Если да, то какая?
Если нет, то почему?
4. Для малоновой кислоты при разведении 64 л/моль эквивалентная электропроводность при бесконечном разведении 382,410-4 Ом-1м2моль-1.
Найти степень диссоциации, концентрацию ионов водорода и константу диссоциации.
5. При титровании 100 мл раствора уксусной кислоты 0,5 н раствором едкого натра получены результаты:
Вычислить концентрацию уксусной кислоты.
Вариант 1. Зависит ли радиус ионной атмосферы от температуры? Если да, то как? Если нет, то почему?
2. Как по данным об изменении электропроводности раствора электролита в зависимости от концентрации определить его силу?
3. Отношение моляльностей водных растворов сульфата и хлорида натрия равно 1:1. Чему равно отношение средних ионных активностей этих растворов?
4. Удельная электропроводность 0,02 н водного раствора уксусной кислоты 0,0231 Ом-1м-1. Определить степень диссоциации и концентрацию ионов водорода в растворе. Необходимую информацию взять из справочника.
5. Удельная электропроводность насыщенного водного раствора хлорида серебра 3,110-6, а удельная электропроводность воды 1,310-6 Ом-1см-1.
Какова растворимость соли в г/л, если предельная эквивалентная электропроводность хлорида серебра 137,5 Ом-1см2моль-1?
Вариант 1. Изменится ли степень диссоциации уксусной кислоты в водном растворе, если добавить ацетат натрия? Если да, то как? Если нет, то почему?
2. Относительное понижение давления насыщенного пара растворителя ионогенных растворов. Чем оно отличается от относительного понижения давления молекулярных растворов?
3. Определить концентрацию водного раствора глюкозы, если этот раствор при 291 К изоосмотичен с раствором, содержащим 0,5 моль/л хлорида кальция, причем кажущаяся степень диссоциации последнего при указанной температуре составляет 65,4 %.
4. Сопротивление 0,01 н водного раствора нитрата калия равно 423 Ом.
Рассчитать величины удельной и эквивалентной электропроводностей, если константа сосуда 0,6 см-1.
5. Константа диссоциации водного раствора аммиака равна 1,7710-5.
Определить рН раствора с моляльной концентрацией 0,1.
Вариант 1. Какой вид имеет зависимость удельная электропроводность объем щелочи при кондуктометрическом титровании смеси сильной и слабой кислот щелочью? Пояснить.
2. Повышение температуры кипения ионогенных растворов. Чем оно отличается от повышения температуры кипения растворов молекулярных?
Как рассчитать молярное повышение температуры кипения растворителя?
3. Абсолютные скорости движения ионов Sr2+ и Cl- в разбавленном растворе при 291 К равны соответственно 5,210-8 и 6,810-8 м2/(cВ). Определите эквивалентные электрические проводимости и числа переноса ионов в растворе SrCl2.
4. Удельная электропроводность водного раствора аммиака 0,1 моляльного раствора составляет 0,037 Ом-1м-1. Рассчитать эквивалентную электропроводность и рН раствора. Данные о подвижностях ионов взять из справочника.
5. В сосуд налит раствор 0,02 н КСl, удельная электропроводность которого 2,39710-3 Ом-1см-1. Сопротивление этого раствора 515,6 Ом. Найти значение эквивалентной электропроводности для 0,05 н раствора нитрата натрия, если через раствор при напряжении 0,5 В идет переменный ток силой 1,85 мА.
Вариант 1. Напишите математическое выражение предельного закона ДебаяГюккеля для раствора Со(NO3)2.
2. Один и тот же электролит растворен в воде и хлороформе. Где степень его диссоциации (при прочих равных условиях) больше и почему?
3. Чистая вода кипит при 373,2 К и атмосферном давлении 760 мм рт. ст.
Определить температуру кипения раствора, содержащего 3,291 г хлорида кальция в 100 г воды. Кажущаяся степень диссоциации соли 68 %, а мольное повышение температуры кипения воды 0,516 кгК/моль.
4. Эквивалентная электропроводность при бесконечном разведении водного раствора КСlО3 равна 0,01481 Ом-1м2моль-1, предельная электропроводность иона калия 0,00735 Ом-1м2моль-1. Вычислить предельную электропроводность хлората и его число переноса.
5. В сосуде для измерения электропроводности два электрода площадью 1,25 см2 расположены на расстоянии 10,5 см; электрическое сопротивление раствора, залитого в сосуд, 1995,6 Ом. Вычислить константу сосуда и удельную электропроводность электролита.
Вариант 1. Напишите два закона, найденных Кольраушем, для электропроводности растворов электролитов.
2. Меняется ли и как константа диссоциации электролита с ростом диэлектрической проницаемости растворителя?
3. Раствор слабой кислоты НА при 298 К и разведении 32 л/моль имеет эквивалентную электропроводность 9,2 Ом-1см2моль-1, а при бесконечном разведении она равна 389 Ом-1см2моль-1. Рассчитайте концентрацию ионов водорода в этом растворе и константу диссоциации кислоты.
4. Рассчитайте среднюю ионную активность водного раствора LaBr3 c концентрацией 0,2 моль/кг.
5. Удельная электропроводность 0,05 н раствора уксусной кислоты при 298 К равна 0,000362 Ом-1см-1. Рассчитайте степень диссоциации кислоты. Величину эквивалентной электропроводности при бесконечном разведении найдите с помощью справочных данных.
Вариант 1. Изобразите два графика зависимости удельной электропроводности при титрования сильной кислоты и слабой кислоты щелочью. В чем различие в их изображении?
2. Какова главная отличительная особенность электрической схемы для измерения электропроводности растворов электролитов по сравнению со схемой для измерения электропроводности проводников 1-го рода? Чем вызвано различие в схемах?
3. Константа диссоциации уксусной кислоты равна 1,7510-5. Для 0, молярного раствора СН3СООН рассчитайте концентрацию ионов водорода и эквивалентную электропроводность, если известно, что для этой кислоты эквивалентная электропроводность при бесконечном разведении равна 390,710-4 Смм2моль-1.
4. Рассчитайте средний ионный коэффициент активности CdI2 в водном растворе с концентрацией 0,002 моль/кг при 313 К, если при той же температуре и моляльной концентрации 0,005 он равен 0,506.
5. Произведение растворимости AgBr в воде при 25 0С равно 4,810-13.
Рассчитайте растворимость AgBr в чистой воде и в растворе NaBr с концентрацией 0,01 моль/кг.
Вариант 1. Как меняется эквивалентная электропроводность сильного электролита при увеличении разведения? Показать на рисунке.
2. Как изменяется подвижность иона в растворе по мере увеличения собственного (кристаллографического) радиуса иона, если сравнивать ряд близких по свойствам ионов одинаковой зарядности? Ответ пояснить.
3. Эквивалентная электропроводность при бесконечном разведении при 25 0С для водных растворов СН2СlСООН и СН2ClСООNa составляет соответственно 389,5 и 89,8 Ом-1см2моль-1, хотя кислота – слабый, а соль – сильный электролит. В чем причина такой большой разницы в величине ?
4. Пользуясь справочными данными, рассчитайте рН раствора фенола в воде с концентрацией 0,05 моль/л при 25 0С.
5. При 291 К удельная электропроводность насыщенного раствора хлористого серебра в воде равна 1,3710-6 Ом-1см-1. Удельная электропроводность воды при этой температуре равна 410-8 Ом-1см-1. Рассчитайте концентрацию хлористого серебра в чистой воде. Воспользуйтесь справочными данными.
Вариант 1. Что называется эквивалентной электропроводностью раствора электролита?
2. Изменится ли и как произведение растворимости малорастворимой соли, если в раствор ввести электролит, имеющий одноименный с солью ион?
3. Сопоставьте ионные силы двух растворов при одинаковой концентрации: а) раствора AgNO3 и б) раствора Co(ClO4)2. Для какого раствора ионная сила больше и во сколько раз?
4. Константа диссоциации уксусной кислоты в воде при 25 0С равна 1,7510-5. Чему будут равны концентрация ионов водорода и рН раствора, если к 1 л однонормального раствора уксусной кислоты добавить 8,2 г ацетата натрия? Принять, что объем раствора при введении соли практически не изменился.
5. Пользуясь справочными данными, рассчитайте, на сколько изменится рН раствора HClO4 в воде при 25 0С, если концентрацию изменить от 0,1 до 0,5 моль/кг.
Вариант 1. Как меняется растворимость малорастворимой соли цианистого серебра в растворе цианистого калия. Объяснить.
2. Изобразите схематически график зависимости удельная электропроводность объем щелочи при кондуктометрическом титровании смеси муравьиной и соляной кислот. Объяснить ход кривых титрования.
3. Две одноосновные органические кислоты при некоторой концентрации имеют разные степени диссоциации: первая – 0,2, вторая – 0,5.
Константа диссоциации какой кислоты больше и во сколько раз?
4. Эквивалентная электропроводность циануксусной кислоты в воде при 298 К при разных концентрациях равна:
Рассчитайте среднее значение константы диссоциации.
5. Эквивалентная электропроводность раствора монохлоруксусной кислоты с разведением 512 л/моль при 25 0С равна 219,4 Ом-1см2моль-1. Рассчитайте степень диссоциации кислоты в этих условиях, если эквивалентная электропроводность монохлоруксусного натрия при 25 0С и бесконечном разведении равна 89,8 Ом-1см2моль-1. Предельные подвижности ионов натрия и водорода соответственно равны 50,1 и 349,8 Ом-1см2моль-1.
Вариант 1. Как называется электрод, на котором в гальваническом элементе протекает реакция окисления? Привести примеры окислительных реакций.
2. Влияет ли давление газообразного хлора на величину потенциала хлорного электрода? Если да, то как? Если нет, то почему?
3. Приведите схематическую запись гальванического элемента, в котором протекает реакция 4. Известно, что с увеличением температуры ЭДС гальванического элемента уменьшается. При работе такого элемента теплота выделяется или поглощается? Доказать.
5. ЭДС цепи, составленной из стандартного водородного электрода и хингидронного, в исследуемом растворе равна 0,544 В при 298 К. Определить рН этого раствора. Воспользоваться справочником.
Вариант 1. Что представляет собой каломельный электрод? Чему равен его потенциал при стандартных условиях?
2. При 298 К ЭДС элемента РtHgHg2Cl2KCl, 0,1 нH+ нас. хингидрономРt равна 0,15 В. Рассчитать рН раствора в правом полуэлементе. Воспользоваться справочником.
3. Привести схематическую запись элемента, в котором протекает реакция 4. Написать уравнение Нернста для окислительно-восстановительной реакции, протекающей на электроде:
5. Величина dE/dT для элемента меньше нуля. Определить, выделяется или поглощается тепло при работе такого элемента? Как изменяется энтропия в этом элементе?
Вариант 1. ЭДС гальванического элемента увеличивается с увеличением температуры. Определить, выделяется или поглощается теплота при работе этого элемента?
2. Из двух электродов: никеля, опущенного в раствор сернокислого никеля, и кадмия, опущенного в раствор сернокислого кадмия, составлен гальванический элемент. Какой из этих электродов образует при 298 К отрицательный полюс гальванического элемента, если активность ионов никеля в растворе и активность ионов кадмия в растворе равны 1?
3. Пользуясь справочными данными, рассчитать ЭДС элемента при 298 К.
Pt (H2)NH4OH, 0,1 моль/кгCH3COOH, 0,1 моль/кгPt (H2) 4. Как связана величина стандартной ЭДС с величиной константы равновесия реакции, протекающей в элементе?
5. ЭДС гальванического элемента, составленного из насыщенного хлорсеребряного электрода и хингидронного в растворе, рН которого неизвестен, при 298 К равна 0,163 В. Пользуясь справочными данными, рассчитать рН раствора, если электрод сравнения отрицательный.
Вариант 1. Воспользовавшись справочным материалом, вычислить электродный потенциал системы Cl-AgCl Ag при 298 К в растворе КCl с концентрацией 0,2 моль/л.
2. Каково должно быть соотношение химических потенциалов ионов в металле и ионов в растворе, для того чтобы металл, опущенный в раствор, содержащий ионы этого металла, заряжался положительно?
3. Дать схему двойного электрического слоя, образующегося на границе раздела фаз электрод – электролит.
4. ЭДС элемента HgHg2Cl2KCl, 0,1 моль/кгAgNO3, 0,1 моль/кгAg при 298 К равна 0,399 В. Определить стандартный потенциал серебряного электрода, если известно, что потенциал 0,1 моль/кг каломельного электрода 0,334 В, а средний ионный коэффициент активности нитрата серебра в 0,1 моляльном растворе 0,734.
5. Пользуясь справочными данными, рассчитать константу равновесия реакции протекающей в гальваническом элементе при 298 К.
Вариант 1. Вычислить потенциал электрода Cl-Hg2Cl2Hg при 298 К в 0,2 моль/кг растворе хлорида натрия со средним ионным коэффициентом активности 0,735. Стандартный электродный потенциал 0,268 В.
2. Вычислить ЭДС элемента при 298 К:
3. Написать уравнение Нернста для газового электрода, обратимого относительно аниона.
4. Рассчитать константу равновесия реакции Fe(CN) 6 +1/2 I2 = Fe(CN) 3 + Iпри 298 К. Воспользоваться справочными данными.
5. Температурный коэффициент ЭДС гальванического элемента равен нулю. Каково изменение энтальпии для реакции, протекающей в этом элементе, если ЭДС равна 1 В, а число электронов 3?
Вариант 1. Какой метод применяется для измерения ЭДС гальванического элемента? Дать принципиальную электрическую схему измерения ЭДС.
2. ЭДС некоторого гальванического элемента, как функции Т, выражается уравнением Е = 0,225 – 6,810-4Т.
Вывести уравнения для расчета величин G, H, S реакции, протекающей в этом элементе при Т, если z = 2.
3. Написать уравнение химической реакции, протекающей в элементе:
4. Пользуясь справочником, рассчитать ЭДС элемента при 298 К:
ZnZnSO4 (0,01 моль/кг)ZnSO4 (0,1 моль/кг)Zn 5. Рассчитать рН раствора, если ЭДС элемента, составленного из стандартного водородного электрода и хингидронного в исследуемом растворе при 298 К, равна 0,521 В. Воспользоваться справочником.
Вариант 1. Написать уравнение Нернста для окислительно-восстановительного электрода, на котором протекает реакция 2. Вычислить ЭДС элемента при 298 К:
ZnZnCl2 (0,005 моль/кг)СdCl2 (2 моль/кг)Cd Необходимые данные взять из справочника.
3. Вычислить потенциал электрода Ag+Ag при 298 К, погруженного в раствор с концентрацией 1 моль/кг нитрата серебра со средним ионным коэффициентом активности 0,429.
4. Зависит ли потенциал электрода от температуры? Если да, то как?
Если нет, то почему?
5. Будет ли меняться и как потенциал окислительновосстановительного электрода Fe2+, Fe3+Pt, если активность ионов в растворе меняется, как показано ниже?
Вариант 1. Каково соотношение между химическими потенциалами ионов в металле и в растворе, если металл, опущенный в раствор, содержащий ионы этого металла, заряжается отрицательно?
2. Как узнать, где катод, а где анод в концентрационном гальваническом элементе?
3. Написать соотношение, связывающее ЭДС равновесной электрохимической цепи с изменением энергии Гиббса в ходе соответствующей химической реакции.
4. При 298 К ЭДС цепи, составленной из насыщенного каломельного электрода и водородного (Р Н = 1 атм), равна 0,604 В. Каково рН раствора электролита в водородном электроде? Воспользоваться справочными данными.
5. Определить знаки электродов в элементе если РН РН.
Вариант 1. Вычислить потенциал электрода SO 2 Hg2SO4Hg при 298 К, погруженного в 0,1 молярный раствор серной кислоты со средним ионным коэффициентом активности 0,265. Стандартный электродный потенциал 0,615 В.
2. Вычислить ЭДС элемента при 298 К:
Pt (H2) HCl, a =0,5 моль/кгHCl, a =2 моль/кгPt (H2) 3. Зависит ли потенциал газового электрода от парциального давления этого газа? Если да, то как? Если нет, то почему? Рассмотреть на примере водородного электрода.
4. Каков физический смысл константы Фарадея? Чему она равна и в каких единицах измеряется?
5. В каком из растворов КСl при 298 К потенциал хлорсеребряного электрода будет больше: в санти-, деци-, одномолярном или насыщенном?
Вариант 1. Что представляет собой хлорсеребряный электрод? К какому типу электродов он относится? Чему равен его потенциал при стандартных условиях?
2. Привести схематическую запись элемента Вестона. Для каких целей он применяется?
3. Гальванический элемент работает с выделением тепла в окружающую среду. Как изменяется его ЭДС с увеличением температуры?
4. Привести схематическую запись элемента, в котором протекает реакция Н2 + Cl2 = 2HCl (раствор).
5. Под каким давлением поступает водород в правый полуэлемент, если ЭДС элемента при 298 К равна 0,059 В?
Pt (H2)HCl (0,01н)Pt (H2) Вариант 1. Написать уравнение Нернста для окислительно-восстановительного электрода, на котором протекает реакция 2. ЭДС элемента ZnZnSO4 (0,005 моль/л)ZnSO4 (0,05 моль/л)Zn при 298 К равна 0,0183 В. Коэффициент активности сульфата цинка в 0,005 молярном растворе 0,477. Чему он равен в 0,05 молярном растворе?
3. Вычислить потенциал электрода Cl-Hg2Cl2Hg при 298 К, погруженного в 0,1 н раствор КСl, имеющий средний коэффициент активности 0,77. Стандартный электродный потенциал 0,268 В.
4. Температурный коэффициент ЭДС гальванического элемента с одноэлектронным переходом равен нулю. Каково изменение энтальпии для реакции, протекающей в этом элементе, если ЭДС равна 1,1 В?
5. Воспользовавшись величинами стандартных электродных потенциалов, приведенных в справочнике, найти произведение растворимости сульфида одновалентной меди.
Вариант 1. Вычислить потенциал электрода H+Pt (H2) при 298 К в 0,1 н растворе НСl со средним ионным коэффициентом активности 0,796. Давление водорода 0,1 атм.
2. Вычислить ЭДС элемента при 298 К:
3. Написать уравнение Нернста для газового электрода, обратимого относительно катиона.
4. Методом ЭДС рассчитать константу равновесия реакции при 298 К в водном растворе. Возможно ли самопроизвольное протекание этой реакции в указанном направлении, если a Sn 1, a Sn 0,01, a Ag 0,1 ?
5. Привести схематическую запись гальванического элемента, в котором протекает реакция Вариант 1. Написать уравнение Нернста для электрода, на котором протекает реакция Как будет заряжена (знак) поверхность металла, если его опустить в раствор нитрата серебра? Объяснить.
3. Привести схематическую запись элемента, в котором протекает следующая химическая реакция:
4. У какого из элементов ЭДС больше:
1. CoCoCl2 (a=0,05)CoCl2 (a=0,1)Co 2. CdCdSO4 (a=0,02)CdSO4 (a=0,06Cd ?
5. Пользуясь справочными данными, рассчитать ЭДС элемента PtHgHg2Cl2KCl (0,1 н)KCl (0,01 н)Pt (Cl2) РСд 1,5атм).
Написать уравнение реакции, протекающей самопроизвольно в этом элементе.
Вариант 1. Написать уравнение Нернста для окислительно-восстановительного электрода, на котором протекает реакция 2. Медный электрод погружен в 0,01 молярный раствор медного купороса при 298 К. Изменится ли электродный потенциал меди, если раствор разбавить вдвое? Если да, то насколько? Если нет, то почему? Ответ обосновать, пользуясь табличными данными.
3. Окислительно-восстановительный потенциал системы Fe2+, Fe3+ при отношении концентраций Fe2+/Fe3+, равном 1,22107 раз, равен 0,387 В. Вычислить стандартный потенциал этой системы, если Fe = 0,08, а Fe = 0,3.
4. Вычислить ЭДС цепи при 298 К:
HgHg2Cl2KCl (1 н)HCl (0,1 н)Pt (Cl2), 1 атм.
Стандартный потенциал хлорного электрода +1,358 В, средний ионный коэффициент активности НСl 0,796, потенциал каломельного электрода 0,2812 В.
5. Что представляет собой стеклянный электрод? Где он используется?
Вариант 1. Типы электродов, используемые в гальванических цепях. Краткая характеристика каждого типа. Привести примеры.
2. Стандартный электродный потенциал золотого электрода при 298 К равен +1,5 В. Как будет заряжена поверхность (знак) металла, если его опустить в раствор, содержащий ионы золота? Пояснить.
3. Дать схематическую запись элемента, в котором протекает реакция 4. Определить активность HCl в водном растворе, если при 298 К ЭДС цепи равна 0,458 В. Давление водорода 1 атм. Воспользоваться справочником.
5. ЭДС цепи, составленной из насыщенного каломельного электрода и водородного (давление 1 атм), равна 0,36 В. Рассчитать рН раствора электролита в водородном электроде. Воспользоваться справочными данными.
Вариант 1. Вычислить потенциал электрода Ag+Аg при 298 К в 0,01 молярном растворе нитрата серебра со средним ионным коэффициентом активности 0,9. Стандартный электродный потенциал 0,799 В.
2. Изменяется ли и как с ростом температуры ЭДС гальванического элемента, если в обратимых условиях он работает с выделением тепла?
3. Воспользовавшись величинами стандартных электродных потенциалов, приведенными в справочнике, найти произведение растворимости йодида серебра.
4. Пользуясь справочными данными, рассчитать константу равновесия реакции протекающей в гальваническом элементе при 298 К.
5. Водородный стандартный электрод соединен в электрохимическую цепь с каломельным электродом. Привести условную запись этого элемента.
Вариант 1. Как называется электрод, на котором в гальваническом элементе протекает реакция восстановления? Привести примеры восстановительных реакций.
2. Поверхность металла, опущенного в раствор своей соли, заряжена отрицательно. Каково соотношение химических потенциалов ионов в металле и в растворе?
3. Что называется концентрационным гальваническим элементом?
Дать пример такого элемента.
4. ЭДС элемента PtHgHg2Cl2KCl (0,1 н)H+ (нас. хингидроном)Pt равна 0,15 В. Пользуясь справочником, рассчитать рН раствора в правом полуэлементе.
5. Написать уравнение реакции, протекающей в элементе ZnZnCl2 (2 моль/кг)KCl (0,1 моль/кг)AgClAg Пользуясь справочными данными, рассчитать его ЭДС.
Вариант 1. Какие гальванические элементы называются химическими?
2. Что представляет собой хингидронный электрод? К какому типу электродов он относится? Для каких целей используется?
3. Как узнать, какой электрод в биметаллическом гальваническом элементе является катодом, а какой анодом? Показать на примере.
4. Напишите уравнение реакции, протекающей в элементе Моляльная концентрация хлористого цинка в растворе равна 2 моль/кг. Воспользовавшись справочными данными определить Е0 и Е при 298 К.
5. Изменяется ли ЭДС гальванического элемента с ростом температуры, если он работает с выделением тепла? Если да, то как? Если нет, то почему?
Вариант 1. Что представляет собой электролитический ключ? Каково его назначение в гальваническом элементе?
2. Написать уравнение Нернста для окислительно-восстановительного электрода, на котором протекает реакция 3. Цинковый электрод погружен в 0,1 н раствор сульфата цинка при 298 К. На сколько изменится электродный потенциал цинкового электрода, если этот раствор разбавить в 10 раз? Необходимые данные взять из справочника.
4. Какова ЭДС цепи при 298 К:
Pt (H2)CH3COOH HCOOH Pt (H2) 1 атм 1 моль/кг 0,5 моль/кг 1 атм К СН СООН = 1,7510-5; К НСООН = 1,7710-4.
5. Воспользовавшись величинами стандартных электродных потенциалов, приведенных в справочнике, найти произведение растворимости хлорида свинца.
Вариант 1. Как изменяются электродные потенциалы водородного и хлорного электродов при увеличении давления соответственно водорода и хлора?
2. Потенциал какого электрода условно принят за нуль? Дать схему такого электрода, указать условия.
3. Написать уравнение химической реакции, которая самопроизвольно протекает в гальваническом элементе:
Активности всех компонентов равны единице.
4. Элемент составлен из двух водородных электродов:
Под каким давлением должен поступать водород в левый электрод, чтобы ЭДС этого элемента при 298 К была равна 0,384 В.
5. ЭДС цепи, составленной из насыщенного каломельного электрода и хингидронного в исследуемом растворе, равна 0,135 В при 298 К. Рассчитать рН исследуемого раствора. При необходимости пользоваться справочными данными.
Вариант 1. Какие константы и экспериментальные данные необходимо иметь, чтобы рассчитать электрическую работу, совершаемую гальваническим элементом?
2. Составьте гальванический элемент, в котором протекает следующая реакция:
3. Для гальванического элемента, работающего в обратимых условиях, ЭДС при 25 0С больше, чем при 0 0С. С выделением или поглощением тепла работает этот элемент?
4. По данным справочника рассчитайте при 298 К константу равновесия реакции, приведенной п. 2.
5. Пользуясь справочными данными, рассчитайте ЭДС следующего элемента при 298 К:
NiNiSO4 (0,1 моль/л)KCl 0,005 (моль/л)CuClCuNi.
Вариант 1. Для каких целей используется каломельный электрод?
2. На окислительно-восстановительном электроде протекает реакция Зависит ли потенциал этого электрода от концентрации (активности) ионов водорода в растворе. Написать уравнение Нернста для этого электрода.
3. Составьте гальванический элемент, в котором протекает реакция 4. Осуществима ли в водном растворе при 298 К реакция если а Ag 1, a Fe 0,1, a Fe 0,01 ? Чему равна константа равновесия этой реакции при 298 К? Воспользуйтесь справочными данными.
5. Рассчитайте тепловой эффект химической реакции Если эта реакция протекает в гальваническом элементе при 298 К, а величина ЭДС и ее производная по температуре соответственно равны 0,513 В и 0,00067 В/град.
Вариант 1. Что называется условным электродным потенциалом?
2. Напишите уравнение химической реакции, протекающей в гальваническом элементе в стандартных условиях при 25 0С:
3. Какой из членов правой части уравнения Нернста для электрода 1-го рода ( 0 ln a ) дает наибольший вклад в величину электродного поzF тенциала при данной активности иона? Доказать на примерах.
4. ЭДС элемента при 25 С равна 0,675 В, а температурный коэффициент ЭДС этого элемента равен -6,510-4 В/град. Напишите уравнение реакции, протекающей в этом элементе, и рассчитайте G, S и Н для этой реакции при 25 0С.
5. ЭДС цепи, составленной из стандартного водородного электрода и хингидронного электрода в исследуемом растворе, равна 0,544 В при 25 0С.
Определите рН исследуемого раствора. Воспользоваться справочником.
Вариант 1. Каково термодинамическое условие образования положительного заряда на поверхности металла, опущенного в раствор соли этого металла?
2. Изобразите схематически график потенциометрического титрования слабой кислоты щелочью и покажите, как, пользуясь этой зависимостью, определить константу диссоциации слабой кислоты.
3. Напишите уравнение реакции, протекающей в гальваническом элементе при 25 0С в стандартных условиях:
4. Рассчитайте произведение растворимости бромистого серебра при 25 С. Воспользоваться таблицей стандартных электродных потенциалов.
5. При 298 К ЭДС цепи, составленной из насыщенного каломельного электрода и водородного с давлением водорода, равным 1 атм, равна 0,360 В.
Рассчитайте рН раствора электролита в водородном электроде.
Вариант 1. Каково термодинамическое условие образования отрицательного заряда на поверхности металла, опущенного в раствор соли этого металла?
2. Напишите уравнение Нернста для хлорного электрода.
3. При 25 0С имеются стандартный водородный электрод и цинковый электрод, помещенный в раствор ZnSO4. Составьте гальванический элемент из этих электродов и напишите уравнение реакции, протекающей в этом элементе.
4. Пользуясь справочными данными, рассчитать при 25 0С ЭДС следующего элемента:
5. Пользуясь справочником, рассчитать ЭДС следующего гальванического элемента:
CdCdSO4 (0,1 моль/л)CdCl2 (0,2 моль/л)Cd Вариант 1. Зависит ли и как от исходных концентраций реагирующих веществ период полупревращения для реакции 2-го порядка?
2. Какие экспериментальные данные необходимы для расчета предэкспоненциального множителя в уравнении Аррениуса?
3. Вывести выражение для расчета времени половинного превращения в реакциях нулевого порядка.
4. Во сколько раз возрастает скорость реакции при повышении температуры с 25 до 80 0С, если энергия активации равна 100 кДж/моль? Определить температурный коэффициент Вант-Гоффа.
5. При разложении этиленоксида в газовой фазе Получены следующие экспериментальные данные:
Каковы порядок этой реакции и константа скорости?
Вариант 1. Вывести уравнение для константы скорости реакции нулевого порядка.
2. Как меняется lgK с ростом величины 1/Т? Покажите это графически.
3. В каком количественном соотношении находятся константы скоростей двух реакций второго порядка, если исходные концентрации обоих реагирующих веществ одинаковы, а значения исходных концентраций и периоды полупревращения для этих реакций следующие:
1-я реакция – 1,5 моль/л; 200 мин;
2-я реакция – 2,0 моль/л; 300 мин?
4. При изменении начальной концентрации реагента А в реакции А В от 0,51 до 1,03 моль/л период полураспада при 25 0С снизился со 150 до 75 с.
Определить порядок и константу скорости этой реакции.
5. Энергия активации некоторой реакции равна 154,4 кДж/моль. Во сколько раз увеличится скорость реакции при повышении температуры от 200 до 250 0С, если исходные концентрации веществ при той и другой температуре равны?
Вариант 1. Указать размерность констант скоростей от нулевого до n -го порядка.
2. Как экспериментально определить порядок реакции по данному компоненту?
3. В каком количественном соотношении находятся константы скорости двух реакций первого порядка, если известно, что период полупревращения первой реакции в пять раз больше, чем второй?
4. Реакция первого порядка При 147 С наблюдали следующие изменения общего давления с течением времени:
Рассчитать константу скорости реакции.
5. Определить время половинного превращения уксусно-этилового эфира при 500 0С, если эта реакция описывается уравнением первого порядка, а предэкспоненциальный множитель и энергия активации для нее соответственно равны 3,21012 с-1 и 200,5 кДж/моль.
Вариант 1. Чем определяется максимальное количество промежуточного вещества в последовательной реакции первого порядка 2. Какие из кинетических характеристик и как можно определить по графику зависимости lgK = f(1/T)? Каков вид этого графика?
3. Вывести выражение для расчета времени полупревращения в реакциях второго порядка при равных концентрациях исходных веществ.
4. Перборат натрия разлагается по реакции первого порядка с энергией активации 96,4 кДж/моль. При 308 К константа скорости равна 4,110-3 мин-1.
Рассчитать константу скорости этой реакции при 298 К и температурный коэффициент.
5. При смешении равных объемов 0,5 молярных растворов Н2О2 и НСНО (реакция второго порядка) через 20 ч прореагировало 80 % исходных веществ. Сколько времени потребуется для того, чтобы реакция прошла до той же глубины, если исходные вещества (растворы) разбавить вдвое, а затем смешать?
Вариант 1. Вывести уравнение для выражения времени половинного превращения у реакций n-го порядка.
2. Что называется лимитирующей стадией сложной химической реакции?
3. Какой основной принцип используется при составлении кинетических уравнений сложных реакций?
4. Концентрация атомов трития в воздухе 510-15 моль/л. Период полураспада 12 лет. Через сколько лет распадется 90 % трития, содержащегося в воздухе? Пополнение его за счет реакции синтеза не учитывать.
5. Константа скорости омыления этилового эфира уксусной кислоты едким натром при 10 0С 2,38 л/(мольмин). Определить время, необходимое для омыления 90 % уксусно-этилового эфира, если смешать при 10 0С 1 л 0,05 н раствора эфира с 1 л 0,1 н раствора NaOH.
Вариант 1. В каких координатах наблюдается линейная зависимость изменения концентрации реагирующих веществ от времени для реакции n-го порядка?
2. Вывести уравнение для расчета времени половинного превращения в реакциях третьего порядка при равных концентрациях исходных веществ.
3. Что такое катализ? Особенности катализаторов.
4. Реакция высокотемпературного хлорирования этилена в диапазоне 320–380 С при избытке этилена и при степени превращения хлора не более 25 % подчиняется кинетическому уравнению первого порядка по хлору.
В течение какого времени от начала процесса при 360 0С кинетику этой реакции можно описывать уравнением первого порядка?
5. В ходе реакции взаимодействия оксида этилена с бензоилсульфамидом при 105 0С концентрация оксида этилена с течением времени меняется так:
Определить порядок реакции по оксиду этилена.
Вариант 1. В чем сущность метода Оствальда-Нойеса при определении порядка реакции?
2. Сумма констант скоростей обратимой реакции первого порядка рассчитывается по уравнению Имеет ли какой-нибудь физический смысл величина D?
3. В каких координатах наблюдается линейная зависимость изменения концентрации реагирующих веществ от времени для реакции третьего порядка?
4. При повышении температуры от 60 до 70 0С константа скорости реакции возросла в два раза. Вычислить энергию активации этой реакции.
5. Перекись водорода в присутствии коллоидальной платины разлагается с выделением кислорода.
Определить порядок реакции и время, в течение которого прореагирует 1/3 доля Н2О2.
Вариант 1. Как, используя интегральный метод, графически определить значение константы скорости реакции третьего порядка при равных начальных концентрациях реагирующих веществ? Какова ее размерность?
2. В чем сущность подстановки при определении порядка реакции?
3. Выведите формулу для расчета константы скорости реакции первого порядка.
4. Реакция первого порядка проходит на 30 % за 35 мин. Какова скорость реакции в моль/(лч) при концентрации реагирующего вещества 0,01 моль/л?
5. Для реакции экспериментально наблюдаемая константа скорости реакции имеет значения:
Рассчитать энергию активации и предэкспоненциальный множитель в уравнении Аррениуса.
Вариант 2. В чем сущность графического способа определения порядка реакции?
3. Что такое фотохимические реакции? Типы фотохимических реакций. Дать примеры.
4. Некоторое вещество А смешано в равных количествах с веществами В и С (с0 = 1 моль/л). По истечении 1000 с половина вещества А прореагировала. Сколько останется вещества А по истечении 2000 с, если эта реакция нулевого, первого или второго порядка?
5. Константа скорости реакции при 25 и 50 0С соответственно равна 0,0093 и 0,806 мин-1. Определить энергию активации и предэкспоненциальный множитель в уравнении Аррениуса.
Вариант 1. В чем сущность метода избытка реагента при определении порядка реакции?
2. Какие экспериментальные данные необходимы для определения порядка реакции?
3. Вывести уравнение константы скорости реакции второго порядка для случая равенства начальных концентраций исходных веществ.
4. При 298 К константа скорости одной реакции 2,1 моль-1лмин-1, а другой – 5500 моль-1лмин-1. Чему равна разность энергий активации этих реакций, если предэкспоненциальный множитель в уравнении Аррениуса для них одинаков?
5. Пероксид водорода в водном растворе каталитически разлагается на кислород и воду, причем полное разложение дает 6,18 мл кислорода при н.у. Объемы кислорода, собранного за различные промежутки времени, приведены ниже:
Определить порядок этой реакции и рассчитать константу скорости.
Вариант 1. Как графически определить значение константы скорости реакции второго порядка при равных начальных концентрациях реагирующих веществ?
менения концентрации во времени веществ А, В, С, если К2К1.
3. Что такое цепные реакции? Привести примеры. Дать анализ уравнения Семенова Н.Н.
4. Вычислите энергию активации и предэкспоненциальный множитель по следующим данным:
5. В сосуде протекает реакция гидрогенизации окиси азота. Если исходные газы взять в эквивалентных количествах при Р = 0,454•105 Па, то давление их уменьшается вдвое в течение 102 с, если же начальное давление 0,384•105 Па, то оно уменьшается вдвое по истечении 140 с. Определить порядок реакции.
Вариант 1. Что называется порядком реакции? Что понимают под молекулярностью реакции?
2. Рассчитать энергию активации реакции, для которой при повышении температуры от 298 до 308 К скорость реакции возрастает в 3 раза.
3. В каких координатах наблюдается линейная зависимость изменения концентрации реагирующих веществ от времени для реакций второго порядка?
4. Рассчитайте величину предэкспоненциального множителя в уравнении Аррениуса при 450 К, если при этой температуре константа скорости равна 5,4•10-4 с-1, а при 470 К она 30•10-4 с-1.
5. Во сколько раз возрастает скорость реакции при повышении температуры от 500 до 600 К, если энергия активации этой реакции равна 80 кДж/моль? Во сколько раз изменится период полуреакции, если порядок реакции первый?
Вариант 1. Как определить скорость реакции в данный момент если есть кинетическая зависимость С = f()?
2. Укажите размерность константы скорости реакции второго порядка.
3. Сформулировать эмпирическое правило Вант-Гоффа. Что показывает температурный коэффициент скорости?
4. В реакции термического распада циклопентана (реакция первого порядка) время четвертичного (25 %) превращения зависело от температуры так:
Вычислить энергию активации и предэкспоненциальный множитель в уравнении Аррениуса.
5. По мере течения реакции СО + Сl2 = COCl наблюдалось уменьшение общего давления в системе с течением времени:
Определить порядок реакции.
Вариант 1. Как зависит скорость реакции от температуры? Правило Вант-Гоффа и уравнение Аррениуса в интегральной и дифференциальной формах.
2. Для двух разных реакций при Т1: К1 = К2, а Е1 E2. Какая из констант скоростей этих реакций больше при Т2 Т1, если механизм реакции при изменении температуры не изменяется?
3. Что такое актор, индуктор, акцептор? Чем объясняется химическая индукция согласно теории Шилова? Приведите примеры сопряженных реакций.
4. Вычислите энергию активации реакции на основании следующих данных:
Чему равен предэкспоненциальный множитель в уравнении Аррениуса?
5. Определить порядок реакции 2СО = 2СО2 + С при 583 К, если в одном случае давление за 30 мин уменьшилось с 1,049•105 до 0,924• Н/м2, а в другом за тот же период с 0,714•105 до 0,628•105 H/м2.
Вариант 1. Зависит ли период полупревращения для реакции первого порядка от начальной концентрации реагирующего вещества? Если да, то как?
Если нет, то почему?
2. В интервале температур 200 – 330 0С метанол окисляется по схеме:
C ростом температуры константа скорости первой реакции растет быстрее, чем второй. Какая из этих реакций обладает большей энергией активации?
3. В каких координатах наблюдается линейная зависимость изменения концентрации реагирующих веществ от времени для реакции нулевого порядка?
4. При изучении кинетики бимолекулярной реакции были получены следующие данные:
Рассчитать энергию активации и предэкспоненциальный множитель в уравнении Аррениуса.
5. Для реакции превращения параводорода в ортоводород была получена следующая зависимость:
(Р0 – начальное давление пара-водорода).
Определить порядок реакции.
Вариант 1. Порядок реакции А В равен нулю. Изменяется ли концентрация вещества В во времени? Если да, то как изменяется? Если нет, то почему?
2. В каком соотношении находятся константы скорости двух реакций второго порядка, если значения начальных концентраций и периода полупревращений для них следующие:
2) С А С В = 0,02моль/л 1/2 = 2 мин.
3. Вывести кинетическое уравнение реакции n-го порядка в интегральной форме для случая равенства концентраций исходных веществ.
4. Реакция аммиака с диоксидом азота на начальной стадии следует кинетике второго порядка. Константа скорости этой реакции при 600 К равна 0,385 лмоль-1с-1, а при 716 К она 16 лмоль-1с-1. Определить энергию активации этой реакции и предэкспоненциальный множитель в уравнении Аррениуса.
5. Реакция первого порядка проходит за 30 мин на 40 %. Какова скорость реакции в моль/лч при концентрации вещества 0,05 моль/л?
Вариант 1. В каком случае реакцию можно считать кинетически обратимой?
2. Начальную концентрацию вещества, вступающего в реакцию второго порядка, увеличили в 10 раз. Как и во сколько раз изменится период полупревращения для этой реакции?
3. Вывести кинетическое уравнение реакции первого порядка в интегральной форме.
4. При 180 0С жидкая диметилмалоновая кислота разлагается с выделением углекислого газа (реакция первого порядка). Рассчитать константу скорости и период полураспада для этой реакции, если объем системы при постоянном давлении изменяется с течением времени так:
5. Реакция образования дифенилгидразона является реакцией второго порядка. При 0 0С константа скорости 0,69 л/(мольс), а при 20 0С – 1,69 л/(мольс). Рассчитать энергию активации и предэкспоненциальный множитель в уравнении Аррениуса.
Вариант 1. Как называется величина К в кинетическом уравнении: V KC A C B ?
Каков ее физический смысл? Укажите размерность этой величины, если 2. Как зависит от исходных концентраций реагирующих веществ период полупревращения для реакции второго порядка?
3. В каких координатах наблюдается линейная зависимость изменения концентрации реагирующих веществ от времени для реакции первого порядка?
4. При изучении кинетики распада диэтилперекиси получены следующие константы скорости реакции при различных температурах:
Рассчитать энергию активации и предэкспоненциальный множитель в уравнении Аррениуса.
5. Реакция термического разложения этана является реакцией первого порядка. При 823 К константа скорости этой реакции равна 2,5105 с-1, а при 903 К 141,5105 с-1. Рассчитайте период полупревращения для этой реакции при 873 К.
Вариант 1. Перечислите основные положения мультиплетной теории катализа Баландина А.А.
2. Что представляют собой последовательные реакции? Приведите график изменения концентраций всех участников реакций.
3. В чем состоит существо теории активных столкновений? Что такое стерический фактор?
4. Реакцию окисления бромистого водорода исследовали при различных температурах, при этом получена следующая зависимость:
Рассчитать энергию активации и предэкспоненциальный множитель в уравнении Аррениуса.
5. Реакция А + В = С второго порядка. Если исходные концентрации равны, то за 500 с реакция проходит на 20 %. За какое время она пройдет на 60 %?
Вариант 1. Могут ли величины молекулярности и порядка реакции быть меньше единицы или дробными? Если могут, то в каких случаях? Если нет, то почему?
2. Как зависит константа скорости реакции от температуры согласно уравнению Аррениуса? Представить эту зависимость в «аррениусовых»
3. Вывести уравнение для константы скорости реакции третьего порядка в интегральной форме для случая равенства концентраций исходных веществ.
4. При изучении кинетики реакции между фтором и окисью углерода была получена следующая зависимость:
Рассчитать энергию активации и предэкспоненциальный множитель в уравнении Аррениуса для этой реакции.
5. При одной и той же концентрации реагирующих веществ скорость реакции при 40 0С втрое выше, чем при 30 0С. Вычислить производную от натурального логарифма константы скорости реакции по температуре при 310 К.
Вариант 1. Как изменяется концентрация исходного вещества со временем, если реакция нулевого порядка. Показать на графике.
2. Как экспериментально определить порядок реакции по данному компоненту?
3. Как графически определить константу скорости реакции второго порядка при равных исходных концентрациях реагирующих веществ?
4. Пользуясь зависимостью между временем полураспада и начальным давлением, определите порядок реакции конверсии параводорода в ортоводород при температуре 923 К.
5. Константа скорости разложения йодистого водорода при 356 0С равна 8,0910-5 лмоль-1с-1, а при 389 0С – 58,810-5 лмоль-1с-1. Рассчитайте константу скорости реакции при 374 0С.
Вариант 1. Что называется лимитирующей стадией сложной химической реакции?
2. Укажите размерности констант скорости реакций нулевого, первого, второго порядков. Можно ли сравнивать константы скорости реакций разных порядков?
3. При изучении реакции разложения ацетона в газовой фазе были получены экспериментальные данные:
Определите порядок реакции и константу скорости.
4. Рассчитайте величину предэкспоненциального множителя в уравнении Аррениуса при 393 К, если при этой температуре константа скорости реакции равна 4,0210-4 с-1, а при 413 К – 19,8310-4 с-1.
5. Реакция разложения перекиси водорода в водном растворе протекает как реакция первого порядка. Период половины превращения Н2О2 при заданных условиях равен 15,86 мин. Определить, какое время потребуется для разложения (при тех же условиях) 99 % Н2О2.
Вариант 1. Назовите стадии гетерогенной реакции.
2. Поясните термин «молекулярность» реакции. Почему молекулярность реакций не превышает трех?
3. Как графически определить значение константы скорости реакции второго порядка при равных исходных концентрациях реагирующих веществ?
4. Показать, что разложение перекиси водорода в водном растворе является реакцией первого порядка. Использовать данные титрования перманганатом калия остатка неразложившейся перекиси водорода в определенном объеме:
5. Используя приближенное правило Вант-Гоффа, вычислить, на сколько нужно повысить температуру, чтобы скорость реакция возросла в 80 раз? Температурный коэффициент скорости принять равным 3.
Вариант 1. В чем суть теории активных ансамблей Кобозева Н.И.?
2. Для каких реакций концентрация исходного вещества всегда линейно уменьшается со временем?
3. Основные положения теории активных соударений.
4. В реакционный сосуд вводят эквивалентные количества I2 и натриевой соли фенилпропионовой кислоты. За течением реакции следят, отбирая пробы и титруя йод тиосульфатом натрия. Были проведены 2 опыта, экспериментальные данные для которых следующие:
Определить порядок реакции, если объем отбираемых проб одинаков в обоих опытах.
5. Для одной из реакций были определены две константы скорости:
при 443 0С 0,00670 и при 497 0С 0,06857. Определить константу скорости этой же реакции при 508 0С.
Вариант 1. Что собой представляют каталитические яды? Каков механизм их действия?
2. Сопоставьте константы скоростей двух реакций первого порядка К и К2, если период полупревращения первой реакции в пять раз больше, чем второй. Доказать.
3. Как графически определить значение константы скорости реакции первого порядка?
4. Константа скорости реакции второго порядка равна 5,4 л/(мольс). Сколько эфира прореагирует за 10 мин при одинаковых начальных концентрациях, равных 0,02 моль/л? Какова должна быть исходная концентрация эфира, чтобы за это же время прореагировало 98 % эфира?
5. Константа скорости реакции омыления этилацетата едким натром при 9,4 0С равна 2,37, а при 14,4 0С 3,204. Рассчитать температурный коэффициент скорости реакции в указанном интервале температур и энергию активации.
Предельная молярная электрическая проводимость (подвижность) ионов (оксалат-ион) Средние ионные коэффициенты активности сильных электролитов в Константы диссоциации слабых кислот и оснований Стандартные электродные потенциалы в водных растворах при 25 0С Fe(CN)63-, Fe(CN)64+(Pt) Fe(CN)63- + e Fe(CN)64- +0, H+, C6H4O2, H+, Cr2O72-, Cr3+ (Pt) Cr2O72- + 14H+ + 6e Cr3+ + 7H2O +1,
Видео:Выполнялка 53.Гармонические колебания.Скачать

ВОПРОСЫ И ЗАДАЧИ
Видео:Плавление и кристаллизация твердых тел, температура плавления, удельная теплота плавления. 8 класс.Скачать

ПО ФИЗИЧЕСКОЙ ХИМИИ




















© 2013 www.diss.seluk.ru — «Бесплатная электронная библиотека — Авторефераты, Диссертации, Монографии, Методички, учебные программы»
Материалы этого сайта размещены для ознакомления, все права принадлежат их авторам.
Если Вы не согласны с тем, что Ваш материал размещён на этом сайте, пожалуйста, напишите нам, мы в течении 1-2 рабочих дней удалим его.
Видео:5.3. Адсорбция на границе жидкость-газ. Поверхностно активные вещества ПАВСкачать

Лабораторные работы и задачи по физической химии (стр. 5 )
 | Из за большого объема этот материал размещен на нескольких страницах: 1 2 3 4 5 6 7 8 9 10 |




 |










 |
15. Провести конноды, отвечающие температурам 40, 45, 50, 60, 65оС (или другим, указанным преподавателем), как показано на рисунке. Определить составы сопряжённых растворов при температурах, указанных преподавателем.
16. Найти и отметить точки, отвечающие среднему арифметическому из составов сопряжённых фаз, которые находятся точно в середине каждой конноды. Провести прямую линию, соединяющую середины коннод, и продлить её до пересечения с кривой расслоения. Определить критическую температуру растворения системы. Установить, подчиняется ли данная система правилу Алексеева.
17. Занести расчетные данные в таблицу.
Составы сопряжённых фаз:
Среднее арифметическое из
состава сопряжённых фаз:
Критическая температура растворения КТР =
18. Сформулировать выводы.
Видео:Валентность. Учимся определять валентность элементов по формуламСкачать

Работа 2.4. Определение коэффициента распределения третьего компонента между двумя жидкими фазами.
Цель работы: Определение коэффициента распределения третьего компонента между водой и органическим растворителем путем проведения жидкостной экстракции.
Целевые задачи: Проведение жидкостной экстракции третьего компонента из водного раствора органическим растворителем; титриметрическое определение концентрации третьего компонента в обеих фазах системы; расчет коэффициента распределения и степени ассоциации вещества в органическом растворителе; оценка экстракционной эффективности органического растворителя.
Если в систему из двух несмешивающихся жидкостей ввести небольшое количество третьего компонента, то после установления равновесия он окажется в обеих фазах, но в разном количестве. Для каждой температуры отношение концентраций третьего компонента в двух равновесных жидких фазах является величиной постоянной, независимо от этих концентраций (закон распределения Нернста):
где К — коэффициент распределения.
Закон распределения является теоретической основой жидкостной экстракции. Экстракцией из растворов называется извлечение и разделение компонентов раствора путем перевода их из одной жидкой фазы в другую, содержащую экстрагент. Основными условиями экстракции являются:
а) несмешиваемость экстрагента с исходным раствором,
б) отсутствие химического взаимодействия извлекаемого вещества с экстрагентом,
в) намного большая растворимость извлекаемого вещества в экстраген — те, чем в первоначальном растворителе.
Фаза, в которую после экстракции переходит извлекаемое вещество, называется экстрактом, а фаза, обедненная им — рафинатом.
Количественной характеристикой эффективности экстракции является коэффициент распределения. В данных методических указаниях выбрана такая система обозначений: С1 — концентрация извлекаемого вещества в рафинате, С2 — его концентрация в экстракте. При этом чем меньше значение коэффициента распределения, тем эффективнее экстрагент и тем больше степень извлечения третьего компонента. Она определяется как отношение массы извлекаемого вещества в экстракте к его массе, содержавшейся в исходном растворе до экстракции.
В ряде случаев при переходе третьего компонента через поверхность раздела фаз его средняя молярная масса изменяется вследствие ассоциации или диссоциации в одном из растворителей. В таких случаях уравнение закона распределения можно представить в виде
где n — показатель при данной температуре, обусловленный свойствами
всех трех компонентов системы, и представляющий собой отношение средних молярных масс третьего компонента в исходном растворителе и в экстрагенте. Например, если уксусная кислота в воде существует главным образом в виде отдельных молекул, а в бензоле — в виде ассоциатов из двух молекул (димеров), то:
Массоциата 120 2
Из методов определения К наиболее употребителен графический. Его принцип заключается в следующем. Уравнение (1) путем логарифмирования линеаризуется, т. е. преобразуется в уравнение прямой, не проходящей через начало координат:
lgC1 = lgK + n lgC2 .
Затем по экспериментальным данным строится график зависимости lgC1 от lgC2, отсекающий от оси ординат отрезок, равный lgK. Тангенс угла наклона этого графика к оси абсцисс равен n. (подробнее об этом см. «Проведение опыта»).
Оснащение рабочего места
Пипетка на 1 мл. Склянки с пробками на 100 мл.
Колбы для титрования. Раствор NаОН 0,1 н.
Цилиндр на 10 мл. Бюретка на 25 мл.
Раствор фенолфталеина в спирте.
Растворы экстрагируемого вещества и органические растворители (по указанию преподавателя).
ВНИМАНИЕ! Органические растворители отмеривать только под
тягой! После окончания работы категорически запрещается сливать
их в канализацию. Для этого имеется специальный сосуд в вытяжном шкафу.
1. Проверить оснащение рабочего места.
2. Измерить и записать температуру.
3. В три склянки с притертыми пробками поместить по 10 мл водных растворов экстрагируемого вещества кислотной природы (по указанию преподавателя).
4. Добавить к каждому раствору по 10 мл указанного преподавателем органического растворителя (под тягой!).
5. Склянки плотно закрыть пробками и после интенсивного встряхивания в течение трех минут оставить для перераспределения не менее чем на 20 минут.
6. Определить титрованием концентрацию экстрагируемого вещества во всех исходных растворах (обозначается С0I, С0II и С0III) для чего отмерить 1 мл исходного раствора экстрагируемого вещества в колбу для титрования, затем добавить 1 каплю раствора фенолфталеина и титровать 0,1 н. раствором NaOH до появления слабо-розового окрашивания, не исчезающего в течениесекунд. Повторить титрование трижды для каждого раствора. Рассчитать С0I, С0II и С0III по уравнению:
где VNaOH — объём раствора NaOH, пошедший на титрование (среднее арифметическое из результатов трех титрований), CNaOH — концентрация NaOH, моль-экв/л, Vк — объём раствора экстрагируемого вещества, взятый для титрования (в данном случае – 1 мл).
Данные занести в таблицу 1.
7. После установления экстракционного равновесия определить равновесные концентрации экстрагируемого вещества С1I, С1II и С1III в водном слое (рафинате). Для этого из склянок отобрать пипеткой по 1 мл водных растворов экстрагируемого вещества (нижний слой) в колбы для титрования и оттитровать 0,1 н. раствором NaOH. Титрование провести трижды для каждого раствора (все результаты титрования сверить у преподавателя). Для расчета использовать уравнение (2).
8. По разности С0 – С1 = С2 вычислить равновесные концентрации экстрагируемого вещества С2I, С2II и С2III в органическом слое (экстракте). Данные сверить у преподавателя и занести в таблицу 1.
9. Рассчитать логарифмы С1 и С2 (с точностью до четырех десятичных
знаков) и занести данные в таблицу 1.
11. Построить график зависимости lgC1 от lgC2 (см. рис.) и продлить его до пересечения с осью Y. При этом от неё отсекается отрезок ОВ, равный lgК, а тангенс угла наклона графика к оси Х равен n.

 |
 |
 |
Рассчитать коэффициент распределения К = 10ОВ. Построить прямоугольный треугольник АВС (так, чтобы отрезки ВС и АС были как можно больше для повышения точности расчета). Рассчитать степень ассоциации экстрагируемого вещества в экстрагенте n = BC/AC.
Примечание. Отрезки ВС и АС измеряются в масштабных единицах.
12. Рассчитать по уравнению (1) К для каждого опыта (КI, КII и КIII) и вычислить среднее арифметическое. Сравнить это значение с найденным графически. Все расчетные данные занести в таблицу 2.
13. Привести в порядок рабочее место и сдать его дежурному.
Температура T = îÑ
Органический растворитель (экстрагент):
Степень ассоциации вещества в экстрагенте n =
найденный графически: К =
рассчитанный по уравнению Нернста: Ксредн =
14. Сформулировать выводы.
Видео:Практическое занятие 5. Уравнение БЭТ. Удельная поверхностьСкачать

Тема 3. Кондуктометрия
Кондуктометрия – совокупность физико-химических методов исследования и анализа различных систем (главным образом водных растворов), основанных на измерении электрической проводимости. Кондуктометрический метод позволяет определить наличие или отсутствие диссоциации исследуемого вещества в растворе (т. е. является оно электролитом или нет), термодинамические характеристики электролитической диссоциации вещества (в частности, энергию диссоциации), растворимость труднорастворимых соединений, степень и константу диссоциации слабых электролитов, константы устойчивости комплексных ионов и др.
Зависимость электрической проводимости растворов от концентрации веществ лежит в основе одного из методов количественного анализа — кондуктометрического титрования.
Перечисленные возможности кондуктометрического метода определяют его значение для фармацевтического анализа лекарственных веществ, для описания свойств новых веществ (как синтезированных, так и выделенных из растительного сырья), а также для изучения термодинамики и кинетики биохимических и физиологических процессов, связанных с проницаемостью биологических мембран, со свойствами аминокислот, белков и других, способных к ионизации соединений.
Изучив данную тему и выполнив лабораторные работы, относящиеся к ней, студент должен знать:
n свойства растворов электролитов;
n теорию электролитической диссоциации;
n основные положения теории растворов сильных электролитов Дебая–Хюккеля;
n закон разведения Оствальда, закон Кольрауша;
n расчетные формулы используемых кондуктометрических методов;
n устройство и принцип работы кондуктометра.
n измерять электрическое сопротивление растворов электролитов с помощью кондуктометра;
n рассчитывать константу ячейки кондуктометра;
n определять удельную и эквивалентную электрические проводимости, степень и константу диссоциации (ионизации) электролитов;
n проводить кондуктометрическое титрование;
n строить и анализировать кривые кондуктометрического титрования.
Студент должен приобрести или закрепить навыки:
n приготовления, разбавления и отмеривания растворов;
n расчета концентрации веществ в растворах;
n табулирования величин, построения и анализа графиков;
Вопросы для самоподготовки.
1. Электрохимия. Основные понятия. Электролитическая диссоциация. Теория растворов сильных электролитов Дебая-Хюккеля. Ионная сила растворов.
2. Коллигативные свойства (криоскопия, эбуллиоскопия, осмотическое давление) растворов электролитов. Изотонический и осмотический коэффициенты, их расчет.
3. Электролитическая диссоциация воды. Водородный показатель рН как мера активной реакции среды.
4. Буферные растворы в фармации. Механизм буферного действия. Связь рН буферных растворов с их составом. Буферная ёмкость.
5. Активность ионов и её связь с концентрацией электролита. Коэффициент активности. Константа диссоциации слабых электролитов. Степень диссоциации. Закон разведения Оствальда. Вывод его математического выражения.
6. Удельная и эквивалентная (мольная) электрическая проводимость растворов. Зависимость электропроводимости от различных факторов. Подвижность ионов. Закон Кольрауша.
7. Кондуктометрическое определение степени и константы диссоциации слабых электролитов.
8. Кондуктометрическое титрование.
Решение типовых задач.
Задача 1. Удельная электрическая проводимость 0,175 М раствора аммиака равна 0,476 Ом-1см-1. Подвижности ионов NH4+ и ОН– при 25оС соответственно равны 73,5 и 198,3 Ом-1см2моль-1. Рассчитать молярную проводимость, степень и константу ионизации аммиака рКb, концентрацию ионов водорода в растворе и его рН.
Решение: Удельная k и молярная l электрические проводимости связаны между собой соотношением l = k/С, где С – концентрация в моль/л.
l = ¾¾¾¾¾ = 2,72 Ом-1см2моль-1
Степень ионизации вычисляется с помощью уравнения: a = l/l¥, где l¥ – мольная (эквивалентная) проводимость при бесконечном разведении, которую определяют по закону Кольрауша: l¥ = l+ + l, (где l+ и l- – подвижности ионов).
l¥ = 73,5 + 198,3 = 271,8 Ом-1см2моль-1,
отсюда: a = 2,72/271,8 = 0,01.
В соответствии с законом разведения Оствальда
где К — константа ионизации электролита (в данном случае К = Кb аммиака), С — концентрация в моль/л,
Отсюда рКb = — lg Кb = 4,752.
Концентрация ионов ОН — в растворе будет равна aС:
Сон- = 0,01´0,175 = 0,00175 моль/л.
Отсюда рОН = — lg 0,00175 = 2,76; рН =,76 = 11,24.
Задачи для самостоятельного решения.
Задача 1. Эквивалентная электрическая проводимость при бесконечном разведении пикрата калия при 25оС равна 1,0397 Ом-1см2моль-1. Подвижность иона калия 0,7358 Ом-1см2моль-1 . Рассчитать подвижность пикрат-иона. Какова будет эквивалентная электрическая проводимость раствора при степени диссоциации пикрата калия, равной 0,2?
Ответ: 0,3039 Ом-1см2моль-1; 0,2079 Ом-1см2моль-1.
Задача 2. Эквивалентная электрическая проводимость 0,117 М раствора уксусной кислоты при 25оС равна 4,815 Ом-1см2моль-1. Рассчитать степень диссоциации СН3СООН в этом растворе и константу диссоциации, если подвижность ионов водорода и ацетата при 25оС, соответственно, равны 349,8 и 40,9 Ом-1см2моль-1.
Видео:Электропроводность сильных и слабых электролитовСкачать

РАБОТА 3.1.
Видео:Поверхностные явления. Адсорбция на подвижных границах раздела фаз.Скачать

Определение константы и степени диссоциации (ионизации) слабых электролитов в водных растворах.
Цель работы: определение степени и константы диссоциации (ионизации) слабых электролитов кондуктометрическим методом.
Целевые задачи: Освоение кондуктометрического метода; расчет константы ячейки (ёмкости сопротивления); измерение сопротивления растворов слабых электролитов; определение удельной и молярной электрической проводимости, степени и константы ионизации растворов электролитов.
Электрическая проводимость раствора – свойство, характеризующее способность проводить электрический ток. Она зависит от количества и природы ионов, природы растворителя и температуры раствора. Измерение электрической проводимости лежит в основе метода исследования и анализа, называемого кондуктометрией. Различают прямую кондуктометрию и кондуктометрическое титрование.
В прямой кондуктометрии по электрической проводимости находят степень и константу диссоциации электролитов, константу устойчивости комплексных соединений, произведение растворимости солей и т. д.
При кондуктометрическом титровании по изменению электрической проводимости контролируют ход взаимодействия титранта с определяемым веществом и находят эквивалентные точки реакций нейтрализации, осаждения, окисления – восстановления и др.
Электрическую проводимость определяют по сопротивлению, которое измеряют с помощью установки, состоящей из измерительного прибора — кондуктометра и кондуктометрической ячейки.
Растворы электролитов характеризуются удельной и эквивалентной электрическими проводимостями.
Удельная электрическая проводимость k – величина, обратная удельному сопротивлению раствора r (которое можно рассчитать, зная общее сопротивление R, длину и площадь поперечного сечения проводника: r = RS/l): k= 1/r. Размерность её в системе СИ Ом-1м-1, однако в практических расчетах обычно используется размерность Ом-1см-1. Физический смысл k при этом будет таким: проводимость объёма раствора, заключенного между двумя плоскими параллельными электродами (площадь поверхности каждого из которых равна 1 см2), расположенными на расстоянии 1 см друг от друга.
Эквивалентная (мольная) электрическая проводимость l — проводимость объёма раствора, содержащего 1 моль эквивалента исследуемого вещества, и заключенного в объёме между плоскими параллельными электродами, расположенными на расстоянии 1см друг от друга. Размерность l в системе СИ Ом-1м2моль-1, однако пользуются и другой размерностью (Ом-1см2моль-1).
Эквивалентная и удельная электропроводимости связаны между собой уравнением:
где V – разведение, то есть объём (в см3) раствора, в котором содержится 1 моль эквивалента исследуемого электролита.
Так как V = 1/С (где С – концентрация), то, при выражении концентрации в моль/л, получается соотношение
где 1000 – пересчетный коэффициент из л в см3.
Проводимость растворов зависит от концентрации, температуры, природы растворенного вещества и растворителя, вязкости, диэлектрической проницаемости и других факторов. Поэтому для характеристики свойств электролита в данном растворителе в кондуктометрии обычно используют эквивалентную (мольную) электрическую проводимость при бесконечном разведении l¥. Она представляет собой предел, к которому стремится l с ростом разведения (или с уменьшением концентрации, стремящейся к нулю).
В соответствии с законом Кольрауша l¥ может быть рассчитана как сумма ионных электрических проводимостей при бесконечном разведении (или, иначе, подвижностей ионов):
Устройство кондуктометра и принцип его действия
Кондуктометр состоит из измерительного прибора и кондуктометрической ячейки, в которую помещается исследуемый раствор электролита. Ячейка представляет собой стеклянный сосуд с вмонтированными в него электродами.
Для прецизионных (высокоточных) измерений используются платиновые электроды, покрытые для увеличения поверхности слоем тонкодисперсной платины (платиновой чернью). При менее точных измерениях, в т. ч. для учебных целей, можно использовать электроды из других металлов (инертных по отношению к исследуемому раствору).
Поскольку невозможно изготовить ячейки с одинаковыми характеристиками, для получения соизмеримых результатов надо для каждой ячейки определять поправочный коэффициент (т. н. константу ячейки). Константа находится с помощью измерения сопротивления данной ячейки, заполненной эталонным раствором с известной электропроводимостью, обычно 0,02 М раствором хлорида калия:
где kKCl — удельная проводимость раствора KCl при температуре опыта.
В основе конструкции кондуктометра лежит схема четырехплечного уравновешенного моста (мост Уитстона), изображенная на рисунке.
Ток, поступающий от источника в точку А, разветвляется к точкам В и D и затем через точку Е возвращается к источнику. Сопротивления отрезков АВ, ВЕ, АD и DЕ соответственно равны Rx, R3, R1, R2. Если к точкам В и D подключить нуль-индикатор (гальванометр) U, то в том случае, когда падения напряжения на участках АВ и АD и, соответственно, ВЕ и DЕ будут одинаковы, он покажет отсутствие тока. При этом будет иметь место соотношение
называемое уравнением баланса моста. Сопротивления R1 и R2 выбираются так, чтобы они были одного порядка с измеряемым сопротивлением, а в качестве R3 берутся магазин сопротивлений и реохорд. Если известны сопротивления R1, R2, и R3, то можно определить и исследуемое сопротивление Rx.
Оснащение рабочего места
Кондуктометр Мерные цилиндры
Ячейка для измерения Колбы или стаканы на 50 мл
электропроводимости Бюретка на 50 мл
Раствор хлорида калия 0,02 М Термометр
Растворы слабых электролитов
1. Проверить оснащение рабочего места. Измерить и записать температуру, при которой проводится опыт.
2. Приготовить методом разбавления вдвое растворы слабого электролита (по указанию преподавателя). Для этого, например, отмерить в 4 колбы (пронумерованные от № 1 до № 4) по 30 мл дистиллированной воды. Добавить в 4-ю колбу 30 мл исходного раствора электролита. После тщательного перемешивания перенести последовательно по 30 мл раствора из 4-й колбы в 3-ю, из 3-й — во 2-ю, из 2-й — в 1-ю. В колбу № 5 отмерить 30 мл исходного раствора электролита.
3. Подготовить к работе кондуктометр, для чего не менее 3 раз промыть дистиллированной водой ячейку кондуктометра; подключить её к клеммам «датчик»; установить ручку «термокомпенсация» в положение, соответствующее температуре опыта; включить прибор в сеть в соответствии с описанием и инструкцией.
4. Для определения константы ячейки Кя поместить в ячейку эталонный 0,02 М раствор хлорида калия и измерить его сопротивление RKCl.
🎥 Видео
Уравнения и графики механических гармонических колебаний. Практ. часть - решение задачи. 11 класс.Скачать

Практическое занятие 4. Адсорбция на границе твердое тело – газСкачать

5.2. Молекулярная адсорбция ПАВ на поверхности раздела раствор-воздухСкачать

электроотрицательность задания/8 классСкачать

Электродные потенциалы металлов. Электроды сравненияСкачать

Теории кислот, оснований и растворов. Теория Аррениуса-Оствальда. 11 класс.Скачать

Хим. кинетика 3 часть | Физическая химияСкачать

Электроотрицательность химических элементов. 8 класс.Скачать
Свободные электромагнитные колебания. 11 класс.Скачать

Электроотрицательность и полярность связи. 10 класс.Скачать

Понятие электроотрицательности, 8 классСкачать