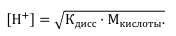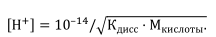Материалы портала onx.distant.ru
Видео:Определение реакций опор в балке. Сопромат.Скачать

Эквивалент. Закон эквивалентов
Эквивалент – реальная или условная частица вещества Х, которая в данной кислотно-основной реакции или реакции обмена эквивалентна одному иону водорода Н + (одному иону ОН — или единичному заряду), а в данной окислительно- восстановительной реакции эквивалентна одному электрону.
Фактор эквивалентности fэкв(X) – число, показывающее, какая доля реальной или условной частицы вещества Х эквивалентна одному иону водорода или одному электрону в данной реакции, т.е. доля, которую составляет эквивалент от молекулы, иона, атома или формульной единицы вещества.
Наряду с понятием “количество вещества”, соответствующее числу его моль, используется также понятие количество эквивалентов вещества.
Закон эквивалентов: вещества реагируют в количествах, пропорциональных их эквивалентам. Если взято n(экв1) моль эквивалентов одного вещества, то столько же моль эквивалентов другого вещества n(экв2) потребуется в данной реакции, т.е.
При проведении расчетов необходимо использовать следующие соотношения:
1. Молярная масса эквивалента вещества X равна его молярной массе, умноженной на фактор эквивалентности:
2. Количество эквивалентов вещества X определяется делением его массы на молярную массу эквивалента:
3. Объём моль-эквивалента газа Х при н.у. равен молярному объёму газа, умноженному на фактор эквивалентности:
4. Молярная масса эквивалента сложного вещества равна сумме молярных масс эквивалентов составляющих это вещество атомов (ионов).
5. Молярная масса эквивалента оксида равна молярной массе эквивалента элемента плюс молярная масса эквивалента кислорода.
6. Молярная масса эквивалента гидроксида металла равна молярной массе эквивалента металла плюс молярная масса эквивалента гидроксила, например:
М[½Са(ОН)2] = 20 + 17 = 37 г/моль.
7. Молярная масса эквивалента сульфата металла равна молярной массе эквивалента металла плюс молярная масса эквивалента SO4 2- , например,
М(½ СаSO4) = 20 + 48 = 68 г/моль.
Видео:Эквивалент и закон эквивалентовСкачать

Эквивалент в кислотно-основных реакциях
На примере взаимодействия ортофосфорной кислоты со щелочью с образованием дигидро-, гидро- и среднего фосфата рассмотрим эквивалент вещества H3PO4.
Эквивалент NaOH соответствует формульной единице этого вещества, так как фактор эквивалентности NaOH равен единице. В первом уравнении реакции молярное соотношение реагентов равно 1:1, следовательно, фактор эквивалентности H3PO4 в этой реакции равен 1, а эквивалентом является формульная единица вещества H3PO4.
Во втором уравнении реакции молярное отношение реагентов H3PO4 и NaOH составляет 1:2, т.е. фактор эквивалентности H3PO4 равен 1/2 и её эквивалентом является 1/2 часть формульной единицы вещества H3PO4 .
В третьем уравнении реакции количество веществ реагентов относятся друг к другу как 1:3. Следовательно, фактор эквивалентности H3PO4 равен 1/3, а её эквивалентом является 1/3 часть формульной единицы вещества H3PO4.
Таким образом, эквивалент вещества зависит от вида химического превращения, в котором принимает участие рассматриваемое вещество.
Следует обратить внимание на эффективность применения закона эквивалентов: стехиометрические расчёты упрощаются при использовании закона эквивалентов, в частности, при проведении этих расчётов отпадает необходимость записывать полное уравнение химической реакции и учитывать стехиометрические коэффициенты. Например, на взаимодействие без остатка 0,25 моль-экв ортофосфата натрия потребуется равное количество эквивалентов вещества хлорида кальция, т.е. n(1/2CaCl2) = 0,25 моль.
Видео:Составление ур-й окислительно-восст. реакций методом ионно-электронного баланса. 1ч. 10 класс.Скачать

Эквивалент в окислительно-восстановительных реакциях
Фактор эквивалентности соединений в окислительно-восстановительных реакциях равен:
где n – число отданных или присоединенных электронов.
Для определения фактора эквивалентности рассмотрим три уравнения реакций с участием перманганата калия:
В результате получаем следующую схему превращения KMnO4.
в кислой среде: Mn +7 + 5e = Mn +2
в нейтральной среде: Mn +7 + 3e = Mn +4
в щелочной среде: Mn +7 + 1e = Mn +6
Схема превращений KMnO4 в различных средах
Таким образом, в первой реакции fэкв(KMnO4) = 1/5, во второй – fэкв(KMnO4) = 1/3, в третьей – fэкв(KMnO4) = 1.
Следует подчеркнуть, что фактор эквивалентности дихромата калия, реагирующего в качестве окислителя в кислой среде, равен 1/6:
Видео:Эквивалент. Часть 1. Эквивалент элемента. Задачи.Скачать

Примеры решения задач
Задача 1. Определить фактор эквивалентности сульфата алюминия, который взаимодействует со щелочью.
Решение. В данном случае возможно несколько вариантов ответа:
Задача 2. Определить факторы эквивалентности Fe3О4 и KCr(SO4)2 в реакциях взаимодействия оксида железа с избытком хлороводородной кислоты и взаимодействия двойной соли KCr(SO4)2 со стехиометрическим количеством щёлочи КОН с образованием гидроксида хрома (III).
Задача 3. Определить факторы эквивалентности и молярные массы эквивалентов оксидов CrО, Cr2О3 и CrО3 в кислотно-основных реакциях.
CrО3 – кислотный оксид. Он взаимодействует со щёлочью:
Молярные массы эквивалентов рассматриваемых оксидов равны:
Мэкв(CrО) = 68(1/2) = 34 г/моль,
Задача 4. Определить объём 1 моль-экв О2, NH3 и H2S при н.у. в реакциях:
Vэкв(NH3) = 22,4× 1/3 = 7,47 л – в первой реакции.
Vэкв(NH3) = 22,4× 1/5 = 4,48 л – во второй реакции.
В третьей реакции для сероводорода Vэкв(H2S)=22,4 1/6 = 3,73 л.
Задача 5. 0,45 г металла вытесняют из кислоты 0,56 л (н.у.) водорода. Определить молярную массу эквивалента металла, его оксида, гидроксида и сульфата.
Задача 6. Рассчитать массу перманганата калия, необходимую для окисления 7,9 г сульфита калия в кислой и нейтральной средах.
fэкв(K2SО3) = 1/2 (в кислой и нейтральной среде).
В кислой среде Мэкв(KMnO4) = 158·1/5 = 31,6 г/моль, m(KMnO4) = 0,1·31,6 = 3,16 г.
В нейтральной среде Мэкв (KMnO4) = 158·1/3 = 52,7 г/моль, m(KMnO4) = 0,1·52,7 =5,27 г.
Задача 7. Рассчитать молярную массу эквивалента металла, если оксид этого металла содержит 47 мас.% кислорода.
Выбираем для расчётов образец оксида металла массой 100 г. Тогда масса кислорода в оксиде составляет 47 г, а масса металла – 53 г.
В оксиде: nэкв (металла) = nэкв(кислорода). Следовательно:
53:Мэкв(Ме) = 47:(32·1/4). В результате получаем Мэкв(Ме) = 9 г/моль.
Задачи для самостоятельного решения
2.1. Молярная масса эквивалента металла равна 9 г/моль. Рассчитать молярную массу эквивалента его нитрата и сульфата.
Ответ: 71 г/моль; 57 г/моль.
2.2. Молярная масса эквивалента карбоната некоторого металла составляет 74 г/моль. Определить молярные массы эквивалентов этого металла и его оксида.
Ответ: 44 г/моль; 52 г/моль.
2.3. Рассчитать объём 1 моля эквивалента сероводорода (н.у.), который окисляется до оксида серы (IV).
Ответ: 3,73 л.
2.4. Определить молярную массу эквивалента Ni(OH)Cl в реакциях:
Ni(OH)Cl + NaOH = Ni(OH)2 + NaCl.
Ответ: 55,6 г/моль; 111,2 г/моль.
2.5. При взаимодействии 4,8 г неизвестного металла и 13 г цинка с соляной кислотой выделяется одинаковый объём водорода. Вычислить молярные массы эквивалентов металла, его оксида и его хлорида.
Ответ: МЭ(металла)=12 г/моль; МЭ(оксида)=20 г/моль, МЭ(хлорида)=47,5 г/моль.
2.6. Рассчитать молярные массы эквивалентов металла и его гидроксида, если хлорид этого металла содержит 79,7 мас.% хлора, а молярная масса эквивалента хлора равна 35,5 г/моль.
Ответ: МЭ(металла)=9 г/моль; МЭ(оксида)=26 г/моль.
2.7. Какой объём 0,6 М раствора H2O2 пойдёт на окисление 150 мл 2н. раствора FeSO4 в реакции:
Ответ: 250 мл.
2.8. Определить объём хлора (н.у), необходимый для окисления 100 мл 0,5н раствора K2MnO4.
Ответ: 0,56 л.
2.9. 0,66 г кислоты требуются для нейтрализации 10 мл 1М раствора КОН. Найти молярные массы эквивалентов кислоты и ее кальциевой соли в обменной реакции.
Ответ: МЭ(кислоты)=66 г/моль; МЭ(соли)=85 г/моль.
2.10. Бромид металла в результате обменной реакции полностью переведен в сульфат, при этом масса уменьшилась в 1,47 раз. Найти молярную массу эквивалента металла. Определить какой это металл.
Ответ: МЭ(металла)=20 г/моль; Са.
Видео:Определение реакций опор простой рамыСкачать

Аналитическая химия (стр. 5 )
 | Из за большого объема этот материал размещен на нескольких страницах: 1 2 3 4 5 6 7 8 |
Тема 3. Кислотно-основное титрование. Определение точки эквивалентности. Расчет кривых титрования сильных и слабых кислот и оснований. Титрование солей. Индикаторы, применяемые в методе кислотно-основного титрования, их выбор. Количественные расчеты
В основе кислотно-основного титрования лежит реакция нейтрализации и в процессе титрования изменяется рН раствора. Поэтому при изучении данной темы необходимо уметь правильно определять состав раствора и рассчитывать рН в ходе титрования. Для правильного выбора индикатора важно знать, что такое точка эквивалентности, скачок рН, точка начала скачка и конца, чем определяется величина скачка рН, и, что такое интервал перехода окраски индикатора и его показатель титрования — рТ.
Рассчитать рН в точке эквивалентности при титровании 20 мл 0,1 М раствора муравьиной кислоты (КHCOOH = 1,8∙10-4) 0,2 М раствором KOH. Подобрать индикатор.
Напишем уравнение реакции:
HCOOH + KOH — HCOOK + H2O
рН в точке эквивалентности определяется гидролизом соли.
HCOO — + H2O — HCOOH + OH — , рН > 7.
В точке эквивалентности объем титранта (КОН) равен
Таким образом, при титровании муравьиной кислоты раствором гидроксида калия рН в точке эквивалентности равен 8,29. Индикатор — фенолфталеин (рТинд. = 9).
При проведении количественных расчетов в методе кислотно-основного титрования используется закон эквивалентов. Особое внимание следует обратить на используемые индикаторы, с тем, чтобы правильно определить фактор эквивалентности реагирующих веществ.
Тема 4 Окислительно-восстановительное титрование. Классификация методов по титранту. Кривые окислительно-восстановительного титрования. Основные индикаторы. Количественные расчеты
Для усвоения данной темы нужно вспомнить теорию окисления-восстановления, написание окислительно-восстановительных реакций, электронно-ионных полуреакций, уметь рассчитывать эквивалентные массы веществ, участвующих в окислении-восстановлении, определять направление реакций, делать расчеты по уравнению Нернста, понимать влияние концентрации и рН среды на направление реакций, знать факторы, влияющие на скорость окислительно-восстановительного титрования.
При построении кривой титрования в данном методе рассчитывают равновесный окислительно-восстановительный потенциал по уравнению Нернста в каждой точке кривой. При этом до точки эквивалентности расчет удобнее проводить по системе определяемого вещества, а после точки эквивалентности по системе титранта. Методы окисления-восстановления классифицируют по используемому титранту. Следует знать важнейшие из них такие как: перманганатометрия, иодометрия, броматометрия, хроматометрия. Особое внимание надо обратить на приготовление рабочих растворов, их стандартизацию, используемые в каждом методе индикаторы.
Пример 1. Вычислить значение окислительно-восстановительного потенциала (по отношению к водородному электроду) в растворе, полученном при приливании к 50 мл 0,2 н. раствора Na2S2O3 20 мл 0,2 н. раствора I2:
Решение. Пишем уравнение реакции:
2S2O32- + I2 = S4O62- + 2I-
2S2O32- — 2е = S4O62- + 2I-
f(S2O32-) = 1, f(I2) = 1/2, f(S4O62-) = 1/2.
В данной точке значение потенциала рассчитывают по системе S4O62-/2S2O32-, так как она лежит до точки эквивалентности.
Согласно уравнению Нернста:
рассчитываем [S4O62-] и [S2O32-]:
было S2O32- 0,1∙50 = 5 ммоль-экв
добавлено I2 0,2∙20 = 4 ммоль-экв
осталось S2O32- 5 — 4 = 1 ммоль-экв
образовалось S4O62- 4 ммоль-экв
Так как в уравнении Нернста входят молярные концентрации ионов, число ммоль S S4O62- = 1/2∙4 = 2 ммоль.
При проведении количественных расчетов следует особое внимание обратить на окислительно-восстановительную реакцию, протекающую в процессе титрования. Решая конкретную задачу, обязательно пишут уравнение реакции, и по ней определяют фактор эквивалентности. В данном методе помимо методов прямого и обратного титрования часто используют метод косвенного титрования (метод замещения).
Пример 1. Вычислить значение окислительно-восстановительного потенциала (по отношению к водородному электроду) в растворе, полученном при приливании к 50 мл 0,2 н. раствора Na2S2O3 20 мл 0,2 н. раствора I2:
Решение. Пишем уравнение реакции:
2S2O32- + I2 = S4O62- + 2I-
2S2O32- — 2е = S4O62- + 2I-
f(S2O32-) = 1, f(I2) = 1/2, f(S4O62-) = 1/2.
В данной точке значение потенциала рассчитывают по системе S4O62-/2S2O32-, так как она лежит до точки эквивалентности.
Согласно уравнению Нернста:
рассчитываем [S4O62-] и [S2O32-]:
было S2O32- 0,1∙50 = 5 ммоль-экв
добавлено I2 0,2∙20 = 4 ммоль-экв
осталось S2O32- 5 — 4 = 1 ммоль-экв
образовалось S4O62- 4 ммоль-экв
Так как в уравнении Нернста входят молярные концентрации ионов, число ммоль S S4O62- = 1/2∙4 = 2 ммоль.
При проведении количественных расчетов следует особое внимание обратить на окислительно-восстановительную реакцию, протекающую в процессе титрования. Решая конкретную задачу, обязательно пишут уравнение реакции, и по ней определяют фактор эквивалентности. В данном методе помимо методов прямого и обратного титрования часто используют метод косвенного титрования (метод замещения).
Тема 5 Методы комплексообразования в титриметрическом анализе. Комплексонометрическое титрование. Индикаторы, механизм их действия. Условия титрования. Количественные расчеты
Методы комплексообразования используют прежде всего для определения ионов металлов-комплексообразователей. Необходимо знать важнейшие комплексоны, правильно писать их формулы, уравнения реакций с ионами металлов различной степени окисления. Одним из методов, основанных на реакции комплексообразования, является метод меркуриметрического титрования. Необходимо знать как готовят рабочий раствор, его стандартизацию, индикаторы, примеры определения ионов.
Важнейшим методом определения содержания ионов металлов является метод комплексонометрии. Наиболее часто используется комплексон III — трилон Б. Следует знать его структурную формулу, уметь писать реакции комплексообразования с трилоном Б и структуру его комплексов с различными ионами.
С различной прочностью комплексов связаны условия титрования. Поэтому важно обратить внимание на роль кислотности среды при образовании комплексов и, следовательно, на роль буферных растворов при проведении титрования.
Необходимо помнить важнейшие индикаторы, используемые в методе комплексонометрии, понимать механизм действия металл-индикаторов.
Для количественных определений в данном методе используются как обычные методы — прямого титрования и по остатку, так и особый метод — заместительное титрование с применением комплексоната магния.
Следует знать примеры определения ряда ионов: кальция, магния, алюминия, кобальта, меди, кальция и магния при совместном присутствии. Так как при комплексообразовании выделяется два иона Н+, фактор эквивалентности трилона Б принимают равным 1/2. Поэтому и любой ион металла, определяемый комплексонометрически, имеет фактор эквивалентности равный 1/2. При решении задач в методе комплексонометрического титрования иногда целесообразнее расчет вести через моли, помня, что всегда 1 молекула трилона Б реагирует с одним ионом металла, независимо от его степени окисления.
Определить содержание Na2SO4∙10H2O в граммах на литр, если к 10,00 мл этого раствора добавлено 50,00 мл 0,1000 М раствора Pb(NO3)2, избыток Pb(NO3)2 оттитрован 10,00 мл 0,09000 М раствора Комплексона III.
Задача на титрование по остатку.
Закон эквивалентов в этом случае можно записать с использованием молярной концентрации трилона Б, и учесть, что это косвенный метод и сульфат натрия определяется по осадку PbSO4. Тогда:
n(Pb(NO3)2) = n(Na2SO4 • 10H2O) + n(Тр. Б) Учитывая аликвоту равную 1000/10. получаем:

Тема 6. Осадительное титрование. Требования к реакциям. Индикаторы. Кривые титрования. Аргентометрия. Характеристика методов
При изучении данной темы следует обратить внимание на требования, предъявляемые к реакциям осаждения, используемым в объемном анализе, на причины сравнительно ограниченного числа ионов, определяемых данным методом. Следует различать, что в зависимости от иона-осадителя методы осаждения подразделяют на аргентометрию, роданометрию, меркурометрию. Особо важным является вопрос о способах фиксирования конца титрования. В осадительном титровании используют индикаторы, действующие по разному принципу:
а) образующие с титрантом цветной комплекс (метод Фольгарда);
б) образующие с титрантом цветной осадок (метод Мора);
в) адсорбционные индикаторы (метод Фаянса) и т. д.
При рассмотрении отдельных методов осадительного титрования рекомендуется отметить достоинства и недостатки каждого из них. Следует знать важнейшие титранты осадительного титрования (AgNO3, Hg2(NO3)2), знать, как готовят их растворы, определяют точную концентрацию, какие ионы можно определить с каждым из них. Знать индикаторы и уметь объяснить принцип их действия в различных случаях титрования. Уметь писать уравнения реакций, знать условия их выполнения.
Расчет кривых титрования в методах осаждения проводится, исходя из константы соответствующего гетерогенного равновесия Кs (ПР).
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Кислотно-основное титрование. Индикаторы, техника титрования
» data-shape=»round» data-use-links data-color-scheme=»normal» data-direction=»horizontal» data-services=»messenger,vkontakte,facebook,odnoklassniki,telegram,twitter,viber,whatsapp,moimir,lj,blogger»>
Кислотно-основное титрование
Основные понятия кислотно-основного титрования
Индикаторы метода кислотно-основного титрования. Теории индикаторов
Техника титрования
Основные понятия кислотно-основного титрования
Метод кислотно-основное титрование базируется на реакциях взаимодействия между кислотами и основаниями, т. е. на реакции нейтрализации:
Рабочими растворами метода являются растворы сильных кислот (HCl, H2S, НNО3 и др.) или сильных оснований (NaOH, КОН, Ва(ОН)2 и др.). В зависимости от титрованного раствора (титранта) кислотно-основное титрование подразделяют на ацидиметрию, если титрантом является раствор кислоты, и алкалиметрию, если используют в качестве титранта раствор основания.
Согласно правилу эквивалентности титрование необходимо продолжать до тех пор, пока количество прибавленного реагента не станет эквивалентным содержанию определяемого вещества. Наступающий в процессе титрования момент, когда количecтвo вещества в растворе титранта становится строго эквивалентным количеству определяемого вещества согласно уравнению химической реакции, называют точкой эквивалентности.
Точку эквивалентности устанавливают различными способами. В методах ручного анализа преимущественно используют изменение окраски индикатора, добавляемого в титруемый раствор. Момент, при котором происходит наблюдаемое изменение цвета индикатора, называют конечной точкой титрования. Очень часто конечная точка титрования не совсем совпадает с точкой эквивалентности. Как правило, они отличаются друг от друга не более чем на 0,04 мл (2 капли) титранта. Это то количество вещества в растворе титранта, которое необходимо для взаимодейcтвия его с индикатором.
Если для приготовления растворов используют вещества, которые не являются стандартными, то проводят их стандартизацию. Например растворы кислот можно стандартизовать по стандартным веществам — натрия тетраборат Na2B4О7 ∙10Н2О, натрия карбонат Nа2СО3 ·10Н2О или по стандартным растворам NaOH, КОН; а растворы оснований — по щавелевой кислоте Н2С2О4 ∙2Н2О, янтарной кислоте Н2С4Н4О4 или по стандартным растворам HCl, H2SO4 , НNО3 .
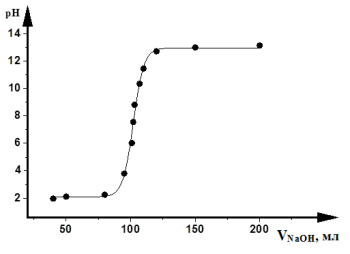
Кривые кислотно-основного титрования выражают зависимость изменения рН раствора от объема добавленного титранта (рис. 3.4).
Рис. 3.4. Кривая кислотно-щелочного титрования
При расчете рН необходимо знать состав титриметрической смеси. Для упрощения вычислений (что не приводит к заметным ошибкам) не учитывают разбавление раствора в процессе титрования и используют понятие «концентрация», а не «активность». Кривые титрования представляют в виде графика зависимости рН от объема добавленного титранта или объема избытка определяемого вещества и избытка титранта.
В начале титрования рН изменяется очень медленно. Кривая (см. рис. 3.4) показывает, в частности, что если оттитровать половину имеющегося количества кислоты (50 мл), рН раствора изменится незначительно по сравнению с исходным, если оттитровать 90 % (90 мл), то и тогда уменьшение рН составит лишь одну единицу. С уменьшением концентрации оставшейся кислоты изменение рН при титровании становится более резким. Оттитровывание кислоты от 90 до 99 % вызывает изменение рН на три единицы. Также на единицу возрастает рН при оттитровывании от 99 до 99,9 %, т. е. на 0,9 %. Титрование остатка кислоты (0,1%) приводит к изменению рН на целых 3 единицы. Введение избытка в 0,1 % NaOH по сравнению с эквивалентным количеством вызывает изменение рН также на 3 единицы, и рН раствора становится равным 13,0.
Кривая титрования сильного основания сильной кислотой представляет собой зеркальное отображение кривой титрования сильной кислоты сильным основанием. При титровании сильной кислотой сильного основания и наоборот до точки эквивалентности рН раствора определяется концентрацией неоттитрованной щелочи или кислоты, а после точки эквивалентности — концентрацией добавленной кислоты или щелочи. В точке эквивалентности раствор нейтрален.
Скачок титрования — это резкое изменение рН в области точки эквивалентности. Факторы, влияющие на величину и положение скачка титрования (на величину скачка титрования влияют все факторы, от которых зависят значения рН):
- ● константа диссоциации титруемого вещества;
- ● концентрация титруемого вещества;
- ● концентрация титранта;
- ● температура;
- ● ионная сила.
Чем меньше концентрация титруемого вещества и титранта, тем меньше скачок. Практически невозможно оттитровать сильные протолиты концентрацией 10 –4 М, а слабые — концентрацией 10 –2 М. При изменении температуры сильно изменяется константа автопротолиза воды, входящая во многие формулы расчета рН. В результате при увеличении температуры скачок уменьшается и смещается в более кислую область. Ионная сила влияет незначительно.
В рассматриваемом случае расчет рН проводят по следующим формулам:
● Для сильной кислоты, например HCl, рН определяется концентрацией ионов водорода: [H+] = M кислоты.
● Для сильного основания, например КОН [H+] = 10 –14 / Mщелочи. Часто проводят титрование с использованием слабых электролитов.
При титровании слабой кислоты сильным основанием чем слабее кислота, тем больше значение рН в начале титрования. Следовательно, ветвь кривой титрования (рис. 3.5) до точки эквивалентности смещается в щелочную область. После достижения точки эквивалентности образуется сильное основание, следовательно, значение рН резко смещается в щелочную область. При дальнейшем титровании кривая изменяется незначительно.
В ходе титрования раствора уксусной кислоты сильным основанием значение pH все время остается выше, чем при тех же концентрациях соляной кислоты. В результате этого скачок на кривой начинается с более высокого значения рН. Заканчивается он, как и в первом случае, при рН = 10, так как титрование производят тем же раствором 0,1 моль/л NaOH.
Рис. 3.5. Ход титрования слабой кислоты сильным основанием
При титровании слабой кислоты сильным основанием pH раствора кислоты вычисляют с учетом ее константы диссоциации:
Интервал скачка рН на кривой титрования 0,1 мольл уксусной кислоты раствором 0,1 мольл NaOH значительно уже предыдущего случая. Он простирается от рН = 7,8 до рН = 10.
При титровании слабого основания сильной кислотой интервал скачка уменьшается в щелочной области рН. Рассчитывается рН в этом случае следующим образом:
При титрование слабой кислоты слабым основанием (или наоборот) сужение интервала скачка рН происходит и в кислотной, и в щелочной областях рН. Вследствие этого интервал скачка рН на кривой вовсе исчезает. Пример — нейтрализация раствора 0,1 моль/л СН3СООН раствором 0,1 моль/л NН4ОН. Кривая титрования не имеет скачка рН. Поэтому нельзя ожидать и резкого изменения окраски индикаторов. Титрование слабой кислоты слабым основанием вообще невозможно.
Индикаторы метода кислотно-основного титрования. Теории индикаторов
Индикаторы — вещества, которые резко реагируют на изменение концентрации определяемого компонента или титранта вблизи точки эквивалентности. В методах кислотно-основного титрования для определения конечной точки титрования используют кислотноосновные индикаторы (табл. 3.1). Это органические вещества, способные видимо и обратимо изменять свою окраску в растворе при изменении рН среды.
Кислотно-основные индикаторы изменяют свою окраску в области интервала перехода независимо от того, достигнута ли точка эквивалентности. Правильно выбранный индикатор изменяет окраску в области скачка титрования. У неправильно выбранного индикатора изменение окраски может происходить задолго до наступления точки эквивалентности или после нее.
Таблица 3.1 Характеристики кислотно-основных индикаторов
Выбирают индикатор с помощью кривой титрования. Для этого на график наносят интервал перехода индикатора. У правильно выбранного индикатора интервал перехода полностью или частично перекрывается скачком титрования. Если такого перекрывания нет, то индикатор для данного титрования не подходит. Значение рН, при котором заканчивается титрование с данным индикатором, называют показателем титрования и обозначают рТ. Показатель титрования находится обычно в середине интервала перехода индикатора. Существуют различные теории индикаторов, каждая из которых по-своему объясняет поведение кислотно-основных индикаторов в кислых и щелочных средах.
Ионная теория индикаторов. В связи с тем, что кислотно-основные индикаторы представляют собой слабые кислоты или слабые основания, любой индикатор диссоциирует в растворе согласно уравнению:
HInd = Н+ + Ind — (бесцветный — малиновый).
Окраска раствора, в котором индикатор находится в молекулярной форме (HInd), отличается от окраски раствора, в котором индикатор находится в ионной форме (Ind − ). Молекулы фенолфталеина HInd бесцветны, а его анионы Ind − окрашены в малиновый цвет. Достаточно к раствору, содержащему фенолфталеин, прибавить 1−2 капли щелочи, как введенные ОН – ионы станут связывать катионы Н+ с образованием слабого электролита — молекул воды. При этом равновесие диссоциации индикатора сместится вправо, и накопление анионов Ind − вызовет окрашивание раствора в малиновый цвет. То есть переход одной окраски, присущей молекулярной форме кислотно-основного индикатора, в другую, свойственную его ионной форме, происходит под влиянием Н+ или ОН − -ионов, т. е. зависит от рН раствора.
Хромофорная теория индикаторов. Поведение индикаторов, объясняемое ионной теорией индикаторов, дополняется хромофорной теорией, согласно которой изменение окраски индикаторов связано с изменением структуры их молекул, внутримолекулярной перегруппировкой, вызываемой действием Н+ или ОН − -ионов. По хромофорной теории в процессе изменения рН раствора меняется строение молекул кислотно-основных индикаторов. Это явление обусловливается бензоидно-хиноидной таутомерией. При изменении рН среды раствора или при диссоциации хромофоры могут перегруппировываться. Перемена окраски у индикаторов является результатом изменений в их внутреннем строении. У одноцветных индикаторов окраска изменяется в связи с появлением или исчезновением хромофоров. У двухцветных индикаторов эти изменения обусловлены превращением одних хромофоров в другие. Типичным одноцветным индикатором является фенолфталеин. При рН –4 , у лакмуса Кд = 10 –8 , а у фенолфталеина Кд = 10 –9 . Следовательно, фенолфталеин является наиболее слабой органической кислотой из этих индикаторов.
Изменение окраски индикаторов происходит при прибавлении к любому раствору любой кислоты или щелочи влечет за собой изменение концентрации ионов Н+ в нем, а следовательно, и величины рН. Перемена окраски у индикаторов также связана с изменением рН раствора. Однако каждый индикатор изменяет окраску только в определенном, характерном для него интервале значений рН. Объясняется это тем, что окраска индикатора зависит от соотношения концентраций его диссоциированной и недиссоциированной форм, т. е.
При рН = 7, [Н+] = 1 –7 , а [HInd] / [Ind−] = 10 –7 / 10 –9 , т. е. при рН = 7 на каждые 100 бесцветных молекул фенолфталеина приходится лишь один окрашенный ион, следовательно, раствор бесцветный.
Если к раствору фенолфталеина прибавить щелочь и довести рН раствора до 8, то соотношение [HInd] / [Ind−] = 10 –8 /10 –9 уменьшится в 10 раз и раствор станет бледно-розовым. При рН = 9 соотношение [HInd] / [Ind−] = 10 –9 /10 –9 = 1,0, т. е. в растворе присутствуют равные количества бесцветных молекул индикатора и окрашенных в красный цвет ионов, при этом раствор приобретает розовую окраску. Следовательно, цвет водного раствора индикатора определяется соотношением концентрации его молекулярной и ионной форм, отличающихся различной окраской, и зависит от [Н+].
Техника титрования
Правильное определение точки эквивалентности при титровании зависит не только от выбора индикатора, но и от порядка титрования. По методу нейтрализации титруют растворы кислот растворами оснований или наоборот. Этот порядок следует учитывать при выборе индикатора. Например, если титруют кислоту основанием и в качестве индикатора используют метиловый оранжевый (или метиловый красный), то розовая окраска индикатора от избыточной капли щелочи должна перейти в желтую.
Такое изменение окраски гораздо хуже улавливается глазом, чем переход ее из желтой в розовую. Поэтому с метиловым оранжевым (или метиловым красным) рекомендуют титровать растворы оснований растворами кислот. С фенолфталeином удобнее титровать растворы кислот растворами оснований, так как при этом бесцветный раствор становится малиновым.
Следует заметить, что при использовании индикаторов для фиксирования конечной точки титрования возможно появление индикаторной ошибки. Она образуется в случае несовпадения рН раствора в точке эквивалентности и рТ индикатора. Если такое несовпадение имеет место, то раствор обычно либо несколько перетитровывают, либо, наоборот, недотитровывают. Для уменьшения индикаторной ошибки титрование проводят с так называемым свидетелем. В запасную коническую колбу (или стакан) наливают дистиллированную воду в количестве, приблизительно равном объему жидкости, получающейся в конце титрования. Прибавляют к воде столько же капель индикатора, например метилового оранжевого, сколько и к титруемому раствору, и приливают из бюретки 1−2 капли кислоты, вызывающей слабое порозовение раствора. Приготовленный таким образом свидетель используют в качестве образца при титровании, добиваясь, чтобы окраска анализируемого раствора и свидетель была одинакова. С помощью свидетель вводят также поправку в результаты титрования на прибавленный избыток кислоты, т. е. из затраченного ее объема вычитают объем двух капель (0,04 мл), использованных на окрашивание индикатора в свидетель.
Правильное определение точки эквивалентности зависит от количества прибавленного индикатора. Иногда стараются прилить побольше индикатора, полагая, что большая интенсивность окраски раствора облегчит определение точки эквивалентности. Но чем больше прибавлено индикатора, тем труднее заметить изменение окраски, так как оно будет происходить медленнее. Для установления конечной точки титрования имеет значение не столько яркость окраски раствора, сколько четкость ее изменения. Опытным путем найдено, что на 10–15 мл анализируемого раствора следует брать одну каплю раствора индикатора, а на 25 мл — не более двух капель.
Таким образом, результат объемного определения зависит не только от выбора индикатора, но также от его взятого количества и от принятого порядка титрования.
💥 Видео
Что такое эквивалент?Скачать
ОВР и Метод Электронного Баланса — Быстрая Подготовка к ЕГЭ по ХимииСкачать

ВАЛЕНТНОСТЬ 8 КЛАСС ХИМИЯ // Урок Химии 8 класс: Валентность Химических ЭлементовСкачать

Задача на кислотно-основное титрование (видео 16) | Титриметрический анализ | ХимияСкачать

Введение в титрование (видео 1)| Титриметрический анализ | ХимияСкачать

Определение опорных реакций балки. Сопромат для чайников ;)Скачать

Расстановка Коэффициентов в Химических Реакциях // Подготовка к ЕГЭ по ХимииСкачать

Шеховцова Т.Н. - Аналитическая химия - Кислотно-основное титрованиеСкачать

Объемные отношения газов при химических реакциях. 8 класс.Скачать

Определение реакций опор простой рамыСкачать

Задача о составной конструкцииСкачать

Закон Авогадро. Молярный объем. 8 класс.Скачать

Комплексиметрия: комплексонометрия, меркуриметрия.Скачать

Математика это не ИсламСкачать