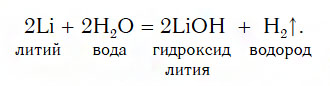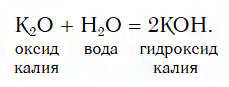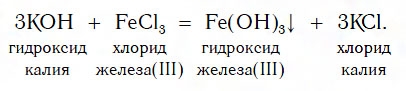В уроке 38 «Получение и применение оснований» из курса «Химия для чайников» рассмотрим способы получения щелочей и нерастворимых оснований, а ещё узнаем где в каких отраслях они применяются.
Поскольку растворимые и нерастворимые основания отличаются по свойствам, эти вещества получают разными способами.
- Получение щелочей
- Взаимодействие активных металлов (Li, Na, К, Ca, Ba) с водой
- Взаимодействие оксидов активных металлов с водой
- Получение нерастворимых оснований
- Применение оснований
- Основания. Химические свойства и способы получения
- Получение оснований
- Химические свойства нерастворимых оснований
- Химические свойства щелочей
- Описать способы получения оснований привести примеры написать уравнения реакций
- 📸 Видео
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Получение щелочей
Для получения щелочей можно использовать следующие реакции.
Взаимодействие активных металлов (Li, Na, К, Ca, Ba) с водой
Поскольку эти реакции протекают очень бурно (рис. 121), на практике их используют редко.
Взаимодействие оксидов активных металлов с водой
Некоторые щелочи (NaOH, KOH) получают, пропуская электрический ток через водные растворы солей NaCl или KCl. При этом наряду со щелочами образуются и другие ценные вещества — водород H2 и хлор Сl2.
Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Получение нерастворимых оснований
Нерастворимые основания получают взаимодействием растворимых оснований (щелочей) с солями. Образующиеся нерастворимые основания выделяются из растворов в виде осадков.
Видео:ОСНОВАНИЯ В ХИМИИ — Химические свойства оснований. Реакции оснований с кислотами и солямиСкачать

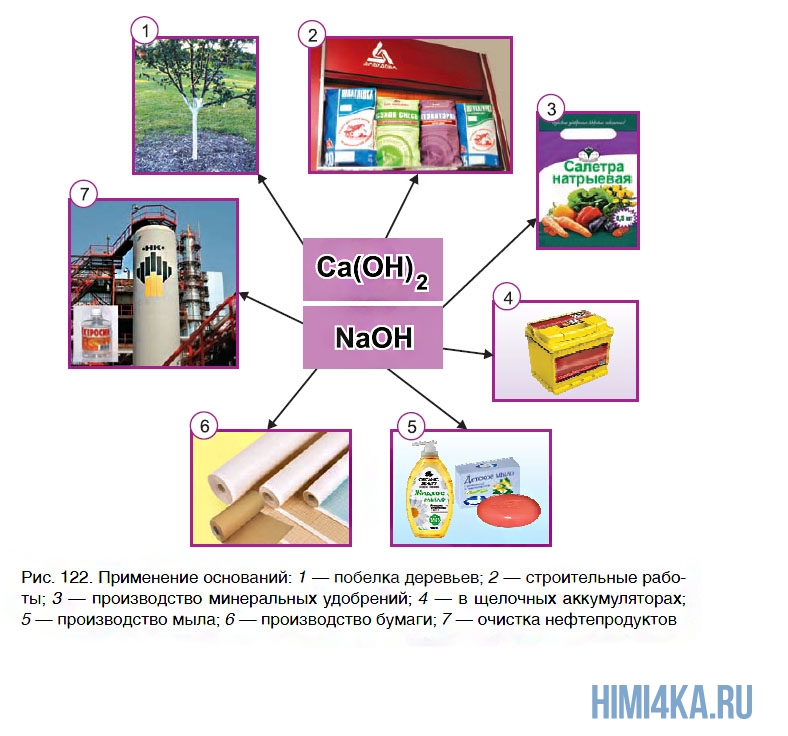
Применение оснований
Из всех оснований наиболее широкое применение находят щелочи. Раствор одной из них вы наверняка сможете найти дома. Эту жидкость под названием «Крот» используют в быту для промывания труб, идущих от кухонных раковин. Дело в том, что эти трубы постепенно засоряются остатками жира, которые мешают стоку воды. А щелочи обладают способностью растворять жиры. Поэтому достаточно в засоренную трубу влить небольшое количество «Крота», и через некоторое время проблема будет решена.
В последнее время в быту получили широкое распространение щелочные гели — густые жидкости, содержащие гидроксид натрия. Они предназначены для быстрого удаления остатков пригоревшего жира с поверхности кухонных плит и СВЧ- печей.
Большое количество гидроксида кальция используется в производстве сахара из сахарной свеклы. Некоторые области применения оснований показаны на рисунке 122.
Из нерастворимых оснований применение находят гидроксиды алюминия Al(OH)3 и магния Mg(OH)2. Они входят в состав медицинского препарата «Алмагель», который используют при заболеваниях пищеварительной системы.
Поскольку щелочи оказывают разрушающее действие на кожу, при их практическом использовании следует соблюдать правила безопасности.
Краткие выводы урока:
- Щелочи образуются при взаимодействии некоторых металлов и их оксидов с водой.
- Нерастворимые основания получаются в результате взаимодействия щелочей с солями.
Надеюсь урок 38 «Получение и применение оснований» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Видео:СОЛИ ХИМИЯ 8 КЛАСС: Химические Свойства Солей и Получение // Реакция Солей с Кислотами и МеталламиСкачать

Основания. Химические свойства и способы получения
Перед изучением этого раздела рекомендую прочитать следующую статью:
Основания – сложные вещества, которые состоят из катиона металла Ме + (или металлоподобного катиона, например, иона аммония NH4 + ) и гидроксид-аниона ОН — .
По растворимости в воде основания делят на растворимые (щелочи) и нерастворимые основания . Также есть неустойчивые основания, которые самопроизвольно разлагаются.
Видео:Как решать ОРГАНИЧЕСКИЕ ЦЕПОЧКИ? Основные типы химических реакцийСкачать

Получение оснований
1. Взаимодействие основных оксидов с водой. При этом с водой реагируют в обычных условиях только те оксиды, которым соответствует растворимое основание (щелочь). Т.е. таким способом можно получить только щёлочи:
основный оксид + вода = основание
Например , оксид натрия в воде образует гидроксид натрия (едкий натр):
Na2O + H2O → 2NaOH
При этом оксид меди (II) с водой не реагирует:
CuO + H2O ≠
2. Взаимодействие металлов с водой. При этом с водой реагируют в обычных условиях только щелочные металлы (литий, натрий, калий. рубидий, цезий) , кальций, стронций и барий. При этом протекает окислительно-восстановительная реакция, окислителем выступает водород, восстановителем является металл.
металл + вода = щёлочь + водород
Например , калий реагирует с водой очень бурно:
2K 0 + 2 H2 + O → 2 K + OH + H2 0
3. Электролиз растворов некоторых солей щелочных металлов . Как правило, для получения щелочей электролизу подвергают растворы солей, образованных щелочными или щелочноземельными металлами и бескилородными кислотами (кроме плавиковой) – хлоридами, бромидами, сульфидами и др. Более подробно этот вопрос рассмотрен в статье Электролиз.
Например , электролиз хлорида натрия:
2NaCl + 2H2O → 2NaOH + H2↑ + Cl2↑
4. Основания образуются при взаимодействии других щелочей с солями. При этом взаимодействуют только растворимые вещества, а в продуктах должна образоваться нерастворимая соль, либо нерастворимое основание:
щелочь + соль1 = соль2↓ + щелочь
щелочь + соль1 = соль2↓ + щелочь
Например: карбонат калия реагирует в растворе с гидроксидом кальция:
Например: хлорид меди (II) взаимодействет в растворе с гидроксидом натрия. При этом выпадает голубой осадок гидроксида меди (II):
CuCl2 + 2NaOH → Cu(OH)2↓ + 2NaCl
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Химические свойства нерастворимых оснований
1. Нерастворимые основания взаимодействуют с сильными кислотами и их оксидами (и некоторыми средними кислотами). При этом образуются соль и вода.
нерастворимое основание + кислота = соль + вода
нерастворимое основание + кислотный оксид = соль + вода
Например , гидроксид меди (II) взаимодействует с сильной соляной кислотой:
При этом гидроксид меди (II) не взаимодействует с кислотным оксидом слабой угольной кислоты – углекислым газом:
2. Нерастворимые основания разлагаются при нагревании на оксид и воду.
Например , гидроксид железа (III) разлагается на оксид железа (III) и воду при прокаливании:
3. Нерастворимые основания не взаимодействуют с амфотерными оксидами и гидроксидами.
нерастворимое оснвоание + амфотерный оксид ≠
нерастворимое основание + амфотерный гидроксид ≠
4. Некоторые нерастворимые основания могут выступать в качестве восстановителей. Восстановителями являются основания, образованные металлами с минимальной или промежуточной степенью окисления, которые могут повысить свою степень окисления (гидроксид железа (II), гидроксид хрома (II) и др.).
Например , гидроксид железа (II) можно окислить кислородом воздуха в присутствии воды до гидроксида железа (III):
4 Fe +2 (OH)2 + O2 0 + 2H2O → 4 Fe +3 ( O -2 H)3
Видео:Химические уравнения. СЕКРЕТНЫЙ СПОСОБ: Как составлять химические уравнения? Химия 8 классСкачать

Химические свойства щелочей
1. Щёлочи взаимодействуют с любыми кислотами – и сильными, и слабыми . При этом образуются средняя соль и вода. Эти реакции называются реакциями нейтрализации . Возможно и образование кислой соли, если кислота многоосновная, при определенном соотношении реагентов, либо в избытке кислоты. В избытке щёлочи образуется средняя соль и вода:
щёлочь(избыток)+ кислота = средняя соль + вода
щёлочь + многоосновная кислота(избыток) = кислая соль + вода
Например , гидроксид натрия при взаимодействии с трёхосновной фосфорной кислотой может образовывать 3 типа солей: дигидрофосфаты, фосфаты или гидрофосфаты.
При этом дигидрофосфаты образуются в избытке кислоты, либо при мольном соотношении (соотношении количеств веществ) реагентов 1:1.
При мольном соотношении количества щелочи и кислоты 2:1 образуются гидрофосфаты:
В избытке щелочи, либо при мольном соотношении количества щелочи и кислоты 3:1 образуется фосфат щелочного металла.
2. Щёлочи взаимодействуют с амфотерными оксидами и гидроксидами. При этом в расплаве образуются обычные соли , а в растворе – комплексные соли .
щёлочь (расплав) + амфотерный оксид = средняя соль + вода
щёлочь (расплав) + амфотерный гидроксид = средняя соль + вода
щёлочь (раствор) + амфотерный оксид = комплексная соль
щёлочь (раствор) + амфотерный гидроксид = комплексная соль
Например , при взаимодействии гидроксида алюминия с гидроксидом натрия в расплаве образуется алюминат натрия. Более кислотный гидроксид образует кислотный остаток:
А в растворе образуется комплексная соль:
Обратите внимание, как составляется формула комплексной соли: сначала мы выбираем центральный атом (к ак правило, это металл из амфотерного гидроксида). Затем дописываем к нему лиганды — в нашем случае это гидроксид-ионы. Число лигандов, как правило, в 2 раза больше, чем степень окисления центрального атома. Но комплекс алюминия — исключение, у него число лигандов чаще всего равно 4. Заключаем полученный фрагмент в квадртаные скобки — это комплексный ион. Определяем его заряд и снаружи дописываем нужное количество катионов или анионов.
3. Щёлочи взаимодействуют с кислотными оксидами. При этом возможно образование кислой или средней соли, в зависимости от мольного соотношения щёлочи и кислотного оксида. В избытке щёлочи образуется средняя соль, а в избытке кислотного оксида образуется кислая соль:
щёлочь(избыток) + кислотный оксид = средняя соль + вода
щёлочь + кислотный оксид(избыток) = кислая соль
Например , при взаимодействии избытка гидроксида натрия с углекислым газом образуется карбонат натрия и вода:
А при взаимодействии избытка углекислого газа с гидроксидом натрия образуется только гидрокарбонат натрия:
2NaOH + CO2 = NaHCO3
4. Щёлочи взаимодействуют с солями. Щёлочи реагируют только с растворимыми солями в растворе , при условии, что в продуктах образуется газ или осадок . Такие реакции протекают по механизму ионного обмена.
щёлочь + растворимая соль = соль + соответствующий гидроксид
Щёлочи взаимодействуют с растворами солей металлов, которым соответствуют нерастворимые или неустойчивые гидроксиды.
Cu 2+ SO4 2- + 2Na + OH — = Cu 2+ (OH)2 — ↓ + Na2 + SO4 2-
Также щёлочи взаимодействуют с растворами солей аммония.
Например , гидроксид калия взаимодействует с раствором нитрата аммония:
! При взаимодействии солей амфотерных металлов с избытком щёлочи образуется комплексная соль !
Давайте рассмотрим этот вопрос подробнее. Если соль, образованная металлом, которому соответствует амфотерный гидроксид , взаимодействует с небольшим количеством щёлочи, то протекает обычная обменная реакция, и в осадок выпадает гидроксид этого металла .
Например , избыток сульфата цинка реагирует в растворе с гидроксидом калия:
Однако, в данной реакции образуется не основание, а амфотерный гидроксид. А, как мы уже указывали выше, амфотерные гидроксиды растворяются в избытке щелочей с образованием комплексных солей . Т аким образом, при взаимодействии сульфата цинка с избытком раствора щёлочи образуется комплексная соль, осадок не выпадает:
Таким образом, получаем 2 схемы взаимодействия солей металлов, которым соответствуют амфотерные гидроксиды, с щелочами:
соль амф.металла(избыток) + щёлочь = амфотерный гидроксид↓ + соль
соль амф.металла + щёлочь(избыток) = комплексная соль + соль
5. Щёлочи взаимодействуют с кислыми солями. При этом образуются средние соли, либо менее кислые соли.
кислая соль + щёлочь = средняя соль + вода
Например , гидросульфит калия реагирует с гидроксидом калия с образованием сульфита калия и воды:
Свойства кислых солей очень удобно определять, разбивая мысленно кислую соль на 2 вещества — кислоту и соль. Например, гидрокарбонта натрия NaHCO3 мы разбиваем на уольную кислоту H2CO3 и карбонат натрия Na2CO3. Свойства гидрокарбоната в значительной степени определяются свойствами угольной кислоты и свойствами карбоната натрия.
6. Щёлочи взаимодействуют с металлами в растворе и расплаве. При этом протекает окислительно-восстановительная реакция, в растворе образуется комплексная соль и водород, в расплаве — средняя соль и водород.
! Обратите внимание! С щелочами в растворе реагируют только те металлы, у которых оксид с минимальной положительной степенью окисления металла амфотерный!
Например , железо не реагирует с раствором щёлочи, оксид железа (II) — основный. А алюминий растворяется в водном растворе щелочи, оксид алюминия — амфотерный:
2Al + 2NaOH + 6 H2 + O = 2Na[ Al +3 (OH)4] + 3 H2 0
7. Щёлочи взаимодействуют с неметалами. При этом протекают окислительно-восстановительные реакции. Как правило, неметаллы диспропорционируют в щелочах. Не реагируют с щелочами кислород, водород, азот, углерод и инертные газы (гелий, неон, аргон и др.):
NaOH +О2 ≠
NaOH +N2 ≠
NaOH +C ≠
Сера, хлор, бром, йод, фосфор и другие неметаллы диспропорционируют в щелочах (т.е. самоокисляются-самовосстанавливаются).
Например , хлор при взаимодействии с холодной щелочью переходит в степени окисления -1 и +1:
2NaOH +Cl2 0 = NaCl — + NaOCl + + H2O
Хлор при взаимодействии с горячей щелочью переходит в степени окисления -1 и +5:
6NaOH +Cl2 0 = 5NaCl — + NaCl +5 O3 + 3H2O
Кремний окисляется щелочами до степени окисления +4.
Например , в растворе:
2NaOH + Si 0 + H2 + O= Na2Si +4 O3 + 2H2 0
Фтор окисляет щёлочи:
2F2 0 + 4NaO -2 H = O2 0 + 4NaF — + 2H2O
Более подробно про эти реакции можно прочитать в статье Окислительно-восстановительные реакции.
8. Щёлочи не разлагаются при нагревании.
Исключение — гидроксид лития:
2LiOH = Li2O + H2O
Видео:8 класс. Составление уравнений химических реакций.Скачать

Описать способы получения оснований привести примеры написать уравнения реакций
СПОСОБЫ ПОЛУЧЕНИЯ ОСНОВАНИЙ.
Растворимые основания (щелочи) в лаборатории получают:
1. Взаимодействием щелочных и щелочно-земельных металлов с водой.
При этом атом металла замещает в молекуле воды H—OH атом водорода и соединяется с гидроксид-ионом, а два атома водорода, соединяясь, образуют молекулу H2.
2. Взаимодействием оксидов щелочных и щелочно-земельных металлов с водой.
Нерастворимые основания получают действием раствора щелочи на соль того металла, гидроксид которого нужно получить.
ХИМИЧЕСКИЕ СВОЙСТВА ОСНОВАНИЙ.
Общие химические свойства оснований обусловлены наличием в их растворах анионов OH – , которые образуются при диссоциации оснований.
1. Водные растворы щелочей изменяют окраску индикаторов.
2. Основания (как растворимые, так и нерастворимые) взаимодействуют с кислотами.
3. Основания взаимодействуют с кислотными и амфотерными оксидами, образуя соль и воду. Это свойство наиболее характерно для растворимых оснований – щелочей.
4. Растворимые основания (щелочи) реагируют с растворами солей, если образуется нерастворимое основание или нерастворимая соль.
5. Нерастворимые в воде основания при нагревании разлагаются:
Щелочи в отличие от нерастворимых оснований при нагревании обычно не разлагаются.
📸 Видео
8 класс. Основания.Химические свойства оснований.Скачать

ОКСИДЫ, КИСЛОТЫ, СОЛИ И ОСНОВАНИЯ ХИМИЯ 8 класс / Подготовка к ЕГЭ по Химии - INTENSIVСкачать

КИСЛОТЫ В ХИМИИ — Химические Свойства Кислот. Реакция Кислот с Основаниями, Оксидами и МеталламиСкачать

Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Ионные уравнения реакций. Как составлять полные и сокращенные уравненияСкачать

ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Химические Цепочки — Решение Цепочек Химических Превращений // Химия 8 классСкачать

Реакция на результаты ЕГЭ 2022 по русскому языкуСкачать

Химические свойства ОСНОВАНИЙ 8 класс | ПРИНЦИП составления ЛЮБОЙ реакции с участием основанийСкачать

Основания. 8 класс.Скачать

Решение цепочек превращений по химииСкачать

Получение оснований и их классификацияСкачать