Химические свойства олова
Олово – это легкий металл с атомным номером 50, который находится в 14-й группе периодической системы элементов. Этот элемент был известен еще в древности и считался одним из самых редких и дорогих металлов, поэтому изделия из олова могли позволить себе самые богатые жители Римской Империи и Древней Греции. Из олова изготавливали специальную бронзу, которой пользовались еще в третьем тысячелетии до нашей эры. Тогда бронза была самым прочным и популярным сплавом, а олово служило одной из примесей и использовалось более двух тысяч лет.
На латыни этот металл называли словом «stannum», что означает стойкость и прочность, однако таким названием ранее обозначался сплав свинца и серебра. Только в IV веке этим словом начали называть само олово. Само же название «олово» имеет множество версий происхождения. В Древнем Риме сосуды для вина делались из свинца. Можно предположить, что оловом называли материал свинец, из которого изготавливали сосуды для хранения напитка оловина, употребляемого древними славянами.
В природе этот металл встречается редко, по распространенности в земной коре олово занимает всего лишь 47-е место и добывается из касситерита, так называемого оловянного камня, который содержит около 80 процентов этого металла.
- Применение в промышленности
- Физические свойства олова
- Получение олова
- Химические свойства олова
- Олово
- Содержание
- История
- Происхождение названия
- Физические свойства
- Серое и белое олово
- Изотопы
- Химические свойства
- Металлическое олово
- Олово (II)
- Олово (IV)
- Нахождение в природе
- Месторождения
- Распространённость в природе
- Формы нахождения
- Твёрдая фаза. Минералы
- Собственно минеральные формы
- Коллоидная форма
- Формы нахождения олова в жидкой фазе
- Промышленные типы месторождений олова
- Производство
- Применение
- Физиологическое действие
- Олово
- Олово
- 🔍 Видео
Видео:Как составлять ХИМИЧЕСКИЕ УРАВНЕНИЯ | 4 лайфхака - 95 ВСЕХ РЕАКЦИЙ в химии!Скачать

Применение в промышленности
Так как олово является нетоксичным и весьма прочным металлом, он применяется в сплавах с другими металлами. По большей части его используют для изготовления белой жести, которая применяется в производстве банок для консервов, припоев в электронике, а также для изготовления бронзы.
Видео:Химия 29. Элемент олово — Академия занимательных наукСкачать

Физические свойства олова
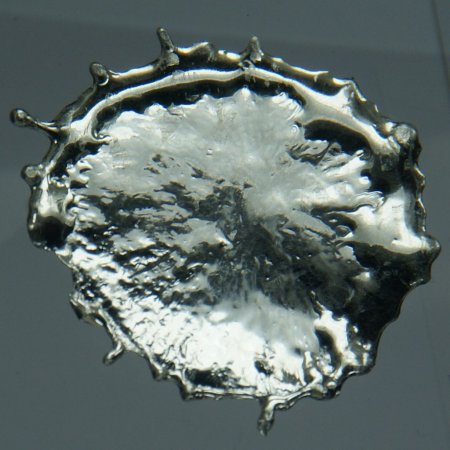
Этот элемент представляет собой металл белого цвета с серебристым отблеском.
Если нагреть олово, можно услышать потрескивание. Этот звук обусловлен трением кристалликов друг о друга. Также характерный хруст появится, если кусок олова просто согнуть.
Олово весьма пластично и ковко. В классических условиях этот элемент существует в виде «белого олова», которое может модифицироваться в зависимости от температуры. Например, на морозе белое олово превратится в серое и будет иметь структуру, схожую со структурой алмаза. Кстати, серое олово очень хрупкое и буквально на глазах рассыпается в порошок. В связи с этим в истории есть терминология «оловянная чума».
Раньше люди не знали о таком свойстве олова, поэтому из него изготавливались пуговицы и кружки для солдат, а также прочие полезные вещи, которые после недолгого времени на морозе превращались в порошок. Некоторые историки считают, что именно из-за этого свойства олова снизилась боеспособность армии Наполеона.
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Получение олова
Основным способом получения олова является восстановление металла из руды, содержащей оксид олова(IV) с помощью угля, алюминия или цинка.
Особо чистое олово получают электрохимическим рафинированием или методом зонной плавки.
Видео:КИСЛОТЫ В ХИМИИ — Химические Свойства Кислот. Реакция Кислот с Основаниями, Оксидами и МеталламиСкачать

Химические свойства олова
При комнатной температуре олово довольно устойчиво к воздействию воздуха или воды. Это объясняется тем, что на поверхности металла возникает тонкая оксидная пленка.
На воздухе олово начинает окисляться только при температуре свыше 150 °С:
Если олово нагреть, этот элемент будет реагировать с большинством неметаллов, образуя соединения со степенью окисления +4 (она более характерна для этого элемента):
Взаимодействие олова и концентрированной соляной кислоты протекает довольно медленно:
Sn + 4HCl → H₂[SnCl₄] + H₂
С концентрированной серной кислотой олово реагирует очень медленно, тогда как с разбавленной в реакцию не вступает вообще.
Очень интересна реакция олова с азотной кислотой, которая зависит от концентрации раствора. Реакция протекает с образованием оловянной кислоты, H₂SnO₃, которая представляет собой белый аморфный порошок:
3Sn + 4HNO₃ + nH₂O = 3H₂SnO₃·nH₂O + 4NO
Если же олово смешать с разбавленной азотной кислотой, этот элемент будет проявлять металлические свойства с образованием нитрата олова:
4Sn + 10HNO₃ = 4Sn(NO₃)₂ + NH₄NO₃ + 3H₂O
Нагретое олово нагреть может реагировать со щелочами с выделением водорода:
Sn + 2KOH + 4H₂O = K₂[Sn(OH)₆] + 2H₂
Здесь вы найдете безопасные и очень красивые эксперименты с оловом.
Степени окисления олова
В простом состоянии степень окисления олова равняется нулю. Также Sn может иметь степень окисления +2: оксид олова(II) SnO, хлорид олова(II) SnCl₂, гидроксид олова(II) Sn(OH)₂. Степень окисления +4 наиболее характерна для оксида олова(IV) SnO₂, галогенидах(IV), например хлорид SnCl₄, сульфид олова(IV) SnS₂, нитрид олова(IV) Sn₃N₄.
Видео:8 класс. Составление уравнений химических реакций.Скачать

Олово
| Олово | |
|---|---|
| Серебристо-белый мягкий, пластичный металл (β-олово) или серый порошок (α-олово) | |
 |
(молярная масса)
(первый электрон)
Олово (химический символ — Sn; лат. Stannum ) — элемент 14-й группы периодической системы химических элементов (по устаревшей классификации — элемент главной подгруппы IV группы), пятого периода, с атомным номером 50. Относится к группе лёгких металлов. При нормальных условиях простое вещество олово — пластичный, ковкий и легкоплавкий блестящий металл серебристо-белого цвета. Известны четыре аллотропические модификации олова: ниже +13,2 °C устойчиво α -олово (серое олово) с кубической решёткой типа алмаза, выше +13,2 °C устойчиво β -олово (белое олово) с тетрагональной кристаллической решёткой. При высоких давлениях обнаружены также γ -олово и σ -олово.
Видео:Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Содержание
- 1 История
- 2 Происхождение названия
- 3 Физические свойства
- 3.1 Серое и белое олово
- 3.2 Изотопы
- 4 Химические свойства
- 4.1 Металлическое олово
- 4.2 Олово (II)
- 4.3 Олово (IV)
- 5 Нахождение в природе
- 5.1 Месторождения
- 5.2 Распространённость в природе
- 5.3 Формы нахождения
- 5.3.1 Твёрдая фаза. Минералы
- 5.3.2 Собственно минеральные формы
- 5.3.2.1 Самородные элементы, сплавы и интерметаллические соединения
- 5.3.2.2 Окисные соединения олова
- 5.3.2.2.1 Касситерит
- 5.3.2.2.2 Гидроокисные соединения
- 5.3.2.2.3 Силикаты
- 5.3.2.2.4 Шпинелиды
- 5.3.2.3 Сульфидные соединения олова
- 5.3.2.3.1 Станнин
- 5.3.3 Коллоидная форма
- 5.3.4 Формы нахождения олова в жидкой фазе
- 5.4 Промышленные типы месторождений олова
- 6 Производство
- 7 Применение
- 8 Физиологическое действие
- 9 Галерея изображений
Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

История
Олово было известно человеку уже в IV тысячелетии до н. э. Этот металл был малодоступен и дорог, поэтому изделия из него редко встречаются среди римских и греческих древностей. Об олове есть упоминания в Библии, Четвёртой Книге Моисея. Олово является (наряду с медью) одним из компонентов оловяннистой бронзы, изобретённой в конце или середине III тысячелетия до н. э. Поскольку бронза являлась наиболее прочным из известных в то время металлов и сплавов, олово было «стратегическим металлом» в течение всего «бронзового века», более 2000 лет (очень приблизительно: XXXV—XI века до н. э.).
Чистое олово получено не ранее XII в., о нем упоминает в своих трудах Р. Бэкон. До этого олово всегда содержало переменное количество свинца. Хлорид SnCl4 впервые получил А. Либавий в 1597 г. Аллотропию олова и явление «оловянной чумы» объяснил Э. Кохен в 1899 г.
Видео:Химические уравнения - Как составлять уравнения реакций // Составление Уравнений Химических РеакцийСкачать

Происхождение названия
Латинское название stannum , связанное с санскритским словом, означающим «стойкий, прочный», первоначально относилось к сплаву свинца и серебра, а позднее к другому, имитирующему его сплаву, содержащему около 67 % олова; к IV веку н. э. этим словом стали называть собственно олово.
Слово олово — общеславянское, однако в некоторых славянских языках такое же или однокоренное слово (польск. ołów , чеш. olovo , серб. олово и др.) используется для обозначения другого, внешне похожего металла — свинца. Слово олово имеет соответствия в балтийских языках (ср. лит. alavas, alvas , латыш. alva — «олово», прусск. alwis — «свинец»). Оно является суффиксальным образованием от корня ol- (ср. древневерхненемецкое elo — «жёлтый», лат. albus — «белый» и пр.), так что металл назван по цвету.
Видео:Уравнения химический реакций на ОГЭ: как составлять без ошибок?Скачать

Физические свойства
Механические и технологические свойства:
модуль упругости 55 ГПа при 0 °С и 48 ГПа при 100 °С; модуль сдвига 16,8—8,1 ГПа; временное сопротивление разрыву — 20 МПа; относительное удлинение — 40 %; твёрдость по Бринеллю — 152 МПа (белое олово), 62 МПа (серое олово); температура литья — 260—300 °С.
При температуре немного выше 170 °С олово становится хрупким.
Стандартный электродный потенциал E °Sn 2+ /Sn равен −0,136 В, а E пары °Sn 4+ /Sn 2+ около 0,151 В.
Серое и белое олово
Простое вещество олово полиморфно. В обычных условиях оно существует в виде β -модификации (белое олово), устойчивой выше +13,2 °C. Белое олово — серебристо-белый, мягкий, пластичный металл, образующий кристаллы тетрагональной сингонии, пространственная группа I4/amd, параметры ячейки a = 0,58197 нм , c = 0,3175 нм , Z = 4 . Координационное окружение каждого атома олова в нём — октаэдр. Плотность β -Sn равна 7,228 г/см 3 . При сгибании прутков олова слышен характерный хруст от взаимного трения кристаллитов.
При охлаждении белое олово переходит в α -модификацию (серое олово). Серое олово образует кристаллы кубической сингонии, пространственная группа Fd3m, параметры ячейки a = 0,646 нм , Z = 8 со структурой типа алмаза. В сером олове координационный полиэдр каждого атома — тетраэдр, координационное число 4. Фазовый переход β -Sn в α -Sn сопровождается увеличением удельного объёма на 25,6 % (плотность α -Sn составляет 5,75 г/см 3 ), что приводит к рассыпанию олова в порошок. Энтальпия перехода α → β ΔH = 2,08 кДж/моль . Одна модификация переходит в другую тем быстрее, чем ниже температура окружающей среды. При −33 °C скорость превращений становится максимальной. Тем не менее белое олово можно переохладить до гелиевых температур. Белое олово превращается в серое также под действием ионизирующего излучения.
Из-за сильного различия структур двух модификаций олова разнятся и их электрофизические свойства. Так, β -Sn — металл, а α -Sn относится к числу полупроводников. Ниже 3,72 К α -Sn переходит в сверхпроводящее состояние. Атомы в кристаллической решётке белого олова находятся в электронном s 2 p 2 -состоянии. Серое олово — ковалентный кристалл со структурой алмаза и электронным sp 3 -состоянием. Белое олово слабо парамагнитно, атомная магнитная восприимчивость χ = +4,5·10 −6 (при 303 К ), при температуре плавления становится диамагнитным, χ = −5,1·10 −6 . Серое олово диамагнитно, χ = −3,7·10 −5 (при 293 К ).
Соприкосновение серого олова и белого приводит к «заражению» последнего, то есть к ускорению фазового перехода по сравнению со спонтанным процессом из-за появления зародышей новой кристаллической фазы. Совокупность этих явлений называется «оловянной чумой». Нынешнее название этому процессу в 1911 году дал Г. Коэн. Начало научного изучения этого фазового перехода было положено в 1870 году работами петербургского учёного, академика Ю. Фрицше. Много ценных наблюдений и мыслей об этом процессе высказано Д. И. Менделеевым в его «Основах химии».
Одним из средств предотвращения «оловянной чумы» является добавление в олово стабилизатора, например висмута. С другой стороны, ускоряет процесс перехода белого олова в серое при не очень низких температурах катализатор хлорстаннат аммония (NH4)2SnCl6.
«Оловянная чума» — одна из причин гибели экспедиции Скотта к Южному полюсу в 1912 году. Она осталась без горючего из-за того, что топливо просочилось из запаянных оловом баков, поражённых «оловянной чумой».
Некоторые историки указывают на «оловянную чуму» как на одно из обстоятельств поражения армии Наполеона в России в 1812 году — сильные морозы привели к превращению оловянных пуговиц на мундирах солдат в порошок.
«Оловянная чума» погубила многие коллекции оловянных солдатиков. Например, в запасниках петербургского музея Александра Суворова превратились в труху десятки фигурок — в подвале, где они хранились, лопнули зимой батареи отопления.
При высоких давлениях обнаружены ещё две модификации олова: γ -олово (переход при температуре 161 °C и давлении около 4 ГПа, при комнатной температуре и давлении 10 ГПа) и σ -олово (переход при температуре около 1000 °C и давлении выше 21 ГПа).
Изотопы
Природное олово состоит из десяти стабильных нуклидов с массовыми числами 112 (в смеси 0,96 % по массе), 114 (0,66 %), 115 (0,35 %), 116 (14,30 %), 117 (7,61 %), 118 (24,03 %), 119 (8,58 %), 120 (32,85 %), 122 (4,72 %) и 124 (5,94 %). Для некоторых из них энергетически возможен двойной бета-распад, однако экспериментально он пока (2018 г.) не наблюдался, поскольку предсказываемый период полураспада очень велик (более 10 20 лет).
Олово обладает наибольшим среди всех элементов числом стабильных изотопов, что связано с тем, что 50 (число протонов в ядрах олова) является магическим числом — оно составляет заполненную протонную оболочку в ядре и повышает тем самым энергию связи и стабильность ядра. Известны два дважды магических изотопа олова, оба они радиоактивны, так как удалены от полосы бета-стабильности: нейтронодефицитное 100 Sn ( Z = N = 50 ) и нейтроноизбыточное 132 Sn ( Z = 50 , N = 82 ).
Изотопы олова 117 Sn и 119 Sn являются мёссбауэровскими изотопами и применяются в гамма-резонансной спектроскопии.
Видео:Химические уравнения. СЕКРЕТНЫЙ СПОСОБ: Как составлять химические уравнения? Химия 8 классСкачать

Химические свойства
Металлическое олово
При комнатной температуре олово, подобно соседу по группе германию, устойчиво к воздействию воздуха или воды. Такая инертность объясняется образованием поверхностной плёнки оксидов. Заметное окисление олова на воздухе начинается при температурах выше 150 °C:
При нагревании олово реагирует с большинством неметаллов. При этом образуются соединения в степени окисления +4, которая более характерна для олова, чем +2. Например:
Растворяется в разбавленных кислотах (HCl, H2SO4):
Олово реагирует c концентрированной соляной кислотой. При этом белое олово (α-Sn) образует раствор хлорида олова (II), а серое (β-Sn) хлорида олова (IV):
Состав продукта реакции олова с азотной кислотой зависит от концентрации кислоты. В концентрированной азотной кислоте (60%) образуется оловянная кислота β -SnO2· n H2O (иногда её формулу записывают как H2SnO3). При этом олово ведёт себя как неметалл:
При взаимодействии с разбавленной азотной кислотой (3-5%) образуется нитрат олова (II):
Окисляется растворами щелочей до гидроксостанната (II), который в горячих расстворах склонен к диспропорцианированию:
Sn + NaOH + 3H2O → Na[Sn(OH)3] + H2↑ 2Na[Sn(OH)3] → Sn + Na2[Sn(OH)6] Sn + 2NaOH + 4H2O → Na2[Sn(OH)6] + 2H2↑
Олово (II)
Менее устойчивая степень окисления чем (IV). Вещества имеют высокую восстановительную активность и легко диспропорцианируют:
2SnO → to SnO2 + Sn
На воздухе соединения быстро окисляются кислородом, как в твердом виде, так и в растворах:
2SnO + O2 → 2SnO2 2Sn 2+ + O2 + 4H + → 2Sn 4+ + 2H2O
Сильным восстановителем является «оловянная соль» SnCl2 ⋅ 2H2O
Оксид можно получить действием аммиака на горячий раствор хлорида олова в атмосфере СO2:
Также при слабом нагревании гидроксида олова (II) Sn(OH)2 в вакууме или осторожном нагревании некоторых солей:
В растворах солей олова идёт сильный гидролиз:
При действии на раствор соли Sn(II) растворами сульфидов выпадает осадок сульфида олова (II):
Этот сульфид может быть легко окислен до сульфидного комплекса раствором полисульфида натрия, при подкислении превращающегося в осадок сульфида олова (IV):
Олово (IV)
Оксид олова(IV) (SnO2) образуется прямым окислением кислородом. При сплавлении с щелочами образует станнаты, при обработке водой образующие гидроксостаннаты:
При гидролизе растворов солей олова (IV) образуется белый осадок — так называемая α -оловянная кислота:
Свежеполученная α -оловянная кислота растворяется в кислотах и щелочах:
При хранении α -оловянная кислота стареет, теряет воду и переходит в β -оловянную кислоту, которая отличается большей химической инертностью. Данное изменение свойств связывают с уменьшением числа активных HO-Sn группировок при стоянии и замене их на более инертные мостиковые -Sn-O-Sn- связи.
Гидрид олова — станнан SnH4 — можно получить по реакции:
Этот гидрид весьма нестоек и медленно разлагается уже при температуре 0 °C.
Четырёхвалентное олово образует обширный класс оловоорганических соединений, используемых в органическом синтезе, в качестве пестицидов и др.
Видео:Олово и свинецСкачать

Нахождение в природе
Олово — редкий рассеянный элемент, по распространённости в земной коре олово занимает 47-е место. Кларковое содержание олова в земной коре составляет, по разным данным, от 2⋅10 −4 до 8⋅10 −3 % по массе. Основной минерал олова — касситерит (оловянный камень) SnO2, содержащий до 78,8 % олова. Гораздо реже в природе встречается станнин (оловянный колчедан) — Cu2FeSnS4 (27,5 % Sn).
Месторождения
Мировые месторождения олова находятся в основном в Китае и Юго-Восточной Азии — Индонезии, Малайзии и Таиланде. Также есть крупные месторождения в Южной Америке (Боливии, Перу, Бразилии) и Австралии.
В России запасы оловянных руд расположены в Хабаровском крае (Солнечный район — месторождения Фестивальное и Соболиное; Верхнебуреинский район — Правоурмийское месторождение), в Чукотском автономном округе (Пыркакайские штокверки; рудник/посёлок Валькумей, Иультин — разработка месторождений закрыта в начале 1990-х годов), в Приморском крае (Кавалеровский район), в Якутии (месторождение Депутатское) и других районах.
Распространённость в природе
Распространённость в природе отражена в следующей таблице:
| Геол. объект | Камен. метеориты | Дуниты и др. | Базальты и др. | Диориты и др. | Гранитоиды | Глины и др. | Вода океанов | Живое вещество(% на живой вес) | Почва | Зола растений |
|---|---|---|---|---|---|---|---|---|---|---|
| Содержание, вес. % | 00 1⋅10 −4 | 0 5⋅10 −5 | 0 1,5⋅10 −4 | 0000 − | 000 3⋅10 −4 | 1⋅10 −3 | 0 7⋅10 −7 | 0000 5⋅10 −5 | 1⋅10 −3 | 00 5⋅10 −4 |
В незагрязнённых поверхностных водах олово содержится в субмикрограммовых концентрациях. В подземных водах его концентрация достигает единиц микрограмм на литр, увеличиваясь в районе оловорудных месторождений, оно попадает в воды за счёт разрушения в первую очередь сульфидных минералов, неустойчивых в зоне окисления. ПДКSn = 2 мг/дм³ .
Олово является амфотерным элементом, то есть элементом, способным проявлять кислотные и основные свойства. Это свойство олова определяет и особенности его распространения в природе. Благодаря этой двойственности олово проявляет литофильные, халькофильные и сидерофильные свойства. Олово по своим свойствам проявляет близость к кварцу, вследствие чего известна тесная связь олова в виде окиси (касситерита) с кислыми гранитоидами (литофильность), часто обогащёнными оловом, вплоть до образования самостоятельных кварц-касситеритовых жил. Щелочной характер поведения олова определяется в образовании довольно разнообразных сульфидных соединений (халькофильность), вплоть до образования самородного олова и различных интерметаллических соединений, известных в ультраосновных породах (сидерофильность).
Формы нахождения
Основная форма нахождения олова в горных породах и минералах — рассеянная (или эндокриптная). Однако олово образует и минеральные формы, и в этом виде часто встречается не только как акцессорий в кислых магматических породах, но и образует промышленные концентрации преимущественно в окисной (касситерит SnO2) и сульфидной (станнин) формах.
Твёрдая фаза. Минералы
В общем можно выделить следующие формы нахождения олова в природе:
- Рассеянная форма; конкретная форма нахождения олова в этом виде неизвестна. Здесь можно говорить об изоморфно рассеянной форме нахождения олова вследствие наличия изоморфизма с рядом элементов (Ta, Nb, W — с образованием типично кислородных соединений; V, Cr, Ti, Mn, Sc — с образованием кислородных и сульфидных соединений). Если концентрации олова не превышают некоторых критических значений, то оно изоморфно может замещать названные элементы. Механизмы изоморфизма различны.
- Минеральная форма: олово установлено в минералах-концентраторах. Как правило, это минералы, в которых присутствует железо Fe +2 : биотиты, гранаты, пироксены, магнетиты, турмалины и так далее. Эта связь обусловлена изоморфизмом, например, по схеме Sn +4 + Fe +2 → 2Fe +3 . В оловоносных скарнах высокие концентрации олова установлены в гранатах (до 5,8 вес. %) (особенно в андрадитах), эпидотах (до 2,84 вес. %) и так далее.
На сульфидных месторождениях олово входит как изоморфный элемент в сфалериты (Силинское месторождение, Россия, Приморье), халькопириты (Дубровское месторождение, Россия, Приморье), пириты. Высокие концентрации олова выявлены в пирротине грейзенов Смирновского месторождения (Россия, Приморье). Считается, что из-за ограниченного изоморфизма происходит распад твёрдых растворов с микровыделениями Cu2 +1 Fe +2 SnS4 или тиллита PbSnS2 и других минералов.
Собственно минеральные формы
Самородные элементы, сплавы и интерметаллические соединения
Хотя концентрации этих минералов в породах очень низки, однако распространены они в широком круге генетических образований. Среди самородных форм вместе с Sn выявлены Fe, Al, Cu, Ti, Cd и так далее, не считая уже известные самородные платиноиды, золото и серебро. Эти же элементы образуют между собой и различные сплавы: (Cu + Sn + Sb), (Pb + Sn + Sb) и другие, а также твёрдые растворы. Среди интерметаллических соединений установлены стистаит SnSb, атакит (Pd,Pt)3Sn, штумырлит Pt(Sn,Bi), звягинцевит (Pd,Pt)3(Pb,Sn), таймырит (Pd,Cu,Pt)3Sn и другие.
Приведённые формы нахождения олова и других элементов встречаются в различных геологических образованиях:
- Группа интрузивных и эффузивных магматических пород: траппы, пикриты Сибирской платформы, гипербазиты и габброиды Камчатки, кимберлиты Якутии, лампроиты Алдана и так далее; гранитоиды Приморья, Дальнего Востока, Тянь-Шаня.
- Группа метасоматически и гидротермально изменённых пород: медно-никелевые руды Сибирской платформы, золоторудные объекты Урала, Кавказа, Узбекистана и так далее.
- Группа современного рудообразования: пелагические осадки Тихого океана, продукты Большого Трещинного Толбачинского извержения, гидротермальная система Узон на Камчатке и прочие.
- Группа осадочных пород различного происхождения.
Окисные соединения олова
Наиболее известной формой является главный минерал олова — касситерит SnO2, представляющий собой соединение олова с кислородом. В минерале по данным ядерной гамма-резонансной спектроскопии присутствует Sn +4 .
Касситерит
Касситерит (от греч. kassiteros — олово) — главный рудный минерал для получения олова, химическая формула SnO2. Теоретически содержит 78,62 % Sn. Образует отдельные выделения, зерна, сплошные массивные агрегаты, в которых зёрна минерала достигают в размере 3—4 мм и даже больше. В чистом виде бесцветные кристаллы, примеси придают минералу самые различные цвета.
- Плотность 6040—7120 кг/м³ (наиболее низкая у светлоокрашенных касситеритов).
- Твёрдость по Моосу 6,5.
- Блеск — матовый, на гранях — алмазный.
- Спайность несовершенная.
- Излом раковистый.
Основные формы выделения касситерита:
- микровключения в других минералах;
- акцессорные выделения минерала в породах и рудах;
- сплошные или вкрапленные руды: игольчатые радиально-лучистые агрегаты (месторождения Приморья), коломорфные и криптокристаллические выделения и скопления (месторождения Приморья); кристаллическая форма — главная форма выделения касситерита.
В России месторождения касситерита имеются на Северо-Востоке, в Приморье, Якутии, Забайкалье; за рубежом — в Малайзии, Таиланде, Индонезии, КНР, Боливии, Нигерии и других странах.
Гидроокисные соединения
Второстепенное место занимают гидроокисные соединения олова, которые можно рассматривать как соли полиоловянных кислот. К ним можно отнести минерал сукулаит Ta2Sn2 +2 O; твёрдый раствор олова в магнетите вида Fe2SnO4 или Fe3SnO3 (Бретштейн Ю. С., 1974; Воронина Л. Б., 1979); «варламовит» — продукт окисления станнина; считается, что он представляет собой смесь аморфных и полуаморфных соединений Sn, метаоловянной кислоты, поликонденсированной фазы и гидрокасситеритовой фазы. Известны также гидратированные продукты окисления — гидромартит 3SnO·H2O; мушистонит (Cu,Zn,Fe)Sn(OH)6; гидростаннат меди CuSn(OH)6 и другие.
Силикаты
Известна многочисленная группа силикатов олова, представленная малаяитом CaSn[SiO5]; пабститом Ba(Sn, Ti)Si3O9, стоказитом Ca2Sn2Si6O18·4H2O и др. Малаяит образует даже промышленные скопления.
Шпинелиды
Из других окисных соединений известны также шпинелиды, например, минерал нигерит Sn2Fe4Al16O32 (Peterson E. U., 1986).
Сульфидные соединения олова
Включает различные соединения олова с серой. Это вторая по промышленному значению группа минеральных форм нахождения олова. Наиболее важным из них является станнин, второй по значению минерал. Кроме этого, отмечаются франкеит Pb5Sn3Sb2S14, герценбергит SnS, берндтит SnS2, тиллит PbSnS2 и кестерит Cu2ZnSnS4. Выявлены и более сложные сульфидные соединения олова со свинцом, серебром, медью, имеющие в основном минералогическое значение. Тесная связь олова с медью обусловливает частое присутствие на оловорудных месторождениях халькопирита CuFeS2 с образованием парагенезиса касситерит — халькопирит.
Станнин
Станнин (от лат. stannum — олово), оловянный колчедан, минерал из класса сульфидов с общей формулой вида Cu2FeSnS4. Она следует из формулы халькопирита путём замены одного атома Fe на Sn. Содержит 29,58 % Cu, 12,99 % Fe, 27,5 % Sn и 29,8 S, а также примеси Zn, Sb, Cd, Pb и Ag. Широко распространённый минерал в оловорудных месторождениях России. На ряде месторождений России (Приморье, Якутия) и Средней Азии (Таджикистан) он является существенным элементов сульфидных минералов и часто вместе с варламовитом составляет 10—40 % общего олова. Часто образует вкрапленность в сфалерите ZnS, халькопирите. Во многих случаях наблюдаются явления распада станнина с выделением касситерита.
Коллоидная форма
Коллоидные и олово-кремнистые соединения играют значительную роль в геохимии олова, хотя детально она не изучена. Значительное место в геологии элемента играют коломорфные соединения и продукты его кристаллических превращений в скрытокристаллические разности. Коломорфный касситерит рассматривается как форма выражения вязких гелеобразных растворов.
Независимые исследования выявили аномально высокую растворимость SnO2 в хлор-кремниевых растворах. Максимальная растворимость достигается при отношении SnO2SiO2 = 1,5 .
Анализ свойств соединения Sn(OH)4 и близость их к соединению Si(OH)4 выявляет способность его к полимеризации с образованием в конечном счёте соединений H2Sn k O2 k +1, Sn k O2 k −1(OH)2. В обоих случаях возможно замещение группы (ОН) на анионы F и Cl.
Таким образом, полимеризация молекул Sn(OH)4 и соединение их с молекулами Si(OH)4 ведёт к образованию геля (коллоида) и появлению цепочек H m Sn2 n Si n O p , причём m ≤ 8 , или H s [SiO2 n (SnO m ) d ] (Некрасов И. Я. и др., 1973).
Имеющиеся данные говорят о том, что коллоидная форма является естественным промежуточным звеном при осаждении олова из гидротермальных растворов.
Формы нахождения олова в жидкой фазе
Наименее изученная часть геохимии олова, хотя в газово-жидких включениях установлены касситериты в виде минералов-узников (Кокорин А. М. и др., 1975). Работ по анализу конкретных оловосодержащих природных растворов нет. В основном вся информация основана на результатах экспериментальных исследований, которые говорят только о вероятных формах нахождения олова в растворах. Существенную роль в разработке методики этих исследований принадлежит академику В. Л. Барсукову.
Вся совокупность экспериментально установленных форм нахождения олова в растворах разбивается на группы:
- Ионные соединения. Эти соединения и их структура описываются с позиций классических валентных и стереохимических представлений. Выделяются подгруппы:
- Простые ионы Sn +2 и Sn +4 в основном обнаружены в магматических расплавах, а также в гидротермальных растворах, обладающих низкими значениями pH. Однако в существующих гидротермальных системах, отражаемых составом газово-жидких включений, такие условия не установлены.
- Галогениды — SnF2, SnF4 0 , SnCl4 0 . Считается, что роль хлора в переносе и отложении олова и сопутствующих металлов более значительна, чем роль фтора.
- Гидроксильные соединения. В щелочных условиях исходными являются соединения H2SnO2, H2SnO4, H2SnO3. Эти формы часто устанавливаются на основе известных минеральных форм. Часть этих форм имеет как искусственное (CaSnO3, Ca2SnO4), так и природное (FeSnO2, Fe2SnO4) происхождение. В кислых средах эти соединения ведут себя как слабые основания типа Sn(OH)2, Sn(OH)4. Считается, что одной из форм проявления подобных соединений является варламовит. Согласно экспериментальным данным Sn(OH)4 отлагается только при Т в слабокислых или нейтральных условиях при pH = 7—9 . Соединения Sn(OH)4 и Sn(OH)3 + устойчивы при pH= 7—9, тогда как Sn(OH)2 +2 и Sn(OH) +2 — при pH . Довольно часто группы (ОН) −1 замещаются на F и Cl, создавая галогенозамещённые модификации гидросоединений олова. В общем виде эти формы представлены соединениями Sn(OH)4- kF k или Sn(OH)4− kF k-nCl n. В целом соединение Sn(OH)3F устойчиво при Т = +25…+50 °C , а Sn(OH)2F2 — при Т = 200 °C .
- Сульфидные соединения. По экспериментальным данным в растворе присутствуют соединения SnS4 −4 или SnS3 −2 при pH > 9 ; SnS2O −2 ( pH = 8—9 ) и Sn(SH)4 ( pH = 6 ). Имеется упоминание о существовании соединения типа Na2SnS3, неустойчивого в кислой среде.
- Комплексные соединения олова изучены при растворении касситерита во фторированных средах. Эти соединения отличаются высокой растворимостью. Этими же свойствами обладают соединения, полученные в хлоридных растворах. В качестве основных форм комплексных соединений, известных из экспериментов, можно назвать Na2[Sn(OH)6], Na2[SnF6], Na2[Sn(OH)2F4] и пр. Эксперименты показали, что комплекс Sn(OH)4F2 −2 будет преобладать при Т = 200 °C .
- Коллоидные и олово-кремнистые соединения. Об их существовании говорит присутствие на многих месторождениях коломорфных выделений касситерита.
Промышленные типы месторождений олова
Описанные выше геохимические особенности олова находят косвенное отражение в формационной классификации оловорудных месторождений, предложенной Е. А. Радкевич с последующими дополнениями.
А. Формация оловоносных гранитов. Касситерит установлен в акцессорной части гранитов. Б. Формация редкометальных гранитов. Это граниты литионит-амазонит-альбитового типа (апограниты по А. А. Беусу). Касситерит в акцессорной части вместе колумбит-татнатлитом, микролитом и прочими. В. Формация оловоносных пегматитов. Оловянная минерализация характерна для Be-Li-, Be-Ta-, F-Li- типов. Г. Формация полевошпат-кварц-касситеритовая. Выделена Ив. Ф. Григорьевым. Это кварц-полевошпатовые жилы с касситеритом и другими минералами. Д. Формация кварц-касситеритовая. Распространена на северо-востоке России. Это жильные зоны, грейзены с кварцем, мусковитом, вольфрамитом, касситеритом и другим. Е. Формация касситерит-силикатно-сульфидная с турмалиновым и хлоритовым типами. Одна из основных продуктивных формаций Приморья России. Ж. Формация касситерит-сульфидная. Также основная оловопродуктивная формация. В ней выделяют основные типы: 1) штокверковое олово-вольфрамовое оруденение; 2) рудные тела квар-касситерит-арсенопиритового типа; 3) продуктивные кварцевые жилы сульфидно-касситерит-хлоритового типа. З. Формация оловянно-скарновая. И. Формация деревянистого олова (риолитовая формация). К. Формация основных и ультраосновных пород (по И. Я. Некрасову). Л. Формация щелочных пород Украины (по В. С. Металлиди, 1988).
Видео:Типы Химических Реакций — Химия // Урок Химии 8 КлассСкачать

Производство
В процессе производства рудоносная порода (касситерит) подвергается дроблению до размеров частиц в среднем
10 мм , в промышленных мельницах, после чего касситерит за счет своей относительно высокой плотности и массы отделяется от пустой породы вибрационно-гравитационным методом на обогатительных столах. В дополнение применяется флотационный метод обогащения/очистки руды. Таким образом удается повысить содержание олова в руде до 40—70 %. Далее проводят обжиг концентрата в кислороде для удаления примесей серы и мышьяка. Полученный концентрат оловянной руды выплавляется в печах. В процессе выплавки восстанавливается до свободного состояния посредством применения в восстановлении древесного угля, слои которого укладываются поочередно со слоями руды, или алюминием (цинком) в электропечах: SnO2 + C = Sn + CO2 . Особо чистое олово полупроводниковой чистоты готовят электрохимическим рафинированием или методом зонной плавки.
Видео:ХИМИЧЕСКИЕ УРАВНЕНИЯ | Как составлять уравнения реакций | Химия 8 классСкачать

Применение
- Олово используется в основном как безопасное, нетоксичное, коррозионностойкое покрытие в чистом виде или в сплавах с другими металлами. Главные промышленные применения олова — в белой жести (лужёное железо) для изготовления тары пищевых продуктов, в припоях для электроники, в домовых трубопроводах, в подшипниковых сплавах и в покрытиях из олова и его сплавов. Важнейший сплав олова — бронза (с медью). Другой известный сплав — пьютер — используется для изготовления посуды. Для этих целей расходуется около 33 % всего добываемого олова. До 60 % производимого олова используется в виде сплавов с медью, медью и цинком, медью и сурьмой (подшипниковый сплав, или баббит), с цинком (упаковочная фольга) и в виде оловянно-свинцовых и оловянно-цинковых припоев. В последнее время возрождается интерес к использованию металла, поскольку он наиболее «экологичен» среди тяжёлых цветных металлов. Используется для создания сверхпроводящих проводов на основе интерметаллического соединения Nb3Sn.
- Дисульфид олова SnS2 применяют в составе красок, имитирующих позолоту («поталь»).
- Искусственные радиоактивные ядерные изомеры олова 117m Sn и 119m Sn — источники гамма-излучения, являются мёссбауэровскими изотопами и применяются в гамма-резонансной спектроскопии.
- Интерметаллические соединения олова и циркония обладают высокими температурами плавления (до 2000 °C) и стойкостью к окислению при нагревании на воздухе и имеют ряд областей применения.
- Олово является важнейшим легирующим компонентом при получении конструкционных сплавов титана.
- Двуокись олова — очень эффективный абразивный материал, применяемый при «доводке» поверхности оптического стекла.
- Смесь солей олова — «жёлтая композиция» — ранее использовалась как краситель для шерсти.
- Олово применяется также в химических источниках тока в качестве анодного материала, например: марганцево-оловянный элемент, окисно-ртутно-оловянный элемент. Перспективно использование олова в свинцово-оловянном аккумуляторе; так, например, при равном напряжении, по сравнению со свинцовым аккумулятором свинцово-оловянный аккумулятор обладает в 2,5 раза большей ёмкостью и в 5 раз большей энергоплотностью на единицу объёма, внутреннее сопротивление его значительно ниже.
- Исследуются изолированные двумерные слои олова (станен), созданные по аналогии с графеном.
Видео:Химия. 9 класс (Урок№17 - Углерод. Аллотропные модификации углерода.Химические свойства. Адсорбция.)Скачать

Физиологическое действие
О роли олова в живых организмах практически ничего не известно. Ежедневное поступление олова с пищей составляет 0,2—3,5 мг , при регулярном потреблении консервированной пищи — до 38 мг . В теле человека содержится примерно (1—2)·10 −4 % олова, наибольшая концентрация наблюдается в кишечнике.
Металлическое олово не токсично, что позволяет применять его в пищевой промышленности. Олово представляет опасность для человека в виде паров, различных аэрозольных частиц и пыли. При воздействии паров или пыли олова может развиться станноз — поражение лёгких. Станнан (оловянистый водород) — сильнейший яд. Также очень токсичны некоторые оловоорганические соединения. Временно допустимая концентрация соединений олова в атмосферном воздухе 0,05 мг/м 3 , ПДК олова в пищевых продуктах 200 мг/кг , в молочных продуктах и соках — 100 мг/кг . Токсическая доза олова для человека — 2 г , интоксикация организма начинается при содержании в организме 250 мг/кг .
Вредные примеси, содержащиеся в олове в обычных условиях хранения и применения, в том числе в расплаве при температуре до 600 °C, не выделяются в воздух в объёмах, превышающих предельно допустимую концентрацию (в частности, определенную по ГОСТ 12.1.005—76. Длительное (в течение 15—20 лет ) воздействие пыли олова оказывает фиброгенное воздействие на лёгкие и может вызвать заболевание работающих пневмокониозом.
Видео:ВСЕ ПРО АЛКАНЫ за 8 минут: Химические Свойства и ПолучениеСкачать

Олово
|  |
| |||||||||||||||||||||||
Видео:Опыты по химии. Соляная кислота и металлыСкачать

Олово
Олово (лат. Stannum), Sn, химический элемент IV группы периодической системы Менделеева; атомный номер 50, атомная масса 118,69; белый блестящий металл, тяжелый, мягкий и пластичный. Элемент состоит из 10 изотопов с массовыми числами 112, 114-120, 122, 124; последний слабо радиоактивен; изотоп 120 Sn наиболее распространен (около 33%).
Историческая справка. Сплавы Олова с медью — бронзы были известны уже в 4-м тысячелетии до н. э., а чистый металл во 2-м тысячелетии до н. э. В древнем мире из Олова делали украшения, посуду, утварь. Происхождение названий «stannum» и «олово» точно не установлено.
Распространение Олова в природе. Олово — характерный элемент верхней части земной коры, его содержание в литосфере 2,5·10 -4 % по массе, в кислых изверженных породах 3·10 -4 ‘%, а в более глубоких основных 1,5·10 -4 %; еще меньше Олова в мантии. Концентрирование Олова связано как с магматическими процессами (известны «оловоносные граниты», пегматиты, обогащенные Оловом), так и с гидротермальными процессами; из 24 известных минералов Олова 23 образовались при высоких температурах и давлениях. Главное промышленное значение имеет касситерит SnO2, меньшее — станнин Cu2FeSnS4. В биосфере Олово мигрирует слабо, в морской воде его лишь 3·10 -7 % ; известны водные растения с повышенным содержанием Олова. Однако общая тенденция геохимии Олова в биосфере — рассеяние.
Физические свойства Олова. Олово имеет две полиморфные модификации. Кристаллическая решетка обычного β-Sn (белого Олово) тетрагональная с периодами а = 5,813Å, с = 3,176Å; плотность 7,29 г/см 3 . При температурах ниже 13,2 °С устойчиво α-Sn (серое Олово) кубической структуры типа алмаза; плотность 5,85 г/см 3 . Переход β->α сопровождается превращением металла в порошок. tпл 231 ,9 °С, tкип 2270 °С. Температурный коэффициент линейного расширения 23·10 -6 (0-100 °С); удельная теплоемкость (0°С) 0,225 кдж/(кг·К), то есть 0,0536 кал/(г·°С); теплопроводность (0°С) 65,8 вт/(м·К.), то есть 0,157 кал/(см·сек·°С); удельное электрическое сопротивление (20 °С) 0,115·10 -6 ом·м, то есть 11,5·10 -6 ом·см. Предел прочности при растяжении 16,6 Мн/м 2 (1,7 кгс/мм 2 ); относительное удлинение 80-90% ; твердость по Бринеллю 38,3-41,2 Мн/м 2 (3,9-4,2 кгс/мм 2 ). При изгибании прутков Олова слышен характерный хруст от взаимного трения кристаллитов.
Химические свойства Олова. В соответствии с конфигурацией внешних электронов атома 5s 2 5р 2 Олово имеет две степени окисления: +2 и +4; последняя более устойчива; соединения Sn (II) — сильные восстановители. Сухим и влажным воздухом при температуре до 100 °С Олово практически не окисляется: его предохраняет тонкая, прочная и плотная пленка SnO2. По отношению к холодной и кипящей воде Олово устойчиво. Стандартный электродный потенциал Олова в кислой среде равен -0,136 в. Из разбавленных НCl и H2SO4 на холоду Олово медленно вытесняет водород, образуя соответственно хлорид SnCl2 и сульфат SnSO4. В горячей концентрированной H2SO4 при нагревании Олово растворяется, образуя Sn(SO4)2 и SO2. Холодная (0°С) разбавленная азотная кислота действует на Олово по реакции:
При нагревании с концентрированной HNO3 (плотность 1,2-1,42 г/мл) Олово окисляется с образованием осадка метаоловянной кислоты H2SnO3, степень гидротации которой переменна:
При нагревании Олова в концентрированных растворах щелочей выделяется водород и образуется гексагидростаниат:
Кислород воздуха пассивирует Олово, оставляя на его поверхности пленку SnO2. Химически оксид (IV) SnO2 очень устойчив, а оксид (II) SnO быстро окисляется, его получают косвенным путем. SnO2 проявляет преимущественно кислотные свойства, SnO — основные.
С водородом олово непосредственно не соединяется; гидрид SnH4 образуется при взаимодействии Mg2Sn с соляной кислотой:
Это бесцветный ядовитый газ, tкип -52 °С; он очень непрочен, при комнатной температуре разлагается на Sn и H2 в течение нескольких суток, а выше 150°С — мгновенно. Образуется также при действии водорода в момент выделения на соли Олова, например:
С галогенами олово дает соединения состава SnX2 и SnX4. Первые солеобразны и в растворах дают ионы Sn 2+ , вторые (кроме SnF4) гидролизуются водой, но растворимы в неполярных органических жидкостях. Взаимодействием Олова с сухим хлором (Sn + 2Cl2 = SnCl4) получают тетрахлорид SnCl4; это бесцветная жидкость, хорошо растворяющая серу, фосфор, иод. Раньше по приведенной реакции удаляли Олово с вышедших из строя луженых изделий. Сейчас способ мало распространен из-за токсичности хлора и высоких потерь Олова.
Тетрагалогениды SnX4 образуют комплексные соединения с Н2О, NH3, оксидами азота, РСl5, спиртами, эфирами и многими органическими соединениями. С галогеноводородными кислотами галогениды Олова дают комплексные кислоты, устойчивые в растворах, например H2SnCl4 и H2SnCl6. При разбавлении водой или нейтрализации растворы простых или комплексных хлоридов гидролизуются, давая белые осадки Sn(OH)2 или Н2SnО3·nН2О. С серой Олово дает нерастворимые в воде и разбавленных кислотах сульфиды: коричневый SnS и золотисто-желтый SnS2.
Получение Олова. Промышленное получение Олова целесообразно, если содержание его в россыпях 0,01% , в рудах 0,1%; обычно же десятые и единицы процентов. Олову в рудах часто сопутствуют W, Zr, Cs, Rb, редкоземельные элементы, Та, Nb и другие ценные металлы. Первичное сырье обогащают: россыпи — преимущественно гравитацией, руды — также флотогравитацией или флотацией.
Концентраты, содержащие 50-70% Олова, обжигают для удаления серы, очищают от железа действием НCl. Если же присутствуют примеси вольфрамита (Fe,Mn)WO4 и шеелита CaWO4, концентрат обрабатывают НCl; образовавшуюся WO3·H2O извлекают с помощью NH4OH. Плавкой концентратов с углем в электрических или пламенных печах получают черновое Олово (94-98% Sn), содержащее примеси Cu, Pb, Fe, As, Sb, Bi. При выпуске из печей черновое Олово фильтруют при температуре 500-600 °С через кокс или центрифугируют, отделяя этим основную массу железа. Остаток Fe и Cu удаляют вмешиванием в жидкий металл элементарной серы; примеси всплывают в виде твердых сульфидов, которые снимают с поверхности Олова. От мышьяка и сурьмы Олово рафинируют аналогично — вмешиванием алюминия, от свинца — с помощью SnCl2. Иногда Bi и Рb испаряют в вакууме. Электролитическое рафинирование и зонную перекристаллизацию применяют сравнительно редко для получения особо чистого Олова. Около 50% всего производимого Олова составляет вторичный металл; его получают из отходов белой жести, лома и различных сплавов.
Применение Олова. До 40% Олово идет на лужение консервной жести, остальное расходуется на производство припоев, подшипниковых и типографских сплавов. Оксид SnO2 применяется для изготовления жаростойких эмалей и глазурей. Соль — станнит натрия Na2SnO3·3H2O используется в протравном крашении тканей. Кристаллический SnS2 («сусальное золото») входит в состав красок, имитирующих позолоту. Станнид ниобия Nb3Sn — один из наиболее используемых сверхпроводящих материалов.
Токсичность самого Олова и большинства его неорганических соединений невелика. Острых отравлений, вызываемых широко используемым в промышленности элементарным Оловом, практически не встречается. Отдельные случаи отравлений, описанные в литературе, по-видимому, вызваны выделением AsH3 при случайном попадании воды на отходы очистки Олова от мышьяка. У рабочих оловоплавильных заводов при длительном воздействии пыли оксида Олова (так называемое черное Олово, SnO) могут развиться пневмокониозы; у рабочих, занятых изготовлением оловянной фольги, иногда отмечаются случаи хронической экземы. Тетрахлорид Олова (SnСl4·5Н2О) при концентрации его в воздухе свыше 90 мг/м 3 раздражающе действует на верхние дыхательные пути, вызывая кашель; попадая на кожу, хлорид Олова вызывает ее изъязвления. Сильный судорожный яд — оловянистый водород (станнометан, SnH4), но вероятность образования его в производственных условиях ничтожна. Тяжелые отравления при употреблении в пищу давно изготовленных консервов могут быть связаны с образованием в консервных банках SnH4 (за счет действия на полуду банок органических кислот содержимого). Для острых отравлений оловянистым водородом характерны судороги, нарушение равновесия; возможен смертельный исход.
Органические соединения Олова, особенно ди- и триалкильные, обладают выраженным действием на центральную нервную систему. Признаки отравления триалкильными соединениями: головная боль, рвота, головокружение, судороги, парезы, параличи, зрительные расстройства. Нередко развиваются коматозное состояние, нарушения сердечной деятельности и дыхания со смертельным исходом. Токсичность диалкильных соединений Олова несколько ниже, в клинической картине отравлений преобладают симптомы поражения печени и желчевыводящих путей.
Олово как художественный материал. Отличные литейные свойства, ковкость, податливость резцу, благородный серебристо-белый цвет обусловили применение Олова в декоративно-прикладном искусстве. В Древнем Египте из Олова выполнялись украшения, напаянные на другие металлы. С конца 13 века в западноевропейских странах появились сосуды и церковная утварь из Олова, близкие серебряным, но более мягкие по абрису, с глубоким и округлым штрихом гравировки (надписи, орнаменты). В 16 веке Ф. Брио (Франция) и К. Эндерлайн (Германия) начали отливать парадные чаши, блюда, кубки из Олова с рельефными изображениями (гербы, мифологические, жанровые сцены). А. Ш. Буль вводил Олово в маркетри при отделке мебели. В России изделия из Олова (рамы зеркал, утварь) получили широкое распространение в 17 веке; в 18 веке на севере России расцвета достигло производство медных подносов, чайников, табакерок, отделанных оловянными накладками с эмалями. К началу 19 века сосуды из Олова уступили место фаянсовым и обращение к Олову как художественному материалу стало редким. Эстетические достоинства современных декоративных изделий из Олова — в четком выявлении структуры предмета и зеркальной чистоте поверхности, достигаемой литьем без последующей обработки.
🔍 Видео
РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

СОЛИ ХИМИЯ 8 КЛАСС: Химические Свойства Солей и Получение // Реакция Солей с Кислотами и МеталламиСкачать

ОКСИДЫ ХИМИЯ — Что такое Оксиды? Химические свойства Оксидов | Реакция ОксидовСкачать

8 класс. ОВР. Окислительно-восстановительные реакции.Скачать