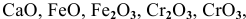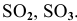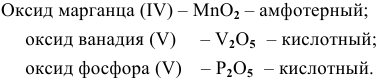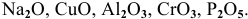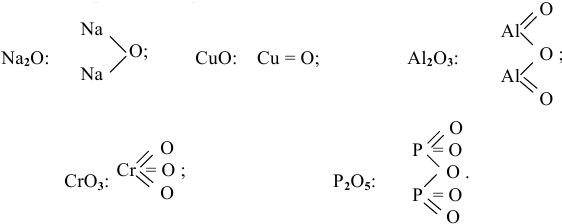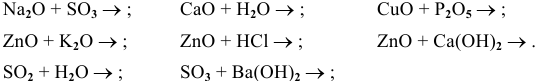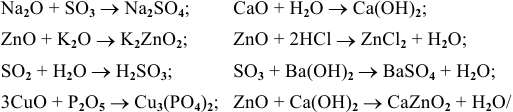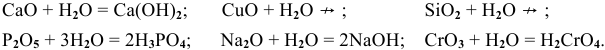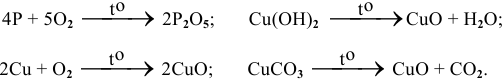- Типовые задачи с решениями по оксидам
- Задача 1
- Задача 2
- Задача 3
- Задача 4
- Задача 5
- Задача 6
- Задача 7
- Задача 8
- Как выполнить задание вида «составить уравнения возможных реакций» (на примере темы «Свойства оксидов», 8 класс) презентация к уроку по химии (8 класс) на тему
- Скачать:
- Предварительный просмотр:
- Подписи к слайдам:
- По теме: методические разработки, презентации и конспекты
- Тема урока: «Оксиды». 8-й класс
- 🔍 Видео
Типовые задачи с решениями по оксидам
Задача 1
Назвать следующие оксиды:
Решение:
Рекомендую самостоятельно составить подобную задачу и решить ее.
Задача 2
Найти эмпирические формулы следующих оксидов: оксид марганца (IV), оксид ванадия (V), оксид фосфора (V). К какой группе оксидов относится каждый из них?
Решение:
Рекомендую самостоятельно составить подобную задачу и решить ее.
Задача 3
Привести графические формулы следующих оксидов:
Решение:
Графическая формула показывает порядок, в котором атомы соединены в молекуле. В графической формуле единица химической связи (валентности) изображается черточкой:
Рекомендую самостоятельно составить подобную задачу и решить ее.
Задача 4
К каким типам относятся следующие оксиды: 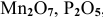
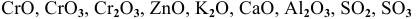
Решение:
К основным оксидам относятся оксиды металлов с ярко выраженными металлическими свойствами, проявляющими низкие валентности, в основном I и II:
К амфотерным оксидам относятся оксиды металлов со слабо выраженными металлическими свойствами. Обычно эти металлы находятся в каждом периоде на границе между неметаллами и металлами с ярко выраженными металлическими свойствами:
К кислотным оксидам относятся оксиды неметаллов, а также оксиды металлов, проявляющих высокие валентности, в основном V, VI, VII: 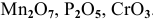
Рекомендую самостоятельно составить подобную задачу и решить ее.
Задача 5
Составить уравнения следующих химических реакций:
Решение:
Рекомендую самостоятельно составить подобную задачу и решить ее.
Задача 6
Какие из перечисленных оксидов будут взаимодействовать с водой: 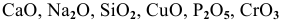
Решение:
С водой взаимодействуют кислотные оксиды, за исключением 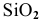
оксид щелочного или щелочно-земельного металла + 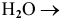
Рекомендую самостоятельно составить подобную задачу и решить ее.
Задача 7
Какие из оксидов будут реагировать попарно: 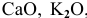
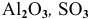
Решение:
Рекомендую самостоятельно составить подобную задачу и решить ее.
Задача 8
Как можно получить следующие оксиды: 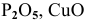
Решение:
Эти задачи взяты со страницы решения задач по неорганической химии:
Возможно эти страницы вам будут полезны:




















































Образовательный сайт для студентов и школьников
Копирование материалов сайта возможно только с указанием активной ссылки «www.lfirmal.com» в качестве источника.
© Фирмаль Людмила Анатольевна — официальный сайт преподавателя математического факультета Дальневосточного государственного физико-технического института
Видео:Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Как выполнить задание вида «составить уравнения возможных реакций» (на примере темы «Свойства оксидов», 8 класс)
презентация к уроку по химии (8 класс) на тему
Предлагаемая презентация с анимационными эффектами и подсказками может помочь восьмикласснику научиться выполнять задания данного вида при изучении темы «Свойства оксидов». Предназначена для самостоятельной работы школьников, много пропускающих по болезни.
Видео:ОКСИДЫ ХИМИЯ — Что такое Оксиды? Химические свойства Оксидов | Реакция ОксидовСкачать

Скачать:
| Вложение | Размер |
|---|---|
| sostavit_uravneniya_vozmozhnykh_reaktsiy_2.ppsx | 1.68 МБ |
Предварительный просмотр:
Видео:ОКСИДЫ, КИСЛОТЫ, СОЛИ И ОСНОВАНИЯ ХИМИЯ 8 класс / Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Подписи к слайдам:
Как выполнить задание… (подсказки ученику) Задание № 1: составить уравнения возможных реакций Составитель: Анна Валерьевна Дзенис учитель химии СП ЦО 109 в ФНКЦ ДГОИ (на примере темы «Химические свойства оксидов»)
Уважаемые восьмиклассники! Предлагаемая презентация поможет вам научиться выполнять задания вида «Составить уравнения возможных реакций» на примере темы «Химические свойства оксидов». Презентация содержит: алгоритм выполнения задания (последовательность действий), обучающие примеры (в них с помощью анимации показана последовательность действий), тренировочные примеры (их нужно выполнить в тетради самостоятельно, а чтобы проверить себя, нажмите соответствующую выноску), справочный материал (выноска-облачко), который может понадобиться при выполнении упражнения. УСПЕХОВ!
1) В левой части схемы под формулой каждого исходного вещества подпишите, к какому классу оно относится. 2) Проверьте, могут ли реагировать вещества , принадлежащие к этим классам . 3) Если взаимодействие возможно, определите, к каким классам относятся продукты реакций. 4) В правой части схемы реакции (после » → «) внизу подпишите названия классов образующихся веществ. 5) Составьте формулы продуктов реакции в соответствии с тем, к каким классам они относятся. (Не забудьте, составляя формулы, поставить значения валентностей и определить индексы!) Последовательность действий:
Пример 1 (обучающий) Задание: составить уравнение возможной реакции Ва O + HCl → …. Решение: Ва O + HCl соль основный кислота оксид (Взаимодействие возможно, так как основные оксиды реагируют с кислотами) Ва II I 2 2 Cl H 2 O + вода Если вы забыли свойства оксидов Следующий пример = →
Пример 2 (тренировочный) Задание: составить уравнение возможной реакции Если вы забыли свойства оксидов SrO + H 3 PO 4 → Проверьте себя Решение: H 2 O + Sr 3 2 ( PO 4 ) II III 3 3 2 кислота основный оксид соль вода = Следующий пример
АМФОТЕРНЫЙ оксид реагирует и с кислотой и со щелочью ОСНОВНЫЙ СОЛЬ КИСЛОТНЫЙ ОКСИДЫ + + H 2 O + H 2 O C ОЛЬ + Н 2 О ЩЕЛОЧЬ (для оксидов Ме IA и CaO , SrO , BaO ) КИСЛОТА (кроме SiO 2 ) + кислота щелочь + Вернуться к примеру 2 Вернуться к примеру 3 Вернуться к примеру 4 Вернуться к примеру 1 Вернуться к примеру 5 Вернуться к примеру 6 Вернуться к примеру 7 Если вы забыли класси-фикацию оксидов Свойства оксидов Вернуться к примеру 8 Вернуться к примеру 9 Вернуться к примеру 10 Вернуться к самоконтролю
Солеобразующие ОКСИДЫ основные амфотерные кислотные Оксиды металлов, которым соответствуют основания Оксиды, проявляющие и основные, и кислотные свойства ( Н 2 О, BeO , ZnO , Al 2 O 3 , Cr 2 O 3 ) Оксиды, которым соответствуют кислоты: а) оксиды неметаллов кроме ( СО, N 2 O , NO ) ; б) оксиды металлов, если валентность Ме ≥ 5 Несолеобразующие ( СО, N 2 O , NO ) Классификация оксидов Вернуться к предыдущему слайду
Некоторые кислотные оксиды и соответствующие им кислоты Вернуться к примеру 3 Вернуться к примеру 6 Вернуться к примеру 7 Вернуться к примеру 9 Вернуться к примеру 10 Кислотный оксид Соответствующая кислота Кислотный остаток (и его валентность) CO 2 H 2 CO 3 CO 3 ( II ) SiO 2 H 2 SiO 3 SiO 3 ( II ) N 2 O 5 HNO 3 NO 3 (I) P 2 O 5 H 3 PO 4 PO 4 ( III ) SO 2 H 2 SO 3 SO 3 ( II ) SO 3 H 2 SO 4 SO 4 ( II ) Вернуться к самоконтролю
Пример 3 (обучающий) Задание: составить уравнение возможной реакции Решение: Если вы забыли свойства оксидов Следующий пример = N 2 O 5 Н 2 О → N 2 O 5 + + …. Н 2 О → Н NO 3 кислотный оксид кислота вода Если вы забыли формулы кислот 2
+ Пример 4 (обучающий) Задание: составить уравнение возможной реакции Решение: Если вы забыли свойства оксидов Следующий пример основный оксид С uO Н 2 О → Подсказки: 1) Каков характер данного оксида меди? 2) Обратите внимание, какие основные оксиды взаимодействуют с водой. 3) Будет ли реагировать с водой данный оксид? Почему? ≠ вода
+ Пример 5 (тренировочный) Задание: составить уравнение возможной реакции Решение: Если вы забыли свойства оксидов Проверьте себя Следующий пример основный оксид → = вода вода → а) Rb 2 O + Н 2 О Н 2 О б) SiO 2 ≠ кислотный оксид Rb ОН щелочь 2 I I Подсказки: 1) Каков характер оксида рубидия? Может ли он реагировать с водой? Почему? 2) Каков характер оксида кремния( IV) ? Будет ли реагировать с водой данный оксид? Почему?
Пример 6 (обучающий) Задание: составить уравнение возможной реакции Решение: Если вы забыли свойства оксидов Следующий пример + …. → → = вода кислотный оксид Если вы забыли формулу кислотного остатка щелочь Р 2 O 5 + + NaOH Р 2 O 5 NaOH соль Na Р O 4 3 I III Н 2 О 6 2 3
Пример 7 (тренировочный) Задание: составить уравнение возможной реакции Решение: Если вы забыли свойства оксидов Проверьте себя Следующий пример = → вода Если вы забыли формулу кислотного остатка соль кислотный оксид щелочь Н 2 О I II 2 SO 3 + + KOH K 2 SO 4
Пример 8 (тренировочный) + Na 2 O Задание: составить уравнение возможной реакции → Решение: Подсказка: 1) Каков характер данных оксидов? 2) Возможно ли взаимодействие между такими оксидами? основный оксид основный оксид К 2 О ≠ Если вы забыли свойства оксидов Следующий пример Проверьте себя
Пример 9 (обучающий) Задание: составить уравнение возможной реакции Решение: Если вы забыли свойства оксидов Следующий пример → …. = SiO 2 + CaO SiO 2 + CaO → основный оксид кислотный оксид соль Ca SiO 3 II II Если вы забыли формулу кислотного остатка
Пример 10 (тренировочный) Задание: составить уравнение возможной реакции Решение: Если вы забыли свойства оксидов Проверьте себя Следующий пример = → Если вы забыли формулу кислотного остатка Rb 2 O + CO 2 Rb 2 CO 3 I II кислотный оксид основный оксид соль
Примеры для самопроверки Проверьте себя д ) Li 2 O + CO 2 → Задание: составить уравнения возможных реакций б) Н 2 О + CaO → а) С O 2 + Ва (ОН) 2 → г) Н NO 3 + Mg О → ж) Н 2 О + HgO → в) SiO 2 + Н 2 О → з ) SO 3 + Н 2 О → е) SrO + Ca О → Если вы забыли свойства оксидов Если вы забыли формулу кислотного остатка
Проверьте себя в) SiO 2 + Н 2 О ≠ (исключение) б) Н 2 О + CaO = Са (ОН) 2 I II а) С O 2 + Ва (ОН) 2 = ВаС O 3 + Н 2 О II II г) 2 Н NO 3 + Mg О = Mg ( NO 3 ) 2 + Н 2 О I II кислотный оксид кислотный оксид основный оксид основный оксид щелочь щелочь соль соль вода вода вода вода кислота продолжение
Проверьте себя (продолжение) основный оксид кислота е) SrO + Ca О ≠ ж) Н 2 О + HgO ≠ з ) SO 3 + Н 2 О = Н 2 SO 4 вода кислотный оксид основный оксид кислотный оксид д ) Li 2 O + CO 2 = Li 2 CO 3 I II соль основный оксид основный оксид вода
При создании презентации был использован шаблон «Школьная доска» с сайта http://pedsovet.su/load/321-1-0-14033
Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

По теме: методические разработки, презентации и конспекты
Как выполнить задание вида «Расставить коэффициенты в схемах реакций» (8 класс)
Предлагаемая презентация может помочь восьмиклассникам, много пропускающим по болезни, научиться выполнять задания данного вида при изучении темы «Первоначальные химические понятия».
Как выполнить задание вида «С какими из перечисленных веществ реагирует данное вещество» (на примере темы «Химические свойства оснований», 8 класс)
Предлагаемая презентация может помочь школьникам, много пропускающим по болезни, научиться выполнять задания данного вида при изучении темы «Свойства оснований».
Как выполнить задание вида «Составить уравнения возможных реакций (на примере темы «Химические свойства оснований»)
Предлагаемая презентация с помощью анимационных эффектров и «подсказок» поможет восьмиклассникам закрепить умение выполнять задания данного вида при изучении темы «Химические свойства оснований». През.
Презентация к дистанционному уроку «Типы химических реакций на примере свойств воды». 8 класс
Презентация содержит слайды, характеризующие химические свойства воды.
Как выполнить задание вида «С какими из перечисленных веществ реагирует данное вещество» (на примере темы «Химические свойства оксидов», 8 класс)
Предлагаемая разработка может помочь учащимся, много пропускающим по болезни, научиться выполнять задания данного вида.
Урок химии в 8 классе «Типы химических реакций на примере свойств воды»
Урок химии в 8 классе по теме «Типы химичеких реакций на примере свойств воды» , напрвлен на обобщение и систематизацию знаний о классификации химичеких реакций.
Конспект урока по химии в 8 классе на тему: «Типы химических реакций на примере свойств воды (реакции разложения и соединения)»
Конспект урока на тему:«Типы химических реакций на примере свойств воды (реакции разложения и соединения)».
Видео:Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Тема урока: «Оксиды». 8-й класс
Разделы: Химия
Класс: 8
Тип урока: изучение нового материала, обобщение и систематизация знаний и умений.
Цель: ввести понятие об оксидах; познакомить с важнейшими неорганическими классами; рассмотреть состав, названия, классификацию и физические свойства оксидов.
Задачи:
- Образовательная. Обобщить и закрепить знания обучающихся о физических свойствах оксидов, их нахождении в природе, применении; закрепить умения записывать уравнения реакций, характеризующих химические свойства оксидов.
- Развивающая. Развивать творческие способности при решении нестандартных задач. Развивать логическое мышление. Формировать умение представления при изучении состава, строения и свойств оксидов.
- Воспитательная. Воспитывать бережное отношение к окружающей среде. Формировать интерес к предмету, внимательность, трудолюбие, любознательность, наблюдательность.
Оборудование: Схема: «Классификация оксидов», карточки-задания, тесты, таблица «Химические свойства оксидов», таблица «Формулы и названия некоторых оксидов, схема 3, общие способы получения оксидов, карточки с формулами оксидов.
Основные формы ведения урока: рассказ, беседа, работа с учебником (общеклассная, групповая и индивидуальная), вопрос – ответ.
План урока:
- Проверка домашнего задания.
- Изучение нового материала.
- Определение и название оксидов.
- Классификация оксидов.
- Физические свойства оксидов.
- Химические свойства оксидов.
- Важнейшие оксиды.
- Способы получения оксидов.
- Способы получения оксидов.
- Закрепление изученного материала
В начале урока, мотивируя учебную деятельность учащихся, учитель рассказывает, что им предстоит изучить оксиды – вещества, образующие минералы; и на доске записывает формулу этих веществ:
| SiO2 – кремнезёмы (IV), Al2O3 – корунд, CaO – негашеная известь, Fe2O3 – красный железняк (гематит), Fe3O4 – магнитный железняк (магнитит). |
Их получают путём горения или разложения сложных веществ. В них 2 элемента, один – кислород. Я отнесу к ним также известь и лёд. Какие это вещества? (Оксиды.)
Проверка домашнего задания
Сценка «Кто я»
Я у древних химиков самым главным веществом считалась. «Начало всех начал» – говорил греческий учёный Фале, живший в VI в. до н.э. и утверждавший, что окружающий мир возник из меня – «первичной материи». Я в древности считалась матерью жизни и смерти. Мне поклонялись, а по преданиям древней Руси, во мне жили русалки и водяные. У древних народов Азии в прошлом я служила причиной войн и борьбы. Являюсь важным двигателем, который не ломается, не ржавеет, не горит, не гниёт и ни кем не уничтожается. Кто я? (Вода)
К какому классу веществ относится вода?
Какие классы неорганических веществ вы знаете?
Какие соединения (вещества) называются кислотами?
Подчеркните синим мелом формулы кислот и дайте им названия.
Как классифицируют кислоты?
Назовите кислородсодержащие и бескислородные кислоты.
Какие соединения называют основаниями?
Подчеркните жёлтым мелом формулы оснований и назовите эти вещества.
Как классифицируют основания?
Пользуясь таблицей растворимости, выберите из данных формул растворимые и нерастворимые основания.
Подчеркните красным мелом формулы солей и дайте им названия.
Какие соединения называют солями?
Как классифицируют соли?
Изучение нового материала
Итак, ребята, в 8 классе на уроках химии мы подробно разбирали состав и свойства неорганических соединений различных классов. Целью сегодняшнего урока является изучение и обобщение нового материала по теме «Оксиды».
Обращаем внимание учащихся на то, что на доске остались неподчёркнутые формулы веществ, с которыми они ещё не знакомы. Это формулы оксидов.
Вопрос 1. Какой газ необходим для фотосинтеза и выделяется при выдохе?
Ответ: углекислый газ CO2 – оксид углерода – (IV).
Вопрос 2. В стихотворении А.А. Ахматовой упомянут металл:
На рукомойнике моём
Позеленела медь
Но так играет луч на нём
Что весело глядеть.
С каким соединением реагирует водород с образованием данного металла и воды?
Ответ: оксид меди – CuO – (II)
Оксиды – сложные вещества, состоящие из двух элементов, один из которых – кислород в степени окисления – 2 и валентности – (II).
Поскольку оксиды образуют почти все химические элементы, необходимо каждому оксиду дать своё название. Названия оксидов состоят из слова «оксид» и названия химического элемента в родительном падеже. Если элемент имеет переменную степень окисления (переменную валентность), то её указывают римскими цифрами, взятыми в скобки, после названия химического элемента.
Элементы с постоянной степенью окисления – металлы главных подгрупп I, II, III групп. Элементы с переменной степенью окисления – остальные металлы.
Таблица № 1. Формулы и названия некоторых оксидов
Упражнение «Не прерви цепочку»
Для каждого ученика приготовлена карточка с формулой оксида. Ученик показывает карточку классу и называет оксид. Работу класса учитель организует по цепочке.
Схема 1. Классификация оксидов
Учитель напоминает формулы различных веществ.
Знак, какого элемента, металла или неметалла находится на первом месте?
Кислотные оксиды, как правило, – оксиды неметаллов.
Почему эти оксиды называют кислотными?
Оксиды, которым соответствуют кислоты (независимо от того, реагируют ли они с водой или не реагируют), называют кислотными.
Впишите в «схему 1» пример кислотного оксида. Сначала назовите любой неметалл, кислоту, а затем – кислотный оксид.
Знак какого элемента, металла или неметалла находится на первом месте в формуле оксидов магния, калия?
Основными оксидами являются оксиды металлов. Если оксид бария взаимодействует с водой, то получается новое вещество Ba(OH)2 – основание.
Теперь становится понятным название «основной оксид».
Оксиды, которым соответствуют основания (независимо от того, реагируют ли они с водой или нет), называют основными.
Основные оксиды реагируют с кислотами, образуя соли.
Кислотные оксиды реагируют со щелочами, образуя соли.
Основные и кислотные оксиды относят к солеобразующим. Но есть оксиды, для которых соответствующие соли не существуют, их называют несолеобразующими или безразличными. Пример: оксид азота (II) – NO
Таким образом, можно сделать вывод, что неметаллы образуют кислотные оксиды (искл. – несолеобразующие оксиды: CO, NO, N2O, SiO )
Физические свойства оксидов
В рамках изучения физических свойств оксидов учащиеся самостоятельно работают с учебником.
Оксиды имеют различные физические свойства: оксиды бывают твёрдые, жидкие и газообразные, различного цвета.
Агрегатные состояния оксидов:
Химические свойства оксидов
Следует акцентировать внимание учащихся на правиле: оксид взаимодействует с водой, если образуется растворимый гидроксид.
Важнейшие оксиды. Оксиды широко распространены в природе. Некоторые оксиды постоянно окружают нас и находят широкое применение. Познакомимся с некоторыми из них.
Вода H2O – оксид водорода. Вода – это самой распространённоё и самое необходимое вещество на нашей планете. Без воды не было бы жизни на Земле. Всё живое нуждается в воде. Так, если без пищи человек может прожить 50 суток, то без воды смерть наступает через 5-7 дней. Вода является и важнейшей составной частью клеток животных и растений. Организм человека на 65-70 % состоит из воды, а у некоторых медуз – до 99 % массы тела составляет вода. Содержание воды в огурцах и арбузах превышает 90 %. Велики затраты воды в сельском хозяйстве. Для того чтобы вырастить 1 т. пшеницы, требуется 1500 т. воды, 1 т. риса – 7000 т. воды. Общие запасы воды на Земле – огромны и составляют 138,6 млн. км 3 . Вода покрывает почти 3/4 поверхности земного шара.
Углекислый газ СО2 – оксид углерода (IV).
Около 0,03 % по объёму углекислый газ содержится в воздухе. В природе он образуется при гниении растительных и животных останков, дыхании, сжигании топлива, в больших количествах выделяется из вулканических трещин и вод минеральных источников.
При обычных условиях диоксид углерода бесцветен, не имеет запаха. Углекислый газ значительно тяжелее воздуха. Углекислый газ применяют при изготовлении шипучих напитков, в медицине – углекислотные ванны. «Сухой лёд» применяется для хранения скоропортящихся пищевых продуктов, для производства и хранения мороженого. Углекислый газ не горит и не поддерживает горение, поэтому его применяют для тушения пожаров.
Оксид кремния (IV) SiO2 в виде песка применяется в строительстве, в производстве стекла, керамики, цемента.
Некоторые оксиды (оксид серы (IV), оксид азота и др.) образуются в промышленном производстве. В больших количествах эти оксиды попадают в атмосферу, где парами воды образуют кислоты, и выпадают в виде так называемых кислотных дождей. Кислотные дожди наносят огромный вред окружающей среде, поэтому необходимо принимать меры, способствующие снижению попадания оксидов в атмосферу.
1) при горении простых и сложных веществ;
2) при разложении сложных веществ – нерастворимых оснований, кислот, солей (схема 4)
Закрепление полученного материала
С каким классом неорганических веществ вы сегодня познакомились?
Почему они имеют такое название?
Классификация оксидов.
Какими физическими свойствами обладают оксиды?
Какими химическими свойствами обладают оксиды?
Общие способы получения оксидов?
Назовите важнейшие оксиды.
Заканчиваем урок подведением итогов, выставляем отметки и предлагаем домашнее задание.
Литература:
1. / Неорганическая химия 7 – 10 класс, Москва «Просвещение 1980 г.» С.А. Балязин, Н.Г. Ключников, В.С. Полосин, § 19, стр. 25, § 26 – 29 стр. 31 – 36, § 44, стр. 53. /
2. / Химия 10 – 12 класс, Москва «Просвещение 1989 г.» Г.Е. Рудзитис, Ф.Г. Фельдман, § 1, стр. 43. /
3. / Химия 8 класс, Москва «Оникс 21 век 2003», И.И. Новошинский, Н.С. Новошинская, § 26 стр. 83, § 45, стр. 169 – 174. /
3. / Химия в школе № 2, 2010 г., стр. 30 – 33. /
4. / Химия в школе № 7, 2012 г., стр. 24 – 25. /
6. / Химия. Первое сентября № 18, 16 – 31 сентября 2009 г., стр. 30 – 41. /
🔍 Видео
Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Оксиды. Химические свойства. 8 класс.Скачать

Получение и химические свойства ОКСИДОВ 8 класс | ПРИНЦИП составления реакций с участием оксидовСкачать

Решение задач на термохимические уравнения. 8 класс.Скачать

Химические уравнения. СЕКРЕТНЫЙ СПОСОБ: Как составлять химические уравнения? Химия 8 классСкачать

Оксиды. 1 часть. 8 класс.Скачать
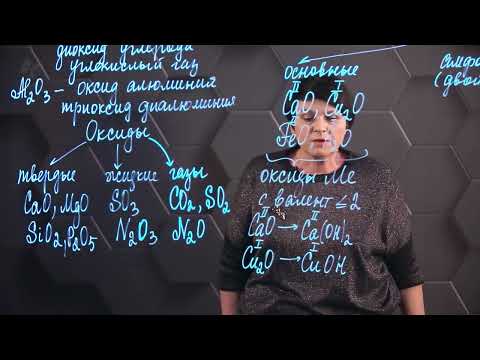
8 класс химические свойства оксидов, оснований, кислот, солей и ионные уравненияСкачать

8 класс. Составление уравнений химических реакций.Скачать

ВСЯ ХИМИЯ С НУЛЯ! | Денис Марков | УмскулСкачать

Расстановка Коэффициентов в Химических Реакциях // Подготовка к ЕГЭ по ХимииСкачать

8 класс.Основные оксиды.Скачать

КИСЛОТЫ В ХИМИИ — Химические Свойства Кислот. Реакция Кислот с Основаниями, Оксидами и МеталламиСкачать

Химические уравнения - Как составлять уравнения реакций // Составление Уравнений Химических РеакцийСкачать

Химия 8 класс (Урок№15 - Оксиды: классификация, номенклатура.)Скачать

ОСНОВАНИЯ В ХИМИИ — Химические свойства оснований. Реакции оснований с кислотами и солямиСкачать