- Оксид железа (III)
- Способы получения
- Химические свойства
- Реакция взаимодействия оксида железа(III) и оксида углерода(II)
- Fe2O3 + 3CO 2Fe + 3CO2
- Реакция взаимодействия оксида железа (III) и оксида углерода (II)
- Реакция взаимодействия оксида железа (III) и оксида углерода (II)
- Реакция взаимодействия азотной кислоты и оксида цинка
- Реакция взаимодействия оксида теллура (VI) и оксида серебра (I)
- Реакция взаимодействия свинца и теллура
- Выбрать язык
- Разделы
- ТОП 5 записей
- Популярные записи
- Элементы, реакции, вещества
- Предупреждение.
- 🎦 Видео
Оксид железа (III)
Оксид железа (III) – это твердое, нерастворимое в воде вещество красно-коричневого цвета.
Способы получения
Оксид железа (III) можно получить различными методами :
1. Окисление оксида железа (II) кислородом.
2. Разложение гидроксида железа (III) при нагревании :
Химические свойства
Оксид железа (III) – амфотерный .
1. При взаимодействии оксида железа (III) с кислотными оксидами и кислотами образуются соли.
Например , оксид железа (III) взаимодействует с азотной кислотой:
2. Оксид железа (III) взаимодействует с щелочами и основными оксидами. Реакция протекает в расплаве, при этом образуется соответствующая соль (феррит) .
Например , оксид железа (III) взаимодействует с гидроксидом натрия:
3. Оксид железа (III) не взаимодействует с водой.
4. Оксид железа (III) окисляется сильными окислителями до соединений железа (VI).
Например , хлорат калия в щелочной среде окисляет оксид железа (III) до феррата:
Нитраты и нитриты в щелочной среде также окисляют оксид железа (III):
5. Оксид железа (III) проявляет окислительные свойства . Но есть интересный нюанс — при восстановлении оксида железа (III), как правило, образуется смесь продуктов: это может быть оксид железа (II), просто вещество железо, или железная окалина Fe3O4. Но в реакции мы записываем при этом только один продукт. А вот какой именно это будет продукт, зависит от условий реакции. Как правило, в экзаменах по химии нам даются указания на возможный продукт (цвет образовавшегося вещества или дальнейшие характерные реакции).
Например , оксид железа (III) реагирует с угарным газом при нагревании. При этом возможно восстановление как до простого железа, так и до оксида железа (II) или железной окалины:
При восстановлении оксида железа (III) водородом также возможно образование различных продуктов, например, простого железа:
Железом можно восстановить оксид железа только до оксида железа (II):
Оксид железа (III) реагирует с более активными металлами .
Например , с алюминием (алюмотермия):
Оксид железа (III) реагирует также с некоторыми другими сильными восстановителями.
Например , с гидридом натрия:
Fe2O3 + 3NaH → 3NaOH + 2Fe
6. Оксид железа (III) – твердый, нелетучий и амфотерный. А следовательно, он вытесняет более летучие оксиды (как правило, углекислый газ) из солей при сплавлении.
Например , из карбоната натрия:
Видео:Качественная реакция на углекислый газ.Скачать

Реакция взаимодействия оксида железа(III) и оксида углерода(II)
Видео:Химия 9 класс (Урок№18 - Угарный газ. Углекислый газ.)Скачать

Fe2O3 + 3CO  2Fe + 3CO2
2Fe + 3CO2
Реакция взаимодействия оксида железа(III) и оксида углерода(II) с образованием железа и оксида углерода(IV). Реакция протекает при температуре около 700°C.
Метод получения чугуна восстановлением руд железа в доменных печах.
- Fe2O3 + 3CO = 2Fe + 3CO2, ΔG1000 = -42 кДж.
Видео:Качественная реакция на углекислый газСкачать

Реакция взаимодействия оксида железа (III) и оксида углерода (II)
Видео:Получение Диоксоферрата Натрия. Реакция Оксида Железа и Гидроксида Натрия.Скачать

Реакция взаимодействия оксида железа (III) и оксида углерода (II)
Уравнение реакции взаимодействия оксида железа (III) и оксида углерода (II):
Реакция взаимодействия оксида железа (III) и оксида углерода (II).
В результате реакции образуются оксид железа (II) и оксид углерода (IV).
Реакция протекает при условии: при температуре 500-600 °C.
Формула поиска по сайту: Fe2O3 + CO → 2FeO + CO2.
Реакция взаимодействия азотной кислоты и оксида цинка
Реакция взаимодействия оксида теллура (VI) и оксида серебра (I)
Реакция взаимодействия свинца и теллура
Выбрать язык
Разделы
ТОП 5 записей
Популярные записи
Элементы, реакции, вещества
Предупреждение.
Все химические реакции и вся информация на сайте предназначены для использования исключительно в учебных целях — только для решения письменных, учебных задач. Мы не несем ответственность за проведение вами химических реакций.
Химические реакции и информация на сайте
не предназначены для проведения химических и лабораторных опытов и работ.
🎦 Видео
Процесс получения Fe2O3. Оксид железа |||.Скачать

ОКСИДЫ ХИМИЯ — Что такое Оксиды? Химические свойства Оксидов | Реакция ОксидовСкачать

Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Получение и превращения гидроксидов железа Fe(OH)2 и Fe(OH)3Скачать

Химия. ЦТ 2015. В10. Восстановление оксида железа углеродом.Скачать

Опыты по химии. Получение гидроксида железа (III) и изучение его свойствСкачать

Взаимодействие алюминия с оксидом железа (III)Скачать

Углекислый газСкачать

Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Расчеты по 2 параллельным уравнениям реакцийСкачать

Оксид углерода(IV). Углекислый газ. Состав и строение молекулы. Получение. Свойства и применениеСкачать

ТИПОВЫЕ ЗАДАЧИ ПО ХИМИИ: Химическое Количество Вещества, Моль, Молярная Масса и Молярный ОбъемСкачать

Химия. Оксиды углеродаСкачать

Оксиды. Получение оксидов. Урок 9. Химия 8 классСкачать

Свойства соединений железа. 9 классСкачать

9 и 11 классы. Железо. Часть 2.Скачать


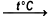 2Fe + 3CO2
2Fe + 3CO2