- Оксид меди (II)
- Способы получения оксида меди (II)
- Химические свойства оксида меди (II)
- Оксид меди (I)
- Содержание
- Нахождение в природе
- Физические свойства
- Химические свойства
- Реакции в водных растворах
- Реакции при высоких температурах
- Прочие реакции
- Получение
- Применение
- Токсичность
- Оксид меди (I, II, III): свойства, получение, применение
- Оксид меди (I)
- Оксид меди (II)
- Оксид меди (III)
- Заключение
- 🌟 Видео
Оксид меди (II)
Оксид меди (II) CuO – твердое кристаллическое вещество черного цвета.
Способы получения оксида меди (II)
Оксид меди (II) можно получить различными методами :
1. Термическим разложением гидроксида меди (II) при 200°С :
2. В лаборатории оксид меди (II) получают окислением меди при нагревании на воздухе при 400–500°С:
2Cu + O2 → 2CuO
3. В лаборатории оксид меди (II) также получают прокаливанием солей (CuOH)2CO3, Cu(NO3)2:
Химические свойства оксида меди (II)
Оксид меди (II) – основный оксид (при этом у него есть слабо выраженные амфотерные свойства) . При этом он является довольно сильным окислителем.
1. При взаимодействии оксида меди (II) с сильными и растворимыми кислотами образуются соли.
Например , оксид меди (II) взаимодействует с соляной кислотой:
СuO + 2HBr = CuBr2 + H2O
CuO + 2HCl = CuCl2 + H2O
2. Оксид меди (II) вступает в реакцию с кислотными оксидами.
Например , оксид меди (II) взаимодействует с оксидом серы (VI) с образованием сульфата меди (II):
3. Оксид меди (II) не взаимодействует с водой.
4. В окислительно-восстановительных реакциях соединения меди (II) проявляют окислительные свойства:
Например , оксид меди (II) окисляет аммиак :
3CuO + 2NH3 → 3Cu + N2 + 3H2O
Оксид меди (II) можно восстановить углеродом, водородом или угарным газом при нагревании:
СuO + C → Cu + CO
Более активные металлы вытесняют медь из оксида.
Например , алюминий восстанавливает оксид меди (II):
3CuO + 2Al = 3Cu + Al2O3
Видео:Взаимодействие оксида меди с серной кислотойСкачать

Оксид меди (I)
| Оксид меди (I) | |
|---|---|
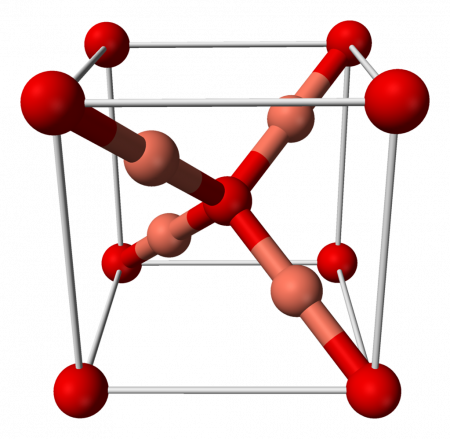 | |
| Традиционные названия | Закись меди, гемиоксид меди, оксид димеди |
| Хим. формула | Cu2O |
| Рац. формула | Cu2O |
| Внешний вид | Коричнево-красные кристаллы |
| Молярная масса | 143,09 г/моль |
| Плотность | 6,1 г/см³ |
| Твёрдость | 3,5 — 4 |
| Энтальпия | |
| • плавления | +64,22 кДж/моль |
| Растворимость | |
| • в воде | 2,4⋅10 −7 г/100 мл |
| Показатель преломления | 2,85 |
| Кристаллическая структура | кубическая |
| Рег. номер CAS | 1317-39-1 |
| PubChem | 10313194 |
| Рег. номер EINECS | 215-270-7 |
| SMILES | |
| RTECS | GL8050000 |
| ChEBI | 81908 |
| ChemSpider | 8488659 |
| ЛД50 | 470 мг/кг |
| Токсичность | средняя |
| Пиктограммы СГС |   |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Оксид меди (I) (гемиоксид меди, окси́д димеди, устар. закись меди) — химическое соединение с формулой Cu2O . Соединение меди с кислородом, основный оксид. Кристаллическое вещество коричнево-красного цвета. В природе встречается в виде минерала куприта.
Видео:Реакции металлов с кислородом и водой. 8 класс.Скачать

Содержание
- 1 Нахождение в природе
- 2 Физические свойства
- 3 Химические свойства
- 3.1 Реакции в водных растворах
- 3.2 Реакции при высоких температурах
- 3.3 Прочие реакции
- 4 Получение
- 5 Применение
- 6 Токсичность
Видео:Опыты по химии. Взаимодействие водорода с оксидом меди (II)Скачать

Нахождение в природе
Оксид меди (I) встречается в природе в виде минерала куприта (устаревшие названия: красная медная руда, стекловатая медная руда, рубиновая медь). Цвет минерала красный, коричнево-красный, пурпурно-красный или чёрный. Твёрдость по шкале Мооса 3,5 — 4.
Разновидность куприта с удлиненными нитевидными кристаллами называется халькотрихит (устаревшее название: плюшевая медная руда). Кирпично-красная смесь куприта с лимонитом носит название «черепичная руда».
Видео:Взаимодействие оксида меди с водородом (CuO + H2 = H2O + Cu)Скачать

Физические свойства
Оксид меди (I) при нормальных условиях — твёрдое вещество коричнево-красного цвета нерастворимое в воде и этаноле. Плавится без разложения при 1242 °C.
Оксид меди (I) имеет кубическую сингонию кристаллической решётки, пространственная группа P n3m, a = 0,4270 нм, Z = 2.
Видео:ОКСИДЫ ХИМИЯ — Что такое Оксиды? Химические свойства Оксидов | Реакция ОксидовСкачать

Химические свойства
Реакции в водных растворах
Оксид меди (I) не реагирует с водой. В очень малой степени (ПР = 1,2⋅10 −15 ) диссоциирует:
Оксид меди (I) переводится в раствор:
- концентрированной соляной кислотой
Cu2O + 4HCl ⟶ 2H[CuCl2] + H2O
- концентрированной щёлочью (частично)
Cu2O + 2OH − + H2O ⇄ 2[Cu(OH)2] −
- концентрированным гидратом аммиака и концентрированными растворами солей аммония
Cu2O + 4(NH3 ⋅ H2O) ⟶ 2[Cu(NH3)2]OH + 3H2O Cu2O + 2NH4 + ⟶ 2[Cu(H2O)(NH3)] +
- путём окисления до солей меди (II) различными окислителями (например, концентрированными азотной и серной кислотами, кислородом в разбавленной соляной кислоте)
Cu2O + 6HNO3 ⟶ 2Cu(NO3)2 + 2NO2↑ + 3H2O Cu2O + 3H2SO4 ⟶ 2CuSO4 + SO2↑ + 3H2O 2 Cu2O + 8HCl + O2 ⟶ 4CuCl2 + 4H2O
Также оксид меди (I) вступает в водных растворах в следующие реакции:
- медленно окисляется кислородом до гидроксида меди (II)
2 Cu2O + 4H2O + O2 ⟶ 4Cu(OH)2↓
- реагирует с разбавленными галогенводородными кислотами с образованием соответствующих галогенидов меди (I):
Cu2O + 2HHal ⟶ 2CuHal↓ + H2O (Hal = Cl, Br, I)
- в разбавленной серной кислоте дисмутирует на сульфат меди (II) и металлическую медь
Cu2O + H2SO4 ⟶ CuSO4 + Cu↓ + H2O
- восстанавливается до металлической меди типичными восстановителями, например гидросульфитом натрия в концентрированном растворе
2 Cu2O + 2NaHSO3 ⟶ 4Cu↓ + Na2SO4 + H2SO4
Реакции при высоких температурах
Оксид меди (I) восстанавливается до металлической меди в следующих реакциях:
- при нагревании до 1800 °C (разложение)
2 Cu2O → 1800∘C 4Cu + O2
- при нагревании в токе водорода, монооксида углерода, с алюминием
Cu2O + H2 → >250∘C 2Cu + H2O Cu2O + CO → 250−300∘C 2Cu + CO2 3 Cu2O + 2Al → 1000∘C 6Cu + Al2O3
- при нагревании с серой
2 Cu2O + 3S → >600∘C 2Cu2S + SO2 2 Cu2O + Cu2S → 1200−1300∘C 6Cu + SO2
Оксид меди (I) может быть окислен до соединений меди (II) в токе кислорода или хлора:
Также, при высоких температурах оксид меди (I) реагирует:
- с аммиаком (образуется нитрид меди (I) )
3 Cu2O + 2NH3 → 250∘C 2Cu3N + 3H2O
- c оксидами щелочных металлов и бария (образуются двойные оксиды)
Cu2O + M2O → 600−800∘C 2MCuO Cu2O + BaO → 500−600∘C BaCu2O2
Прочие реакции
Оксид меди (I) реагирует с азидоводородом:
- при охлаждении выпадает осадок азида меди (II)
Cu2O + 5HN3 → 10−15∘C 2Cu(N3)2↓ + H2O + NH3↑ + N2↑
- при комнатной температуре в токе азидоводородной кислоты выпадает осадок азида меди (I)
Cu2O + 2HN3 → 20−25∘C 2CuN3↓ + H2O
Видео:Восстановление меди водородом из оксида меди (II)Скачать

Получение
Оксид меди (I) может быть получен:
- нагреванием металлической меди при недостатке кислорода
4Cu + O2 → >200∘C 2 Cu2O
- нагреванием металлической меди в токе оксида азота (I) или оксида азота (II)
2Cu + N2O → 500−600∘C Cu2O + N2 4Cu + 2NO → 500−600∘C 2 Cu2O + N2
- нагреванием металлической меди с оксидом меди (II)
Cu + CuO → 1000−1200∘C Cu2O
- термическим разложением оксида меди (II)
4CuO → 1026−1100∘C 2 Cu2O + O2
- нагреванием сульфида меди (I) в токе кислорода
2Cu2S + 3O2 → 1200−1300∘C 2 Cu2O + 2SO2
В лабораторных условиях оксид меди (I) может быть получен восстановлением гидроксида меди (II) (например, гидразином):
Также, оксид меди(I) образуется в реакциях ионного обмена солей меди (I) с щелочами, например:
- в реакции йодида меди (I) с горячим концентрированным раствором гидроксида калия
2CuI + 2KOH ⟶ Cu2O ↓ + 2KI + H2O
- в реакции дихлорокупрата (I) водорода с разбавленным раствором гидроксида натрия
2H[CuCl2] + 4NaOH ⟶ Cu2O ↓ + 4NaCl + 3H2O
В двух последних реакциях не образуется соединения с составом, соответствующим формуле CuOH (гидроксид меди (I) ). Образование оксида меди (I) происходит через промежуточную гидратную форму переменного состава Cu2O ⋅ xH2O .
- Окисление альдегидов гидроксидом меди (II). Если к голубому осадку гидроксида меди (II) прилить раствор альдегида и смесь нагреть , то сначала появляется жёлтый осадок гидроксида меди (I):
R−CHO + 2Cu(OH)2 → t R−COOH + 2CuOH↓ + H2O при дальнейшем нагревании желтого осадка гидроксида меди (I) превращается в красный оксид меди (I): 2CuOH → t Cu2O + H2O
Видео:6 Восстановление оксида меди водородомСкачать

Применение
Оксид меди (I) применяется как пигмент для окрашивания стекла, керамики, глазурей; как компонент красок, защищающих подводную часть судна от обрастания; в качестве фунгицида.
Обладает полупроводниковыми свойствами, используется в меднозакисных вентилях.
Видео:Реакция обмена между оксидом меди (II) и серной кислотойСкачать

Токсичность
Оксид меди (I) — умеренно токсичное вещество: LD50 470 мг/кг (для крыс перорально). Вызывает раздражение глаз, может вызывать раздражение кожи и дыхательных путей.
Очень токсично для водной среды: LC50 для Daphnia magna составляет 0,5 мг/л в течение 48 ч.
Видео:Взаимодействие уксусной кислоты с оксидом меди (II)Скачать

Оксид меди (I, II, III): свойства, получение, применение
Как вам известно, в химии существует четыре класса неорганических соединений. Веществ, представляющих каждый из них, очень много, но лидирующее положение, несомненно, занимают оксиды. У одного химического элемента может быть сразу несколько разных бинарных соединений с кислородом. Такое свойство имеет и медь. У нее существует три оксида. Давайте рассмотрим их детальнее.
Оксид меди (I)
Его формула — Cu2O. В некоторых источниках данное соединение могут называть гемиоксидом меди, оксидом димеди или закисью меди.
Свойства
Является кристаллическим веществом, имеющим коричнево-красный цвет. Этот оксид не растворяется в воде и этиловом спирте. Может плавиться, не разлагаясь, при температуре чуть больше 1240 о С. Данное вещество не взаимодействует с водой, но может переводиться в раствор, если участниками реакции с ним будут концентрированные хлоровородная кислота, щелочь, азотная кислота, гидрат аммиака, соли аммония, серная кислота.
Получение оксида меди (I)
Его можно получить, нагрев металлическую медь, или в такой среде, где кислород имеет малую концентрацию, а также в токе некоторых оксидов азота и вместе с оксидом меди (II). Кроме того, он может стать продуктом реакции термического разложения последнего. Оксид меди (I) получится и в том случае, если нагреть сульфид меди (I) в токе кислорода. Есть и другие, более сложные способы его получения (например, восстановление одного из гидроксидов меди, ионный обмен любой соли одновалентной меди с щелочью и т.п.), но их практикуют только в лабораториях.
Применение
Нужен в качестве пигмента, когда окрашивают керамику, стекло; компонента красок, которые защищают подводную часть судна от обрастания. Используется также как фунгицид. Без него не обходятся и меднозакисные вентили.
Оксид меди (II)
Его формула — CuO. Во многих источниках может встречаться под названием окиси меди.
Свойства
Это высший оксид меди. Вещество имеет вид черных кристаллов, которые почти не растворяются в воде. Взаимодействует с кислотой и при этой реакции образует соответствующую соль двухвалентной меди, а также воду. При его сплавлении с щелочью продукты реакции представлены купратами. Разложение оксида меди (II) происходит при температуре около 1100 о С. Аммиак, монооксид углерода, водород и уголь способны извлекать из этого соединения металлическую медь.
Получение
Его можно получить при нагревании металлической меди в воздушной среде при одном условии — температура нагревания должна быть ниже 1100 о С. Также оксид меди (II) может получиться, если нагреть карбонат, нитрат, двухвалентный гидроксид меди.
Применение
С помощью данного оксида окрашивают в зеленый или синий цвет эмаль и стекло, а также производят медно-рубиновую разновидность последнего. В лаборатории этим оксидом обнаруживают восстановительные свойства веществ.
Оксид меди (III)
Его формула — Cu2O3. Имеет традиционное название, которое звучит, наверное, немного необычно — окисел медь.
Свойства
Имеет вид красных кристаллов, не растворяющихся в воде. Разложение этого вещества происходит при температуре 400 о С, продукты данной реакции — оксид меди (II) и кислород.
Получение
Его можно получить, окисляя двухвалентный гидроксид меди с помощью пероксидисульфата калия. Необходимое условие реакции — щелочная среда, в которой она должна происходить.
Применение
Данное вещество само по себе не используется. В науке и промышленности более широкое распространение находят продукты его разложения — оксид меди (II) и кислород.
Заключение
Вот и все оксиды меди. Их несколько из-за того, что медь имеет переменную валентность. Существуют и другие элементы, у которых есть по несколько оксидов, но о них поговорим в другой раз.
🌟 Видео
8 класс. Химия. Как получить оксид меди (ll).Скачать

Химия. 8 класс. Реакции металлов с кислородом /09.10.2020/Скачать

41. ЖелезоСкачать

Качественная реакция на оксид медиСкачать

Окисление этанола оксидом меди (II). Опыт 3Скачать

оксид меди + соляная кислотаСкачать

Опыты по химии. Взаимодействие угля и оксида меди (II)Скачать

Восстановление оксида меди водородомСкачать

Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Реакция оксида меди(II) со спиртом.Скачать

Взаимодействие уксусной кислоты с оксидом медиСкачать





