Оксид кремния (IV)
Физические свойства и нахождение в природе
Оксид кремния (IV) SiO2 – это твердое вещество с атомной кристаллической решеткой. В природе встречается в виде кварца, речного песка, кремнезема и прочих модификаций:
Химические свойства
Оксид кремния (IV) – типичный кислотный оксид . За счет кремния со степенью окисления +4 проявляет слабые окислительные свойства.
1. Как кислотный оксид, диоксид кремния (IV) взаимодействует с растворами и расплавами щелочей и в расплаве с основными оксидами . При этом образуются силикаты.
Например , диоксид кремния взаимодействует с гидроксидом калия:
Еще пример : диоксид кремния взаимодействует с оксидом кальция.
SiO2 + CaO → CaSiO3
2. Оксид кремния (IV) не взаимодействует с водой , т.к. кремниевая кислота нерастворима .
3. Оксид кремния (IV) реагирует при сплавлении с карбонатами щелочных металлов . При этом работает правило: менее летучий оксид вытесняет более летучий оксид из солей при сплавлении.
Например , оксид кремния (IV) взаимодействует с карбонатом калия. При этом образуется силикат калия и углекислый газ:
4. Из кислот диоксид кремния реагирует только с плавиковой или с газообразным фтороводородом:
5. При температуре выше 1000 °С оксид кремния реагирует с активными металлами, при этом образуется кремний.
Например , оксид кремния взаимодействует с магнием с образованием кремния и оксида магния:
SiO2 + 2Mg → Si + 2MgO
Видеоопыт взаимодействия оксида кремния (IV) с магнием можно посмотреть здесь.
При избытке восстановителя образуются силициды:
SiO2 + 4Mg → Mg2Si + 2MgO
6. Оксид кремния (IV) взаимодействует с неметаллами.
Например , оксид кремния (IV) реагирует с водородом в жестких условиях. При этом оксид кремния проявляет окислительные свойства:
Еще пример : оксид кремния взаимодействует с углеродом. При этом образуется карборунд и угарный газ:
SiO2 + 3С → SiС + 2СО
При сплавлении оксид кремния взаимодействует с фосфатом кальция и углем:
Видео:Реакции металлов с кислородом и водой. 8 класс.Скачать

Кремний
Кремний — неметаллический элемент IVa группы периодической таблицы Д.И. Менделеева. Второй после кислорода элемент по распространенности в земной коре.
В чистом виде в природе практически отсутствует. Чаще всего встречается в виде кремнезема — SiO2 — песок, песчаник, кварц, глина.
Кремниевая (силиконовая) долина
Регион в штате Калифорния (США), отличающийся большой плотностью высоко технологичных компаний, связанных с производством компьютеров и микропроцессоров.
Кремний является природным полупроводником, используется как основной материал для производства микросхем. Кремний ближе, чем вы думаете: внутри гаджета, которым вы пользуетесь 😉
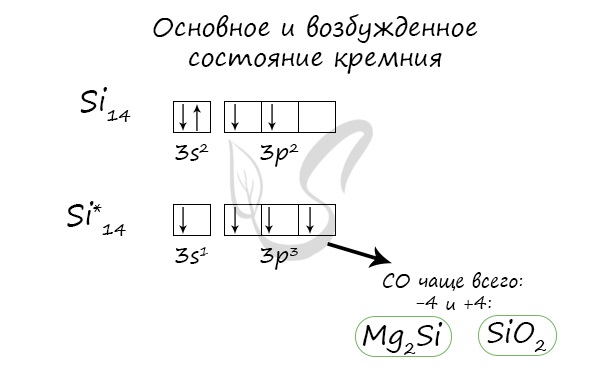
Основное и возбужденное состояние кремния
При возбуждении атома кремния электроны на s-подуровне распариваются и один из них переходит на p-подуровень.
Природные соединения
В природе кремний встречается в виде следующих соединений:
- SiO2 — кварц, кремнезем, гранит, песчаник, песок, глина
- SiO2 с примесью Fe 3+ — цитрин
- SiO2 с примесью Fe 2+ и Fe 3+ — аметист
Получение
В промышленности кремний получают путем восстановления кремнезема в электрических печах, алюминотермией.
В лабораторных условиях мелкий белый песок прокаливают с магнием:
SiO2 + Mg → (t) MgO + Si
Химические свойства
- Реакции с неметаллами
При обычных условиях без нагревания кремний реагирует только со фтором.
При нагревании кремний вступает в реакции с остальными галогенами (Cl, Br, I), углеродом, кислородом. При очень высоких температурах (1200 °C) кремний с кислородом образует оксид кремния II — несолеобразующий оксид.
Si + O2 → (t = 1200 °C) SiO
В подобных реакциях кремния проявляет свои окислительные способности.
Ca + Si → Ca2Si (силицид кальция)
Реакция с щелочами
С целью травления (удаления поверхностного слоя материала) кремниевые изделия можно погружать в раствор щелочи.
Оксид кремния IV — SiO2
Оксид кремния IV имеет атомное строение, обладает высокой прочностью и твердостью. Плавится при температуре +1730 °C градусов.
В промышленности оксид кремния IV получают нагреванием кремния в атмосфере кислорода.
В лабораторных условиях проводят реакция силиката натрия с уксусной кислотой. Кремниевая кислота сразу же распадается на SiO2, который выпадает в осадок, и воду.
- Реакции с кислотами
Химически SiO2 устойчив к действию кислот, однако вступает в реакцию с газообразным фтороводородом (газом) и плавиковой кислотой (жидкостью).
Реакции с основными оксидами и щелочами
SiO2 является кислотным оксидом, соответствует кремниевой кислоте. Вступая в реакции с основными оксидами и щелочами, образует соли данной кислоты — силикаты.
Так как чаще всего кислотные оксиды с солями не реагируют, тем более необычной кажется реакция оксида кремния IV с карбонатами.
Кремниевая кислота
Слабая, малорастворимая в воде кислота. Ее соли носят название — силикаты.
Поскольку кремниевая кислота малорастворима, то банальной реакцией SiO2 с водой ее не получить. Эту задачу решают в две стадии через ее соли — силикаты.
Кремниевая кислота слабая, нестойкая, легко распадается на воду и оксид кремния IV.
© Беллевич Юрий Сергеевич 2018-2022
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Оксид кремния

Средняя оценка: 4.5
Всего получено оценок: 83.
Средняя оценка: 4.5
Всего получено оценок: 83.
Кремний проявляет переменную валентность (II, IV), поэтому может образовывать два оксида кремния – монооксид и диоксид. Они отличаются физическими и химическими свойствами. Подробнее об оксидах кремния говорим в этой статье.
Видео:ОКСИДЫ ХИМИЯ — Что такое Оксиды? Химические свойства Оксидов | Реакция ОксидовСкачать

Монооксид
Формула оксид кремния (II) – SiO. Это вязкое, похожее на смолу вещество. Сохраняет аморфное состояние и не окисляется при обычных условиях. Не образует соли, не проводит электричество.

Монооксид получают двумя способами:
- нагреванием (температура выше 400°C) кремния при недостатке кислорода:
В твёрдом состоянии монооксид представляет собой тёмно-коричневый порошок. Проявляет прочность и инертность в реакциях с кислотами. Растворим в плавиковой кислоте.
Химические свойства монооксида кремния:
- разлагается при нагревании:
Монооксид не встречается на Земле в естественной среде. Однако газообразный монооксид входит в состав межзвёздных пылевых облаков.
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Диоксид
Оксид кремния (IV) – SiO2. Это твёрдое кристаллическое тугоплавкое вещество, нерастворимое в воде. Не проводит электрический ток.
Формулу диоксида имеют песок, кварц, горный хрусталь, яшма, агат, аметист и другие горные породы. Диоксид входит в состав 87 % литосферы.
Диоксид кремния имеет немолекулярное строение. Кристаллическая решётка состоит из атомов кремния и кислорода, связанных ковалентными связями. К каждому атому кремния присоединено четыре атома кислорода, а каждый атом кислорода связан с двумя атомами кремния.
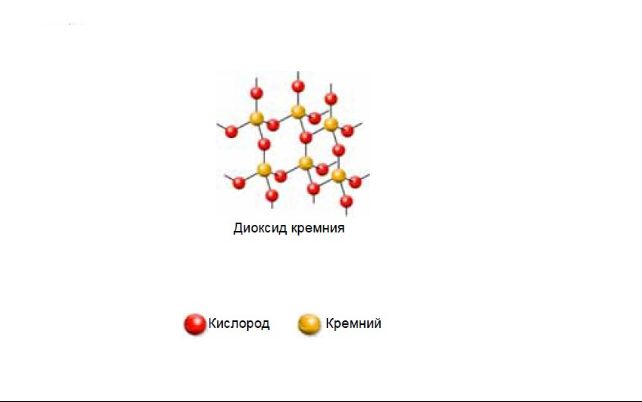
Диоксид можно получить в лаборатории, нагрев кремний до 400-500°C в присутствии кислорода:
Диоксид образуется при действии кислот на растворимые силикаты. В результате образующаяся кремниевая кислота распадается на воду и диоксид:
При нормальных условиях реагирует только с плавиковой кислотой. Со щелочами и основными оксидами реагирует при нагревании. Не реагирует с водой. Основные свойства с химическими уравнениями представлены в таблице.
Взаимодействие
Описание
Уравнение
Реагирует с водородом и углеродом с образованием кремния и карборунда соответственно
– SiO2 + 3С → SiC + 2CO
С активными металлами
Реагирует при температуре выше 1000°С с образованием кремния. При избытке металла образуются силициды
– SiO2 + 2Mg → Si + 2MgO;
Реагирует с газом и плавиковой кислотой при нормальных условиях
Сплавляется с образованием силикатов
Реагирует при высоких температурах
С карбонатами щелочных металлов
Взаимодействует при нагревании
Диоксид кремния используется для производства стекла, силикагеля, бетона.
Видео:Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Что мы узнали?
Кремний образует два оксида – монооксид и диоксид. Монооксид – аморфное вещество, не образующее соли. Взаимодействует при нагревании с водяным паром, углекислым газом, хлором. Разлагается на простые вещества при нагревании. Диоксид – песок и его производные. Это кристаллическое вещество с немолекулярным строением. Не реагирует с водой, кислотами (исключение – плавиковая кислота). Взаимодействует с неметаллами, металлами, фтороводородом, щелочами, оксидами, карбонатами. Оксиды кремния – диэлектрики.
📹 Видео
Кислотный оксид + вода = ??? Основной оксид + вода = ???Скачать

Химия 9 класс: Оксид кремнияСкачать

Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

оксид кремния 4 ( формула )Скачать

8 класс. Составление уравнений химических реакций.Скачать

Проклятая химическая реакция 😜 #shortsСкачать

Типы Химических Реакций — Химия // Урок Химии 8 КлассСкачать

Химические свойства воды/часть 1/химия 8 классСкачать

8 класс. ОВР. Окислительно-восстановительные реакции.Скачать

ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Оксиды. Химические свойства. 8 класс.Скачать

Химия 9 класс (Урок№20 - Кремний и его соединения. Стекло. Цемент.)Скачать

оксид кремнияСкачать

ОКСИДЫ, КИСЛОТЫ, СОЛИ И ОСНОВАНИЯ ХИМИЯ 8 класс / Подготовка к ЕГЭ по Химии - INTENSIVСкачать