- Реакция взаимодействия оксида калия и воды
- Реакция взаимодействия алюминия и хлороводорода
- Реакция взаимодействия хлорида германия (II) и гидроксида натрия
- Реакция взаимодействия селенида натрия и азотной кислоты
- Выбрать язык
- Разделы
- ТОП 5 записей
- Популярные записи
- Элементы, реакции, вещества
- Предупреждение.
- Оксид калия: способы получения и химические свойства
- Способ получения
- Химические свойства
- Оксид калия: формула, взаимодействие
- Что такое оксид?
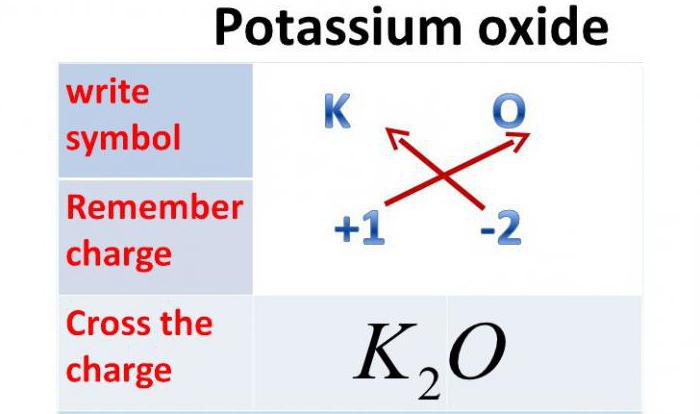
- Оксид калия: формула
- Физические свойства
- Химические свойства К2О
- Реакция с водой
- С другими оксидами
- Взаимодействие с кислотами
- К2О и галогены
- Взаимодействие с аммиаком
- Взаимодействие с органическими веществами
- Получение К2О
- Использование К2О в промышленности
- 🌟 Видео
Видео:Получение и химические свойства ОКСИДОВ 8 класс | ПРИНЦИП составления реакций с участием оксидовСкачать

Реакция взаимодействия оксида калия и воды
Уравнение реакции взаимодействия оксида калия и воды:
Реакция взаимодействия оксида калия и воды.
В результате реакции образуется гидроксид калия.
Реакция протекает при нормальных условиях.
Реакция протекает бурно.
Формула поиска по сайту: K2O + H2O → 2KOH.
Реакция взаимодействия алюминия и хлороводорода
Реакция взаимодействия хлорида германия (II) и гидроксида натрия
Реакция взаимодействия селенида натрия и азотной кислоты
Выбрать язык
Разделы
ТОП 5 записей
Популярные записи
Элементы, реакции, вещества
Предупреждение.
Все химические реакции и вся информация на сайте предназначены для использования исключительно в учебных целях — только для решения письменных, учебных задач. Мы не несем ответственность за проведение вами химических реакций.
Химические реакции и информация на сайте
не предназначены для проведения химических и лабораторных опытов и работ.
Видео:Тетрапероксохромат Kалия - K3Cr(O2)4. Реакция Хромата Калия, Гидроксида Калия и Пероксида Водорода.Скачать

Оксид калия: способы получения и химические свойства
Оксид калия K2O — Бинарное неорганическое вещество . Белый, термически устойчивый.
Относительная молекулярная масса Mr = 94,20; относительная плотность для тв. и ж. состояния d = 2,33; tпл = 740º C при избыточном давлении.
Видео:Алюминий и гидроксид калияСкачать

Способ получения
1. Оксид калия можно получить путем взаимодействия калия и гидроксида калия при 450º С, в результате образуется оксид калия и водород :
2K + 2KOH = 2K2O + H2
2. При взаимодействии надпероксида калия и калия при температуре 700º C и избыточном давлении образуется оксид калия:
Видео:Золотая кислота и гидроксид калия - продолжениеСкачать

Химические свойства
1. При разложении оксида калия образуется пероксид калия и калий, температура при этом должна быть 350–430º С:
2. Оксид калия взаимодействует со сложными веществами:
2.1. Оксид калия реагирует с водой . Образуется гидроксид калия:
2.2. Оксид калия взаимодействует с кислотами . При этом образуются соль и вода.
Например , оксид калия с разбавленной соляной кислотой образует хлорид калия и воду:
K2O + 2HCl = 2KCl + H2O.
2.3. При взаимодействии калия с оксидами образуются соли.
2.3.1. Реагируя с углекислым газом при 400º C оксид калия образует карбонат калия:
2.3.2. При 150–200º C, в результате взаимодействия оксида калия, и оксидом азота (IV) образуются нитрат калия и нитрит калия:
2.3.3. Оксид калия взаимодействует с оксидом алюминия при 1000º С. При это образуется алюминат калия:
Видео:Химические свойства ОСНОВАНИЙ 8 класс | ПРИНЦИП составления ЛЮБОЙ реакции с участием основанийСкачать

Оксид калия: формула, взаимодействие
В неорганической химии существует три основных класса соединений. Это кислоты, щелочи и оксиды. Кислота состоит из катиона водорода и аниона кислотного остатка. Щелочь — из катиона металла и гидроксильной группы. Об оксидах мы поговорим подробнее далее.
Видео:Самый *ПРОСТОЙ* способ ПОЛУЧИТЬ ГИДРОКСИД КАЛИЯСкачать

Что такое оксид?
Это соединение, состоящее из двух разных химических элементов, одним из которых является кислород. Вторым же может быть металл или неметалл. Количество атомов кислорода зависит от валентности второго химического элемента, входящего в состав соединения. Так, например, валентность калия равна одному, поэтому оксид калия будет содержать один атом кислорода и два атома калия. Валентность кальция равна двум, поэтому его оксид будет состоять из одного атома кислорода и одного атома кальция. Валентность фосфора равна пяти, поэтому его оксид состоит из двух атомов фосфора и пяти атомов кислорода.
В этой статье мы более подробно поговорим про оксид калия. А именно — о его физических и химических свойствах, о его применении в различных областях промышленности.
Видео:ХИМИЯ | Основные классы соединений. Уравнения реакций ч.1Скачать

Оксид калия: формула
Так как валентность данного металла равна одному, а валентность кислорода — двум, то это химическое соединение будет состоять из двух атомов металла и одного атома Оксигена. Итак, оксид калия: формула — К2О.
Видео:Кислотный оксид + вода = ??? Основной оксид + вода = ???Скачать

Физические свойства
Рассматриваемый оксид обладает бледно-желтой окраской. Иногда он может быть и бесцветным. При комнатной температуре он обладает твердым агрегатным состоянием.
Температура плавления данного вещества равняется 740 градусам Цельсия.
Плотность составляет 2,32 г/см 3 .
При термическом разложении данного оксида образуется пероксид этого же металла и чистый калий.
Растворим в органических растворителях.
В воде не растворяется, а вступает в реакцию с ней.
Обладает высокой гигроскопичностью.
Видео:Химия 8 класс.Основания.Скачать

Химические свойства К2О
Данное вещество обладает типичными для всех основных оксидов химическими свойствами. Рассмотрим химические реакции данного оксида с различными веществами по порядку.
Видео:Задача с кислыми солями и растворимостью 33 ЕГЭ химия 2023Скачать

Реакция с водой
В первую очередь оно способно реагировать с водой с образованием в результате гидроксида данного металла.
Уравнение такой реакции выглядит следующим образом:
Зная молярную массу каждого из веществ, из уравнения можно сделать следующий вывод: из 94 граммов рассматриваемого оксида и 18 граммов воды можно получить 112 граммов калий гидроксида.
Видео:Гидроксид калия ЭлекиролизСкачать
С другими оксидами
Кроме того, рассматриваемый оксид способен реагировать с диоксидом карбона (углекислым газом). При этом образуется соль — карбонат калия.
Уравнение реакции оксида калия и оксида карбона можно записать следующим образом:
Так, можно сделать вывод, что из 94 граммов рассматриваемого оксида и 44 граммов углекислого газа получается 138 граммов калий карбоната.
Также рассматриваемый оксид может вступать в реакцию с оксидом сульфура. При этом образуется другая соль — калий сульфат.
Взаимодействие оксида калия с оксидом сульфура можно выразить следующим уравнением:
Из него видно, что, взяв 94 грамма рассматриваемого оксида и 80 граммов оксида сульфура, можно получить 174 грамма сульфата калия.
Таким же образом К2О может реагировать и с другими оксидами.
Другой тип взаимодействия — реакции не с кислотными, а с амфотерными оксидами. В таком случае образуется не кислота, а соль. Примером такого химического процесса может служить взаимодействие рассматриваемого оксида с оксидом цинка.
Эту реакцию можно выразить следующим уравнением:
Из него видно, что при взаимодействии рассматриваемого оксида и оксида цинка образуется соль под названием калий цинкат. Если знать молярную массу всех веществ, то можно подсчитать, что из 94 граммов К2О и 81 грамма оксида цинка можно получить 175 граммов калий цинката.
Также К2О способен взаимодействовать с оксидом азота. При этом образуется смесь из двух солей: нитрата и нитрита калия. Уравнение этой реакции выглядит таким образом:
Если знать молярные массы веществ, можно сказать, что из 94 граммов рассматриваемого оксида и 92 граммов оксида нитрогена можно получить 101 грамм нитрата и 85 граммов нитрита.
Видео:Получение: Гидроксида калия - KOHСкачать

Взаимодействие с кислотами
Самый распространенный случай — оксид калия + серная кислота = сульфат калия + вода. Уравнение реакции выглядит таким образом:
Из уравнения можно сделать вывод, что для получения 174 граммов сульфата калия и 18 граммов воды необходимо взять 94 грамма рассматриваемого оксида и 98 граммов серной кислоты.
Похожим образом происходит химическое взаимодействие между рассматриваемым оксидом и азотной кислотой. При этом образуется нитрат калия и вода. Уравнение этой реакции можно записать следующим образом:
Таким образом, из 188 граммов рассматриваемого оксида и 252 граммов азотной кислоты можно получить 404 грамма нитрата калия и 36 граммов воды.
По такому же принципу рассматриваемый оксид может реагировать и с другими кислотами. В процессе этого будут образовываться другие соли и вода. Так, к примеру, при реакции этого оксида с фосфорной кислотой получается фосфат и вода, с хлоридной кислотой — хлорид и вода и так далее.
Видео:Задача №34 про сплавление оксида железа с щелочью | ЕГЭ по химии 2024Скачать

К2О и галогены
Рассматриваемое химическое соединение способно реагировать и с веществами данной группы. К галогенам относятся простые соединения, состоящие из нескольких атомов одного и того же химического элемента. Это, например, хлор, бром, иод и некоторые другие.
Итак, хлор и оксид калия: уравнение:
В результате такого взаимодействия образуется две соли: хлорид и гипохлорит калия. Из 94 грамм рассматриваемого оксида и 70 грамм хлора получается 74 грамма хлорида калия и 90 грамм гипохлорита калия.
Видео:9.гидроксид калия и др. Свойства основанийСкачать

Взаимодействие с аммиаком
К2О способен реагировать с этим веществом. В результате такого химического взаимодействия образуется гидроксид и амид калия. Уравнение данной реакции выглядит следующим образом:
Зная молярные массы всех веществ, можно вычислить пропорции реагентов и продуктов реакции. Из 94 граммов рассматриваемого оксида и 17 граммов аммиака можно получить 56 граммов гидроксида калия и 55 граммов амида калия.
Видео:Реакция ОВР с KOH #химия #химияогэ #огэСкачать

Взаимодействие с органическими веществами
Из органических химических веществ оксид калия взаимодействует с эфирами и спиртами. Однако эти реакции идут медленно и требуют специальных условий.
Видео:9 класс. Химия. ОГЭ. Задание 11. Классификация химических реакций.Скачать

Получение К2О
Данное химическое вещество можно получать несолькими способами. Вот самые распространенные из них:
- Из нитрата калия и металлического калия. Эти два реагента нагревают, в результате чего образуется К2О и азот. Уравнение реакции выглядит следующим образом: 2KNO3 + 10К = N2 + 6К2О.
- Второй способ происходит в два этапа. Сначала происходит реакция между калием и кислородом, в результате чего образуется пероксид калия. Уравнение реакции выглядит так: 2К + О2 = К2О2. Далее пероксид обогащают калием, в результате чего и получают оксид калия. Уравнение реакции можно записать таким образом: К2О2 + 2К = 2К2О.
Видео:Задача №34 на гидрокарбонат и растворимость | ЕГЭ по химии 2024Скачать

Использование К2О в промышленности
Наиболее часто рассматриваемое вещество используется в сельскохозяйственной промышленности. Данный оксид является одним из компонентов минеральных удобрений. Калий очень важен для растений, так как повышает их стойкость к различным заболеваниям. Также рассматриваемое вещество применяется в строительстве, так как может присутствовать в составе некоторых видов цемента. Кроме того, оно применяется в химической промышленности для получения других соединений калия.
🌟 Видео
8 класс химические свойства оксидов, оснований, кислот, солей и ионные уравненияСкачать

Как протекает реакция нитрата серебра с гидроксидом калия?Скачать

Задачи по химии. Система уравнений. Кремний. В2 ЦТ 2005Скачать