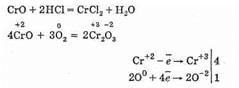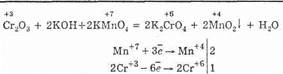Оксид хрома (II)
Химические свойства
Оксид хрома (II) имеет основный характер, ему соответствует гидроксид хрома (II), обладающий основными свойствами.
1. При обычной температуре устойчив на воздухе, выше 100°С окисляется кислородом . Все соединения хрома (II) – сильные восстановители.
2. При высоких температурах оксид хрома (II) диспропорционирует :
3CrO → Cr + Cr2O3
3. Оксид хрома (II) не взаимодействует с водой.
4. Оксид хрома (II) проявляет основные свойства. Взаимодействует с сильными кислотами и кислотными оксидами .
Например , оксид хрома (II) взаимодействует с соляной кислотой:
CrO + 2HCl → CrCl2 + H2O
Видео:Кислотный оксид + вода = ??? Основной оксид + вода = ???Скачать

Оксиды хрома (II), (III) и (VI)
Хром образует три оксида: CrO, Cr2O3, CrO3.
Оксид хрома (II) CrO — пирофорный черный порошок. Обладает основными свойствами.
В окислительно-восстановительных реакциях ведет себя как восстановитель:
CrO получают разложением в вакууме карбонила хрома Cr(СО)6 при 300°С.
Оксид хрома (III) Cr2O3 — тугоплавкий порошок зеленого цвета. По твердости близок к корунду, поэтому его вводят в состав полирующих средств. Образуется при взаимодействии Cr и O2при высокой температуре. В лаборатории оксид хрома (III) можно получить нагреванием дихромата аммония:
Оксид хрома (III) обладает амфотерными свойствами. При взаимодействии с кислотами образуются соли хрома (III): Cr2O3+3H2SO4=Cr2(SO4)3+3Н2О
При взаимодействии с щелочами в расплаве образуются соединения хрома (III) — хромиты (в отсутствие кислорода): Cr2O3+2NaOH=2NaCrO2+Н2О
В воде оксид хрома (III) нерастворим.
В окислительно-восстановительных реакциях оксид хрома (III) ведет себя как восстановитель:
Оксид хрома (VI) CrO3 — хромовый ангидрид, представляет собой темно-красные игольчатые кристаллы. При нагревании около 200°С разлагается:
Легко растворяется в воде, имея кислотный характер, образует хромовые кислоты. С избытком воды образуется хромовая кислота H2CrO4:
При большой концентрации CrO3 образуется дихромовая кислота Н2Cr2О7:
которая при разбавлении переходит в хромовую кислоту:
Хромовые кислоты существуют только в водном растворе, ни одна из этих кислот в свободном состоянии не выделена. Однако соли их весьма устойчивы.
Оксид хрома (VI) является сильным окислителем:
Окисляет иод, серу, фосфор, уголь, превращаясь в Cr2O3. Получают CrO3 действием избытка концентрированной серной кислоты на насыщенный водный раствор дихромата натрия: Na2Cr2O7+2H2SO4=2CrO3+2NaHSO4+H2O Следует отметить сильную токсичность оксида хрома (VI).
Дата добавления: 2016-01-03 ; просмотров: 11977 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Видео:ОКСИДЫ ХИМИЯ — Что такое Оксиды? Химические свойства Оксидов | Реакция ОксидовСкачать

Acetyl
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. 🔍 ВидеоРеакции металлов с кислородом и водой. 8 класс.Скачать  Реакция оксида кальция с водой | CaO + H2O = Ca(OH)2Скачать  Оксиды хромаСкачать  РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать  Ионные уравнения реакций. Как составлять полные и сокращенные уравненияСкачать  Все реакции по теме «Хром» для ЕГЭ по химии | Екатерина СтрогановаСкачать  28. Химические свойства и способы получения оксида хрома (III) Cr2O3Скачать  Химические свойства воды/часть 2/химия 8Скачать  8 класс химические свойства оксидов, оснований, кислот, солей и ионные уравненияСкачать  Окисление аммиака в присутствии оксида хромаСкачать  Хром и его соединенияСкачать  ВСЕ РЕАКЦИИ С ХРОМОМ И ЕГО СОЕДИНЕНИЯМИ| ЕГЭ ХИМИЯ 2024 | НООСкачать  Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать  Решение задач на термохимические уравнения. 8 класс.Скачать  1.2. Хром. Свойства соединений хрома(II, III)Скачать  11 класс. Хром. Часть 2.Скачать  Оксид Хрома(6) - CrO3. Реакция Дихромата Калия и Серной Кислоты. Реакция K2Cr2O7 и H2SO4.Скачать  Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать  |