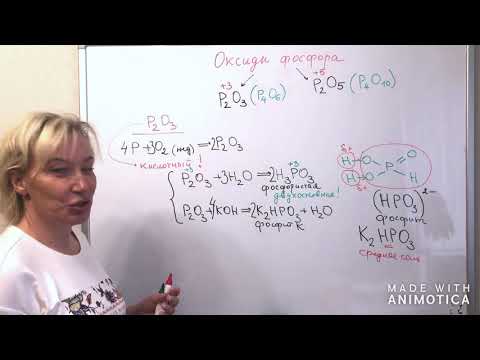| Оксиды азота | Цвет | Фаза | Характер оксида |
| P2O3 Оксид фосфора (III), фосфористый ангидрид | белый | твердый | кислотный |
| P2O5 Оксид фосфора(V), фосфорный ангидрид | белый | твердый | кислотный |
Оксид фосфора (V) – это кислотный оксид. В нормальных условиях образует белые кристаллы. В парах состоит из молекул P4О10. Очень гигроскопичен (используется как осушитель газов и жидкостей).
Способы получения. Оксид фосфора (V) получают сжиганием фосфора в избытке кислорода.
Видео:Химия 9 класс (Урок№16 - Фосфор. Аллотропия фосфора. Свойства фосфора. Оксид фосфора(V).)Скачать

Химические свойства
1. Оксид фосфора (V) – очень гигроскопичное вещество, которое используется для осушения газов. Обладая высоким сродством к воде, оксид фосфора (V) дегидратирует до ангидридов неорганические и органические кислоты.
Например , оксид фосфора (V) дегидратирует серную, азотную и уксусную кислоты:
2. Фосфорный ангидрид является типичным кислотным оксидом , взаимодействует с водой с образованием фосфорных кислот:
В зависимости от количества воды и от других условий образуются мета-фосфорная, орто-фосфорная или пиро-фосфорная кислота:
Видеоопыт взаимодействия оксида фосфора с водой можно посмотреть здесь.
3. Как кислотный оксид, оксид фосфора (V) взаимодействует с основными оксидами и основаниями .
Например , оксид фосфора (V) взаимодействует с гидроксидом натрия. При этом образуются средние или кислые соли:
Еще пример : оксид фосфора взаимодействует с оксидом бария (при сплавлении):
Видео:Реакция оксида фосфора с водой. Химический опытСкачать

Оксид фосфора с водой ионное уравнение
I. Оксид фосфора (V) – фосфорный ангидрид

Получение: Получается при горении фосфора в избытке воздуха или кислорода
Применение: Оксид фосфора (V) очень энергично соединяется с водой, а также отнимает воду от других соединений. Применяется как осушитель газов и жидкостей.
Химические свойства: Оксид фосфора (V) – это кислотный оксид, взаимодействует, подобно другим кислотным оксидам с водой, основными оксидами и основаниями.
Фосфорный ангидрид особым образом взаимодействует с водой, взаимодействуя с водой при обычных условиях (без нагревания) , образует в первую очередь метафосфорную кислоту НРО3:
при нагревании образуется ортофосфорная кислота H3PO4:
II. Ортофосфорная кислота
Наибольшее практическое значение имеет ортофосфорная кислота Н3РO4
Строение молекулы: В молекуле фосфорной кислоты атомы водорода соединены с атомами кислорода:
Физические свойства: Фосфорная кислота представляет собой бесцветное, гигроскопичное твердое вещество, хорошо растворимое в воде.
Получение:
1) Взаимодействие оксида фосфора (V) с водой при нагревании:
2) Взаимодействие природной соли – ортофосфата кальция с серной кислотой при нагревании:
3) При взаимодействии фосфора с концентрированной азотной кислотой
Химические свойства:
Свойства, общие с другими кислотами
Специфические свойства
1. Водный раствор кислоты изменяет окраску индикаторов на красный:
Ортофосфорная кислота диссоциирует ступенчато:
HPO4 2- ↔ H + + PO4 3- (ортофосфат-ион)
2. Взаимодействует с металлами в ряду активности до (Н2):
3. Взаимодействует с основными оксидами:
4. Взаимодействует с основаниями Ме(ОН)n:
если кислота в избытке, то образуется кислая соль:
5. Реагирует с аммиаком (по донорно-акцепторному механизму), если в избытке кислота, образуются кислые соли:
6. Реагирует с солями слабых кислот:
1. При нагревании ортофосфорная кислота постепенно превращается в метафосфорную кислоту:
2. Качественная реакция на PO4 3- — фосфат ион
Отличительной реакцией ортофосфорной кислоты от других фосфорных кислот является реакция с нитратом серебра — образуется жёлтый осадок:
3. Играет большую роль в жизнедеятельности животных и растений. Её остатки входят в состав АТФ. При разложении АТФ выделяется большое количество энергии, что очень важно для живых организмов.
Применение:
В основном для производства минеральных удобрений.
А также, используется при пайке, для очищения от ржавчины металлических поверхностей. Также применяется в составе фреонов, в промышленных морозильных установках как связующее вещество. Ортофосфорная кислота зарегистрирована в качестве пищевой добавки E338. Применяется как регулятор кислотности в газированных напитках.
III. Минеральные удобрения
Минеральные удобрения — неорганические соединения, содержащие необходимые для растений элементы питания.
В почвах обычно имеются все необходимые растению питательные элементы. Но часто отдельных элементов бывает недостаточно для удовлетворительного роста растений. На песчаных почвах растения нередко испытывают недостаток магния, на торфяных почвах – молибдена, на черноземах – марганца и т. п. Применениеминеральных удобрений – один из основных приемов интенсивного земледелия. С помощью минеральных удобренийможно резко повысить урожаи любых культур на уже освоенных площадях без дополнительных затрат на обработку новых земель. Для внесения минеральных удобрений используются туковые сеялки.
Установлено, что в состав растений входит около 70 элементов. Некоторые из них – макроэлементы – необходимы растениям в больших количествах; другие же – микроэлементы – требуются в незначительных количествах.
1. Макроэлементы – углерод, кислород, водород, азот, фосфор, сера, магний, калий, кальций.
2. Ммкроэлементы – железо, марганец, бор , медь, цинк, молибден, кобальт и др.
Тир важнейших элемента – азот, фосфор и калий – необходимы растениям в больших количествах. Поэтому удобрения, содержащие эти элементы, получают в промышленных масштабах.
При недостатке азота задерживается образование зелёной массы, растения плохо растут, их листья желтеют. Азотные удобрения необходимы растениям в весенний период.
Фосфор необходим при росте и развитии репродуктивных органов растений (цветков, плодов).
Калий ускоряет процесс фотосинтеза и содействует накоплению углеводов (сахара – в сахарной свекле, крахмала в картофеле). У злаковых он способствует укреплению стебля и тем самым устраняет их полегание.
Железо, марганец, бор и другие микроэлементы играют определённую роль в жизни растений. Так, например, при наличии микроэлемента бора растения лучше усваивают азот, фосфор, и калий.Медь, марганец и цинк ускоряют окислительно-восстановительные процессы и тем самым способствуют росту растений. Железо участвует в синтезе хлорофилла.
Растения поглощают макро – и микроэлементы из почвенного раствора в виде ионов (NH4 + , NO3 — ,K + и других)
Минеральные удобрения содержат питательные вещества в виде различных минеральных солей. В зависимости от того, какие питательные элементы содержатся в них, минеральные удобренияподразделяют на простые и комплексные.
1) Простые минеральные удобрения содержат один какой-либо элемент питания (P,K, N). К ним относятся фосфорные, азотные, калийные и микроудобрения.
2) Комплексные минеральные удобрения содержат одновременно два или более основных питательных элемента.
IV. Тренажеры
V. Закрепление
Задание №1. Составьте уравнения реакций оксида фосфора (V) с
1. Na2O
2. NaOH
3. H2O при нагревании
4. H2O без нагревания
Для 2 реакции запишите полное и краткое ионное уравнение.
Задание №2. Составьте молекулярные и ионные уравнения реакций ортофосфорной кислоты с:
1. калием
2. оксидом калия
3. гидроксидом калия
4. сульфитом калия
Задание №4. Вычислите (в %), какое из фосфорных удобрений: двойной суперфосфат или преципитат богаче фосфором? Химические формулы удобрений найдите в схеме самостоятельно.
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Урок №37. Оксид фосфора (V). Фосфорная кислота и её соли. Фосфорные удобрения
Оксид фосфора (V) – фосфорный ангидрид
Физические свойства:
Оксид фосфора (V) Р 2 О 5 — белый гигроскопичный порошок (поглощает воду), следует хранить в плотно закрытых сосудах.
Получение:
Получается при горении фосфора в избытке воздуха или кислорода
4P + 5O 2 = t, °C = 2P 2 O 5
Применение:
Оксид фосфора (V) очень энергично соединяется с водой, а также отнимает воду от других соединений. Применяется как осушитель газов и жидкостей.
Химические свойства:
Оксид фосфора (V) – это кислотный оксид, взаимодействует, подобно другим кислотным оксидам с водой, основными оксидами и основаниями.
Фосфорный ангидрид особым образом взаимодействует с водой, взаимодействуя с водой при обычных условиях (без нагревания) , образует в первую очередь метафосфорную кислоту НРО 3 :
P 2 O 5 + H 2 O = холод = HPO 3
при нагревании образуется ортофосфорная кислота H 3 PO 4 :
P 2 O 5 + 3H 2 O = t, °C = 2H 3 PO 4
При нагревании H 3 PO 4 можно получить пирофосфорную кислоту H 4 P 2 O 7 :
2H 3 PO 4 = t, °C = H 2 O + H 4 P 2 O 7
Ортофосфорная кислота
Наибольшее практическое значение имеет ортофосфорная кислота Н 3 РO 4 .
Строение молекулы:
В молекуле фосфорной кислоты атомы водорода соединены с атомами кислорода:
Физические свойства:
Фосфорная кислота представляет собой бесцветное, гигроскопичное твердое вещество, хорошо растворимое в воде.
Получение:
1) Взаимодействие оксида фосфора (V) с водой при нагревании:
P 2 O 5 + 3H 2 O = t, °C = 2H 3 PO 4
2) Взаимодействие природной соли – ортофосфата кальция с серной кислотой при нагревании:
Сa 3 (PO 4 ) 2 + 3H 2 SO 4 = t, °C = 3CaSO 4 + 2H 3 PO 4
3) При взаимодействии фосфора с концентрированной азотной кислотой
3P + 5HNO 3 + 2H 2 O = 3H 3 PO 4 + 5NO
Химические свойства:
Свойства, общие с другими кислотами
1. Водный раствор кислоты изменяет окраску индикаторов на красный:
Ортофосфорная кислота диссоциирует ступенчато:
H 3 PO 4 ↔ H + + H 2 PO 4 — (дигидроортофосфат-ион)
H 2 PO 4 — ↔ H + + HPO 4 2- (гидроортофосфат-ион)
HPO 4 2- ↔ H + + PO 4 3- (ортофосфат-ион)
2. Взаимодействует с металлами в ряду активности до (Н 2 ):
металл+ H 3 PO 4 =соль+Н 2 ↑
3. Взаимодействует с основными оксидами:
оксид металла + H 3 PO 4 = соль + Н 2 О
основание + H 3 PO 4 = соль + Н 2 О
если кислота в избытке, то образуется кислая соль:
H 3 PO 4(изб) + NaOH = NaH 2 PO 4 + H 2 O или
H 3 PO 4(изб) + 2NaOH = Na 2 HPO 4 + 2H 2 O
5. Реагирует с аммиаком (по донорно-акцепторному механизму), если в избытке кислота, образуются кислые соли:
6. Реагирует с солями слабых кислот:
2H 3 PO 4 +3Na 2 CO 3 = 2Na 3 PO 4 + 3H 2 O + 3CO 2 ↑
Специфические свойства
1. При нагревании ортофосфорная кислота постепенно превращается в метафосфорную кислоту:
2H 3 PO 4 = t, °C =H 2 O + H 4 P 2 O 7
H 4 P 2 O 7 = t, °C = H 2 O + 2HPO 3
2. Качественная реакция на фосфат-ионы
Отличительной реакцией ортофосфорной кислоты от других фосфорных кислот является реакция с нитратом серебра — образуется жёлтый осадок :
Н 3 РО 4 + 3AgNO 3 = Ag 3 PO 4 ↓+ 3HNO 3
3. Играет большую роль в жизнедеятельности животных и растений.
Её остатки входят в состав АТФ. При разложении АТФ выделяется большое количество энергии, что очень важно для живых организмов.
Применение:
А также, используется при пайке, для очищения от ржавчины металлических поверхностей. Также применяется в составе фреонов, в промышленных морозильных установках как связующее вещество. Ортофосфорная кислота зарегистрирована в качестве пищевой добавки E338. Применяется как регулятор кислотности в газированных напитках.
Фосфорные удобрения
Фосфор – элемент важнейшего органического соединения для любого организма аденозинтрифосфорной кислоты – АТФ. Эта кислота служит аккумулятором энергии в живой клетке. Фосфор входит в состав нуклеиновых кислот – ДНК и РНК, а без них невозможно хранение и воспроизведение генетической информации, содержащейся в клетке. Фосфор принимает активное участие в восстановлении и и распаде углеводов, оказывая большое влияние на рост растения, его цветение и плодоношение.
Растения усваивают фосфор из почвы главным образом в виде фосфат – иона (РО 4 3- ). Как известно, фосфорная кислота образует три типа солей: орто-, гидро- и дигидрофосфаты. Для усвоения растением удобрение должно быть растворимо в воде, из средних фосфатов растворимы только соли щелочных металлов, гидрофосфаты растворимы лучше, зато дигидрофосфаты растворимы все без исключения.
Однако, и нерастворимая фосфоритная мука Са 3 (РО 4 ) 2 и труднорастворимый преципитат СаНРО 4 прекрасно усваиваются некоторыми культурами (люпин, горох, горчица, гречиха…). Дело в том, что корневые волоски этих растений выделяют органические кислоты, растворяющие неподатливые в воде соли.
Одно из первых фосфорных удобрений – это простой суперфосфат CaSO 4 . Ca(H 2 PO 4 ) 2 . Массовая доля оксида фосфора в нем не превышает 20% (это немного), кроме того, большую часть этого удобрения составляет балласт – сульфат кальция. Однако, пользоваться им будут еще долго, из-за легкости его получения:
В другом фосфорном удобрении – двойном суперфосфате Са(Н 2 РО 4 )∙Н 2 О — в отличие от простого нет балласта – неусваиваемого растениями гипса. Производство этого удобрения связано с применением фосфорной кислоты вместо серной, сырьем может служить как фосфорит (ортофосфат кальция), так и известняк (карбонат кальция):
Са 3 (РО 4 ) 2 + 4Н 3 РО 4 + 3Н 2 О = 3Са(Н 2 РО 4 ) 2 ∙Н 2 О
СаСО 3 + 2Н 3 РО 4 = Са(Н 2 РО 4 ) 2 ∙Н 2 О + СО 2
На основе фосфорной кислоты также можно получить еще одно фосфорное удобрение – преципитат СаНРО 4 , содержащий 27–42 % фосфорного ангидрида:
2Н 3 РО 4 + Са(ОН) 2 = Са(Н 2 РО 4 ) 2 + 2Н 2 О
Са(Н 2 РО 4 ) 2 + Са(ОН) 2 = 2СаНРО 4 + 2Н 2 О
А если заменить в этих удобрениях довольно безразличный для растений кальций на ион аммония? Нейтрализацией фосфорной кислоты газообразным аммиаком получают высокоэффективные удобрения — аммофосы:
ЗАДАНИЯ ДЛЯ ЗАКРЕПЛЕНИЯ
№1. Составьте уравнения реакций оксида фосфора (V) с
3. H 2 O при нагревании
4. H 2 O без нагревания
Для 2 реакции запишите полное и краткое ионное уравнение.
№2. Составьте молекулярные и ионные уравнения реакций ортофосфорной кислоты с:
2. оксидом калия
3. гидроксидом калия
4. сульфитом калия
№3. Осуществите превращения по схеме:
№4. Вычислите (в %), какое из фосфорных удобрений: двойной суперфосфат или преципитат богаче фосфором?
🎦 Видео
Опыты по химии. Взаимодействие оксида фосфора (V) с водойСкачать

ОКСИДЫ ХИМИЯ — Что такое Оксиды? Химические свойства Оксидов | Реакция ОксидовСкачать

Опыты по химии. Взаимодействие воды с оксидамиСкачать

Взаимодействие оксида фосфора с водойСкачать

Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Опыты по химии. Горение фосфора над водойСкачать

Оксид фосфора и водаСкачать

Проклятая химическая реакция 😜 #shortsСкачать

Кислотный оксид + вода = ??? Основной оксид + вода = ???Скачать

Взаимодействие оксида фосфора с водойСкачать

Химические Цепочки — Решение Цепочек Химических Превращений // Химия 8 классСкачать

Ионное произведение воды. Водородный показатель. 11 класс.Скачать

4 Оксид фосфора с водой П aviСкачать

Химические уравнения. СЕКРЕТНЫЙ СПОСОБ: Как составлять химические уравнения? Химия 8 классСкачать

Реакция оксида фосфора с водой / Reacrion of phosphorous pentaoxide with waterСкачать

75. Ионные реакции в растворах электролитовСкачать

9 класс. Урок 6. Оксиды фосфора.Скачать