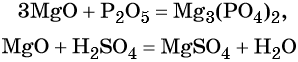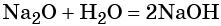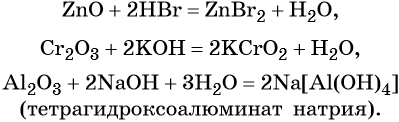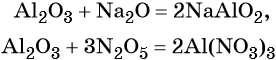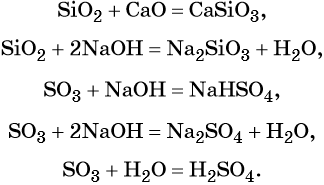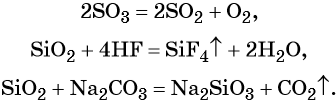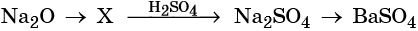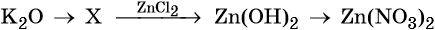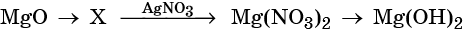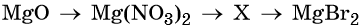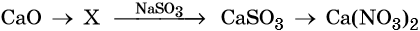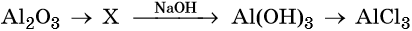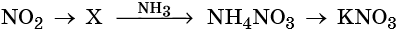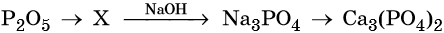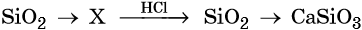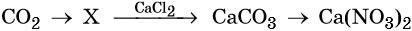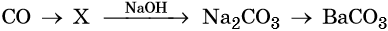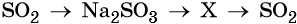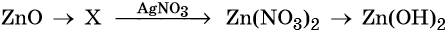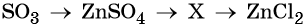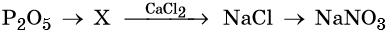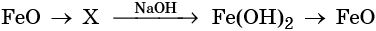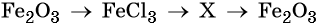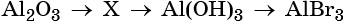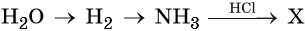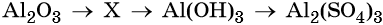Гидроксид бария Ba(OH)2 — неорганическое соединение. Белый, плавится без разложения. При дальнейшем нагревании разлагается. Хорошо растворяется в воде. Проявляет основные свойства.
Относительная молекулярная масса Mr = 171,34; относительная плотность для тв. и ж. состояния d = 4,5; tпл = 408º C.
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Способы получения
1. Гидроксид бария получают в результате взаимодействия твердого сульфида бария и паров воды при 450º С, на выходе образуется гидроксид бария и сероводородная кислота:
2 . При взаимодействии бария с водой при комнатной температуре образуется гидроксид бария и водород:
3. Оксид бария при взаимодействии с водой образует гидроксид бария:
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Качественная реакция
Качественная реакция на гидроксид бария — окрашивание фенолфталеина в малиновый цвет .
Видео:Химия | Молекулярные и ионные уравненияСкачать

Химические свойства
1. Гидроксид бария взаимодействует со сложными веществами :
1.1. Гидроксид бария реагирует с кислотами:
1.1.1. В результате реакции между гидроксидом бария и разбавленной соляной кислотой образуется хлорид бария и вода:
1.1.2. Гидроксид бария взаимодействует с разбавленной серной кислотой, образуя сульфат бария и воду:
1.1.3. В результате взаимодействия гидроксида бария и разбавленной фосфорной кислоты образуется фосфат бария и вода:
если с гидроксидом бария будет взаимодействовать концентрированная фосфорная кислота, то в результате реакции возможно образование гидрофосфата бария и воды:
1.1.4. С насыщенным и холодным гидроксидом бария реагирует разбавленная сероводородная кислота , образуя сульфид бария и воду:
если сероводородная кислота будет насыщенной на выходе образуются гидросульфид бария и вода:
1.1.5. Гидроксид бария вступает во взаимодействие с концентрированной плавиковой кислотой с образованием фторида бария и воды:
1.2. Гидроксид бария взаимодействует с оксидами:
1.2.1. В результате взаимодействия гидроксида бария и углекислого газа образуется карбонат бария и вода:
если с углекислым газом реагирует карбонат бария в виде суспензии, то образуется гидрокарбонат бария в растворе:
1.2.2. Гидроксид бария вступает в реакцию с оксидом серы (IV) , образуя на выходе сульфит бария и воду:
если с оксидом серы (IV) взаимодействует гидроксид бария в виде суспензии, то на выходе происходит образование гидросульфита бария в растворе:
1.3. Гидроксид бария вступает в взаимодействие с солями :
1.3.1. Гидроксид бария вступает в реакцию с хроматом калия и образует хромат бария и гидроксид калия:
1.3.2. Насыщенный гидроксид бария взаимодействует при кипении с концентрированным раствором хлората аммония. При этом образуются хлорат бария, газ аммиак и воды:
2. Гидроксид бария разлагается при температуре 780 — 800º С, образуя на выходе оксид бария и воду:
Видео:Ионные уравнения реакций. Как составлять полные и сокращенные уравненияСкачать

Оксид бария плюс гидроксид калия ионное уравнение
Для выполнения задания используйте следующий перечень веществ: хлорид аммония, кислород, сульфид бария, гидроксид калия, оксид бария. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна реакция ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения этой реакции.
Для выполнения задания используйте следующий перечень веществ: хлорид аммония, кислород, сульфид бария, гидроксид калия, оксид бария. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
Запишем уравнение реакции:
Составим электронный баланс:
Сера в степени окисления −2 является восстановителем, а кислород в степени окисления 0 — окислителем.
Видео:2. Ионные уравнения реакций. (практика)Скачать

Химические свойства оксидов: основных, амфотерных, кислотных
Определения и формулы основных, амфотерных и кислотных оксидов были приведены ранее в уроке 6.
Характерные химические свойства основных оксидов: реакции с кислотными оксидами с образованием солей и с кислотами с образованием солей и воды, например:
Некоторые основные оксиды реагируют с водой с образованием оснований. Эта реакция проходит в том случае, если продукт реакции растворим в воде:
В аналогичных условиях, например, оксид железа (II) с водой реагировать не будет, так как гидроксид железа (II) в воде нерастворим.
Амфотерные оксиды взаимодействуют как с кислотами, так и с основаниями с образованием солей и воды или комплексных соединений:
Кроме того, амфотерные оксиды могут взаимодействовать как с кислотными, так и с основными оксидами, например:
С водой амфотерные оксиды не взаимодействуют.
Кислотные оксиды реагируют с основными оксидами с образованием солей; с основаниями, с образованием солей и воды или кислых солей, а также с водой, в том случае если образующаяся в ходе такой реакции кислота растворима в воде:
Кроме того, кислотные оксиды вступают в окислительно-восстановительные и обменные реакции:
Видео:ОКСИДЫ, КИСЛОТЫ, СОЛИ И ОСНОВАНИЯ ХИМИЯ 8 класс / Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Тренировочные задания
1. Оксид натрия взаимодействует с каждым из двух веществ:
1) серная кислота и вода
2) уксусная кислота и азот
3) оксид лития и фосфор
4) оксид бария и серная кислота
2. Оксид калия взаимодействует с
1) азотом и фосфором
2) водой и сульфатом натрия
3) серной кислотой и оксидом фосфора (V)
4) литием и хлоридом натрия
3. Оксид кальция взаимодействует с
1) оксидом кремния
2) оксидом углерода (II)
3) оксидом азота (II)
4) оксидом азота (I)
4. Оксид бария взаимодействует с каждым из двух веществ:
1) азотной кислотой и водой
2) уксусной кислотой и хлором
3) оксидом натрия и азотом
4) оксидом серы (IV) и кремнием
5. Оксид магния не взаимодействует с
1) соляной кислотой
2) серной кислотой
3) оксидом лития
4) оксидом кремния
6. Оксид кальция взаимодействует с каждым из двух веществ:
1) оксидом фосфора (V), водой
2) оксидом углерода (IV) и сульфидом натрия
3) оксидом магния и азот
4) кислородом и сульфатом натрия
7. Оксид кальция реагирует с
1) медью
2) фосфором
3) оксидом углерода (IV)
4) оксидом магния
8. Оксид натрия реагирует с
1) водой
2) сульфатом калия
3) нитратом железа (II)
4) оксидом азота (II)
9. Оксид бария реагирует с каждым из двух веществ:
1) оксидом азота (II) и хлором
2) азотной кислотой и водой
3) оксидом углерода (II) и железом
4) серой и хлоридом кальция
10. Оксид магния реагирует с каждым из двух веществ:
1) оксидом кальция и оксидом железа (II)
2) оксидом алюминия и оксидом хрома (II)
3) соляной кислотой и оксидом кремния (VI)
4) оксидом фосфора (V) и цинком
11. Оксид цинка
1) растворяется в кислотах, но не реагирует с основаниями
2) растворяется в щелочах, но не реагирует с кислотами
3) реагирует с оксидом натрия, но не реагирует с водой
4) реагирует с оксидом калия и водой
12. Оксид хрома (III) реагирует с
1) оксидом калия
2) водой
3) оксидом серы (VI)
4) оксидом азота (I)
13. Оксид алюминия амфотерен, поскольку он способен взаимодействовать
1) как с азотной, так и серной кислотой
2) с водой и кислотами
3) с водой и щелочами
4) как с кислотами, так и со щелочами
14. Оксид алюминия реагирует с
1) сульфатом калия
2) оксидом калия
3) оксидом азота (II)
4) оксидом углерода (IV)
15. Оксид серы (VI) взаимодействует с каждым из двух веществ:
1) оксидом лития и углекислым газом
2) водой и углекислым газом
3) водой и гидроксидом калия
4) кислородом и натрием
16. Оксид фосфора (V) взаимодействует с каждым из двух веществ:
1) кислородом и водородом
2) водой и углекислым газом
3) водой и гидроксидом натрия
4) водой и оксидом углерода (II)
17. Оксид серы (VI) не взаимодействует с
1) водой
2) хлоридом калия
3) гидроксидом натрия
4) оксидом бария
18. Оксид серы (IV) взаимодействует с
1) оксидом углерода (IV) и водой
2) оксидом фосфора (V) и водой
3) сульфатом калия и водой
4) оксидом кальция и гидроксидом натрия
19. Оксид серы (IV) не взаимодействует с
1) водой
2) фосфатом кальция
3) раствором гидроксида натрия
4) гидроксидом кальция
20. Оксид хлора (VII) взаимодействует с каждым из двух веществ:
1) кальцием и углекислым газом
2) водой и углеродом
3) водой и оксидом калия
4) кислородом и азотом
21. Установите соответствие между реагирующими веществами и продуктами реакций.
22. Установите соответствие между реагирующими веществами и продуктами реакций.
23. Установите соответствие между реагирующими веществами и продуктами реакций.
24. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) CaO + SiO2 →
Б) CaO + H3PO4 (разб.) →
В) CaO + HCl →
25. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) ZnO + HCl →
Б) ZnO + NaOH ⎯⎯ H2O →
В) ZnO + Na2O ⎯⎯ сплавление →
26. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) ZnO + H3PO4 →
Б) ZnO + NaOH + H2O →
В) ZnO + C →
27. Установите соответствие между реагирующими веществами и продуктами реакций.
28. Установите соответствие между реагирующими веществами и продуктами реакций.
29. Установите соответствие между реагирующими веществами и продуктами реакций.
30. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) SO2 + H2S →
Б) SO2 (изб.) + NaOH →
В) SO2 + NaOH (изб.) →
31. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
32. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
33. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
34. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для первого превращения составьте сокращённое ионное уравнение реакции.
35. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
36. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
37. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
38. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
39. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для второго превращения составьте сокращённое ионное уравнение реакции.
40. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для второго превращения составьте сокращённое ионное уравнение реакции.
41. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
42. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для первого превращения составьте сокращённое ионное уравнение реакции.
43. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для второго превращения составьте сокращённое ионное уравнение реакции.
44. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для второго превращения составьте сокращённое ионное уравнение реакции.
45. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
46. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для второго превращения составьте сокращённое ионное уравнение реакции.
47. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для первого превращения составьте сокращённое ионное уравнение реакции.
48. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
49. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
50. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
🌟 Видео
Реакции ионного обмена. 9 класс.Скачать

ОКСИДЫ ХИМИЯ — Что такое Оксиды? Химические свойства Оксидов | Реакция ОксидовСкачать

Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Реакции ионного обменаСкачать

Химия. ОксидыСкачать

Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Ионные уравнения | Химия 8 класс #42 | ИнфоурокСкачать

Амфотерные гидроксиды. Химия ОГЭ 2023 | TutorOnlineСкачать

Гидроксид бария + Роданид АммонияСкачать

Ионные уравнения (реакции в растворах электролитов)Скачать

BaCl2+KOH=Ba(OH)2+KCl Ионное и молекулярное уравнения реакции, демонстрация.Скачать

Реакции ионного обмена. 9 класс.Скачать

Ионные уравнения: образования водыСкачать

9.гидроксид калия и др. Свойства основанийСкачать