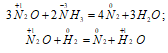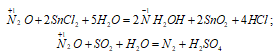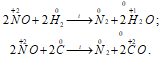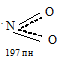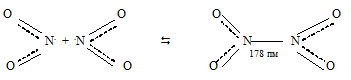| Оксиды азота | Цвет | Фаза | Характер оксида |
| N2O Оксид азота (I), закись азота, «веселящий газ» | бесцветный | газ | несолеобразующий |
| NO Оксид азота (II), закись азота, «веселящий газ» | бесцветный | газ | несолеобразующий |
| N2O3 Оксид азота (III), азотистый ангидрид | синий | жидкость | кислотный |
| NO2 Оксид азота (IV), диоксид азота, «лисий хвост» | бурый | газ | кислотный (соответствуют две кислоты) |
| N2O5 Оксид азота (V), азотный ангидрид | бесцветный | твердый | кислотный |
N2O5 – оксид азота (V), ангидрид азотной кислоты – кислотный оксид.
Видео:Зависимость скорости реакции от концентрации реагентовСкачать

Получение оксида азота (V)
1. Получить оксид азота (V) можно окислением диоксида азота :
2. Еще один способ получения оксида азота (V) – обезвоживание азотной кислоты сильным водоотнимающим веществом, оксидом фосфора (V) :
Видео:Влияние концентрации на скорость химических реакций. 10 класс.Скачать

Химические свойства оксида азота (V)
1. При растворении в воде оксид азота (V) образует азотную кислоту:
2. Оксид азота (V), как типичный кислотный оксид, взаимодействует с основаниями и основными оксидами с образованием солей-нитратов.
Например , оксид азота (V) реагирует с гидроксидом натрия:
Еще пример : оксид азота (V) реагирует с оксидом кальция:
3. За счет азота со степенью окисления +5 оксид азота (V) – сильный окислитель .
Например , он окисляет серу:
4. Оксид азота (V) легко разлагается при нагревании (со взрывом):
Видео:Задачи на скорость реакции в зависимости от концентрации реагентовСкачать

Оксид азота 5 разлагается по уравнению зависимость концентрации реагента от времени
Общий метод определения порядка реакции основан на законе действующих масс:
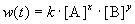
Представим, что вещество B находится в большом избытке, и его концентрация мало меняется в ходе реакции. Тогда порядок реакции по веществу A можно определить, измерив скорость реакции при двух концентрациях A. Записывая уравнение (3.1) для двух моментов времени в логарифмической форме и вычитая одно выражение из другого, найдем порядок x:
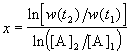
В случае, если имеется больше двух экспериментальных точек, можно записать кинетические данные в координатах lnw — ln[A] и представить их в линейном виде с помощью метода наименьших квадратов. Тогда порядок реакции x будет равен тангенсу угла наклона прямой.
Если реакция имеет целый порядок, то для определения порядка используют различные частные методы. Метод подстановки заключается в том, что кинетические данные представляют в виде
где функция f соответствует решению кинетического уравнения для одного из целых порядков. Если величина k, определенная таким образом, будет постоянной, то мы угадали, т.е. выбрали верный порядок. Если k будет изменяться со временем, то надо выбрать функцию f, соответствующую другому порядку.
Другой способ определения целого порядка заключается в измерении зависимости времени протекания реакции от начальной концентрации. Из решения (2.1) кинетического уравнения для реакции n-го порядка следует, что время t x, за которое степень превращения достигнет x, обратно пропорционально (n-1)-й степени начальной концентрации (см. также (2.2)):
Измеряя время превращения t x при двух начальных концентрациях, можно определить порядок n по формуле:
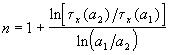
Отметим, что разные начальные концентрации можно выбирать на одной и той же кинетической кривой.
Пример 3-1. В некоторой реакции целого порядка nA 
Решение. Из первого опыта следует, что период полураспада вещества при начальной концентрации 1 моль/л равен 4 мин. Во втором опыте при начальной концентрации 2 моль/л период полураспада равен 1 мин (от 2 моль/л до 0.5 моль/л — за 5 мин, из них от 1 моль/л до 0.5 моль/л — 4 мин, следовательно на превращение от 2 моль/л до 1 моль/л потребовалась 1 мин).
Таким образом, при увеличении начальной концентрации в 2 раза период полураспада уменьшился в 4 = 2 n-1 раза, следовательно порядок реакции n = 3.
Пример 3-2. Кинетика реакции первого порядка, в которой происходило образование кислоты, изучалась путем отбора проб реакционной смеси и их титрования одним и тем же раствором щелочи. Объемы щелочи, которые пошли на титрование:
Время, мин
Объем, мл
Докажите, что реакция имеет первый порядок. Рассчитайте период полураспада.
Решение. Запишем решение кинетического уравнения для реакции первого порядка в виде:
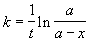
где a = x 
Время, мин
k, мин -1
0.0348
0.0347
В течение реакции величина k остается постоянной, что и доказывает первый порядок.
Период полураспада равен
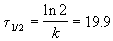
Пример 3-3. Реакция омыления метилацетата при 298 К описывается уравнением:
Для этой реакции получены следующие кинетические данные:
Время, мин
сNaOH, ммоль/л
Исходные концентрации щелочи и эфира одинаковы и равны 0.01 моль/л. Определите порядок реакции и константу скорости.
Решение. Запишем кинетические данные в координатах lnw-lnсNaOH, причем скорость реакции определим через конечные изменения концентраций и времени:
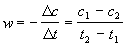
(Концентрацию вещества иногда обозначают не квадратными скобками, а буквой c). По этой приближенной формуле скорость лучше определять в середине временного интервала: t = (t1 + t2)/2. Концентрацию в этот момент времени определим как полусумму значений на границах интервала: c = (c1 + c2)/2. Сведем полученные данные в таблицу (учтем, что cNaOH = 10 ммоль/л при t = 0):
Видео:Оксиды азота. Оксид азота(I)Скачать

Строение и свойства оксидов азота
Задача 898.
Описать химические свойства N2О и NO. К какому классу оксидов относятся эти соединения?
Решение:
а) Химические свойства N2O:
1) При нагревании выше 500 0 С оксид азота (I) разлагается на азот и кислород:
2) Оксид азота (I) – сильный окислитель. Реакции N2O с аммиаком и водородом могут сопровождаться взрывом:
В водном растворе N2O взаимодействует с катионом Sn 2+ , восстанавливаясь до NH2OH, а раствор SO2 в воде восстанавливает N2O до N2:
б) Химические свойства NO. В NO атом азота находится в своей промежуточной степени окисления +2, поэтому для него характерна окислительно-восстановительная двойственность. Под действием сильных окислителей он окисляется, а в присутствии сильных восстановителей – восстанавливается.
1) NO как восстановитель:
2) NO как окислитель:
3) При взаимодействии NO с щелочными металлами образуется нитроксил-ион NO – , который является электронным аналогом молекулы О2 и имеет кратность связи 2:
NO + Na ↔ Na + + NO –
Нитроксил-ион играет роль промежуточного соединения в обратимых процессах нитрификации. Он димеризуется с образованием гипонитрит-иона:
4) Молекула NO относительно легко теряет электрон, превращаясь в прочный катион нитрозила NO+, изоэлектронный молекулам N2 и СО. Этот катион образует соли нитрозила:
NOF + BF3 ↔ [BF4] –
Тетрафторо-
борат (III) нитрозила
В водных растворах соли нитрозила гидролизуются:
Монооксид азота может быть лигандом в комплексных соединениях. Как лиганд NO называют «нитрозил». Например, [Fe(NO)4] – тетранитрозилжелезо, [Fe(H2O)5NO]Cl2 – хлорид нитрозилпентаакважелеза(II), K2[Fe(NO)(CN)5] – пентацианонитрозилферрат(III).
Оксиды N2O и NO – не солеобразующие сосуды. Они не взаимодействуют с водой, растворами кислот и оснований.
Задача 899.
Что представляет собой бурый газ, выделяющийся при действии концентрированной азотной кислоты на металлы? Из каких молекул он состоит? Почему его окраска усиливается при повышении температуры и ослабляется при ее понижении? Будет ли этот газ подчиняться закону Бойля — Мариотта, если подвергать его сжатию при постоянной температуре? Составить уравнения реакций, происходящих при растворении этого газа в воде и в растворе щелочи.
Решение:
При действии на металлы концентрированной азотной кислотой выделяется оксид азота (IV) NO2 – бурый очень токсичный газ:
Молекула NO2 нелинейная:
Угол ONO равен 134,1 0
Её неспаренный электрон находится на связывающей орбитали. Благодаря этому при повышении давления и понижении температуры NO2 переходит в бесцветный димер:
При температуре от -11,2 0 С до 140 0 С бурый газ состоит из молекул NO2 и N2O4, которые в интервале этих температур находятся в равновесии друг с другом:
При повышении температуры до 140 0 С окраска бурого газа усиливается до почти чёрной. Это объясняется тем, что при нагревании равновесие в системе
N2O4 —2NO2 сместится в сторону образования NO2, т. е. при нагревании идёт диссоциация молекул N2O4 до образования в системе преимущественно молекул NO2, которые и придают тёмно-бурую окраску. Наоборот, при охлаждении в системе N2O4 —2NO2 происходит преимущественно димеризация молекул NO2 с образованием молекул N2O4, что и приводит к ослаблению окраски бурого газа.
Если мы будем повышать температуру системы больше 140 о С, то начнётся диссоциация молекул NO2 на NO и О2 (2NO2 ↔ 2NO + О2) и газ будет обесцвечиваться.
Если же бурый газ подвергнуть сжатию при постоянной температуре, то равновесие в системе N2O4 ↔ 2NO2, согласно принципу Ле Шателье, сместится влево, в сторону уменьшения числа газообразных веществ (в сторону уменьшения объёма в системе). При этом объём системы уменьшится, окраска будет становиться светлее.
Задача 900.
Почему молекула NO2 легко димеризуется, а для SO2 подобный процесс не характерен?
Решение:
Молекула NO2 нелинейная, имеет угловую форму с sp 2 -гибридизацией орбиталей атома азота:
Угол ONO равен 134,1 0
Её неспаренный электрон находится на связывающей орбитали. Благодаря этому при повышении давления и понижении температуры NO2 переходит в бесцветный димер:
угол ONO = 135 0
2ОN . + . NO2 ↔ 2ОN—NO2
Молекула N2O4 плоская. Таким образом, связь между двумя молекулами NO2 происходит за счёт объединения неспаренных электронов атомов азота обеих молекул.
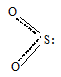
Молекула SO2 имеет также как молекула NO2 угловую форму с sp 2 -гибридизацией орбиталей атома серы:
Угол OSO равна 119,5 0 , длина связи O—S равна 143 пм.
На связывающей орбитали в молекуле SO2 находятся два спаренных электрона, поэтому молекулы не могут димеризоваться.
💥 Видео
ТИПОВЫЕ ЗАДАЧИ ПО ХИМИИ: Химическое Количество Вещества, Моль, Молярная Масса и Молярный ОбъемСкачать

Скорость химических реакций. 9 класс.Скачать

Оксиды азота. Оксид азота(IV)Скачать

задачи по химии "Зависимость скорости химической реакции от концентрации реагирующих веществ"Скачать

задачи на порядок хим реакцииСкачать

Тепловой эффект хим. реакции. Энтальпия. Закон Гесса. Капучинка ^-^Скачать

Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Установление эмпирической и молек. формул по массовым долям элем., входящих в состав в-ва. 10 класс.Скачать

Основы химической кинетикиСкачать

Химическая кинетика. Скорость химической реакции | ХимияСкачать

Разложение нитратов за 5 минут | ХИМИЯ ЕГЭ | СОТКАСкачать

5 3 Определение порядка реакцийСкачать

Химическое равновесие. Константа равновесия. 10 класс.Скачать

О НЁМ НЕ ГОВОРЯТ НА УРОКАХ ХИМИИ. ОКСИД АЗОТА (III)!Скачать

Задание 23 нового формата | Химия ЕГЭ 2023 | УмскулСкачать

Все типы задания 18. Скорость реакции | Химия ЕГЭ 2023 | УмскулСкачать