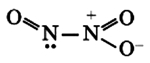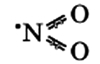| Оксиды азота | Цвет | Фаза | Характер оксида |
| N2O Оксид азота (I), закись азота, «веселящий газ» | бесцветный | газ | несолеобразующий |
| NO Оксид азота (II), закись азота, «веселящий газ» | бесцветный | газ | несолеобразующий |
| N2O3 Оксид азота (III), азотистый ангидрид | синий | жидкость | кислотный |
| NO2 Оксид азота (IV), диоксид азота, «лисий хвост» | бурый | газ | кислотный (соответствуют две кислоты) |
| N2O5 Оксид азота (V), азотный ангидрид | бесцветный | твердый | кислотный |
Оксид азота (I) N2O, оксид диазота, закись азота, веселящий газ – это несолеобразующий оксид . Малые концентрации закиси азота вызывают лёгкое опьянение (отсюда название — «веселящий газ»). При вдыхании чистого газа быстро развиваются состояние опьянения и сонливость. Закись азота обладает слабой наркотической активностью, в связи с чем в медицине её применяют в больших концентрациях. В смеси с кислородом при правильном дозировании (до 80 % закиси азота) вызывает хирургический наркоз.
Строение молекулы оксида азота (I) нельзя описать методом валентных связей. Так как оксид азота (I) состоит из двух, так называемых резонансных структур, которые переходят одна в другую:
Общую формулу в таком случае можно задать, обозначая изменяющиеся связи в резонансных структурах пунктиром:
Получить оксид азота (I) в лаборатории можно разложением нитрата аммония:
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Химические свойства оксида азота (I)
1. При нормальных условиях оксид азота (I) инертен. При нагревании проявляет свойства окислителя . Оксид азота (I) при нагревании окисляет водород, аммиак, металлы, сернистый газ и др. При этом азот восстанавливается в простое вещество.
N2O + Mg → N2 + MgO
Еще пример : оксид азота (I) окисляет углерод и фосфор при нагревании:
2. При взаимодействии с сильными окислителями N2O может проявлять свойства восстановителя.
Например , N2O окисляется раствором перманганата в серной кислоте:
3. Как несолеобразующий оксид, при обычных условиях с основаниями, основными оксидами, амфотерными оксидами, кислотными оксидами, кислотами и амфотерными гидроксидами оксид азота (I) не реагирует:
Видео:Химия | Молекулярные и ионные уравненияСкачать

Оксид азота (I, II, III, IV, V): свойства, получение, применение
Введение
Если внимательно взглянуть на азот в периодической системе химических элементов Д. И. Менделеева, то можно заметить, что он имеет переменную валентность. Это значит, что азот образует сразу несколько бинарных соединений с кислородом. Некоторые из них были открыты недавно, а некоторые — изучены вдоль и поперек. Существуют малостабильные и устойчивые оксиды азота. Химические свойства каждого из этих веществ совершенно разные, поэтому при их изучении нужно рассматривать как минимум пять оксидов азота. Вот о них и пойдет речь в сегодняшней статье.
Оксид азота (I)
В обычных условиях представлен бесцветным газом, имеющим сладковатый запах. Его могут растворять вода, этанол, эфир и серная кислота. Если газобразный оксид одновалентного азота нагреть до комнатной температуры под давлением 40 атмосфер, то он сгущается до бесцветной жидкости. Это несолеобразующий оксид, разлагающийся во время нагревания и показывающий себя в реакциях как восстановитель.
Этот оксид образуется, когда нагревают сухой нитрат аммония. Другой способ его получения — термическое разложение смеси «сульфаминовая + азотная кислота».
Используется в качестве средства для ингаляционного наркоза, пищевая промышленность знает этот оксид как добавку E942. С его помощью также улучшают технические характеристики двигателей внутреннего сгорания.
Оксид азота (II)
При нормальных условиях имеет вид бесцветного газа, который плохо растворяется в воде. Его трудно сжижить, однако в твердом и жидком состояниях это вещество имеет голубой цвет. Данный оксид может окисляться кислородом воздуха
Его довольно просто получить, для этого нужно нагреть до 1200-1300 о С смесь азота и кислорода. В лабораторных условиях он образуется сразу при нескольким опытах:
- Реакция меди и 30%-ного раствора азотной кислоты.
- Взаимодействие хлорида железа, нитрита натрия и соляной кислоты.
- Реакция азотистой и иодоводородной кислот.
Это одно из веществ, из которых получают азотную кислоту.
Оксид азота (III)
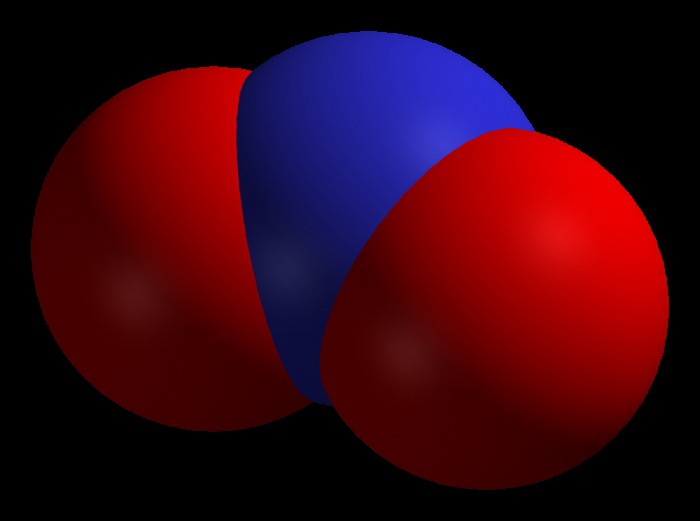
В нормальных условиях является жидкостью, которая имеет синий цвет, а в стандартных — бесцветным газом. Чистый оксид существует только в твердом агрегатном состоянии.
Образуется при взаимодействии 50%-ной азотной кислоты и твердого оксида трехвалентного мышьяка (его также можно заменить крахмалом).
С помощью этого вещества в лабораториях получают азотистую кислоту и ее соли.
Оксид азота (IV)
Последнее название соответствует одному из его свойств. Ведь этот оксид имеет вид или красно-бурого газа или желтоватой жидкости. Ему присуща высокая химическая активность.
Данный оксид получают при взаимодействии азотной кислоты и меди, а также во время термического разложения нитрата свинца.
С помощью него производят серную и азотную кислоты, окисляют жидкое ракетное топливо и смесевые взрывчатые вещества.
Оксид азота (V)
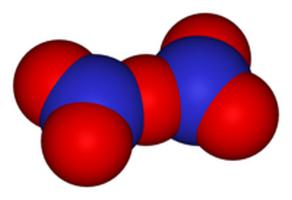
Имеет вид бецветных и очень летучих кристаллов. Они могут плавиться при температуре 32,3 о С.
Этот оксид образуется при нескольких реакциях:
- Дегидрация азотной кислоты оксидом пятивалентного фосфора.
- Пропускание сухого хлора над нитратом серебра.
- Взаимодействие озона с оксидом четырехвалентного азота.
Из-за своей крайней неустойчивости в чистом виде нигде не используется.
Заключение
В химии существует девять оксидов азота, приведенные выше являются только классическими соединениями этого элемента. Остальные четыре — это, как уже было сказано, нестабильные вещества. Однако их все объединяет одно свойство — высокая токсичность. Выбросы оксидов азота в атмосферу приводят к ухудшению состояния здоровья живущих поблизости от промышленных химических предприятий людей. Симптомы отравления каким-либо из этих веществ — токсический отек легких, нарушение работы центральной нервной системы и поражение крови, причина которого — связывание гемоглобина. Поэтому с оксидами азота необходимо осторожно обращаться и в большинстве случаев использовать средства защиты.
Видео:Оксиды азота. Оксид азота(I)Скачать

Оксиды азота
Азот образует несколько оксидов:
- солеобразующие оксиды:
- N2O3 — оксид азота (III)
- NO2 — оксид азота (IV)
- N2O4 — димер оксида азота (IV)
- N2O5 — оксид азота (V)
- несолеобразующие оксиды:
- N2O — оксид азота (I)
- NO — оксид азота (II)
Все оксиды азота, за исключением N2O, являются ядовитыми веществами.
Видео:ОКСИДЫ ХИМИЯ — Что такое Оксиды? Химические свойства Оксидов | Реакция ОксидовСкачать

Оксид азота N2O (I)
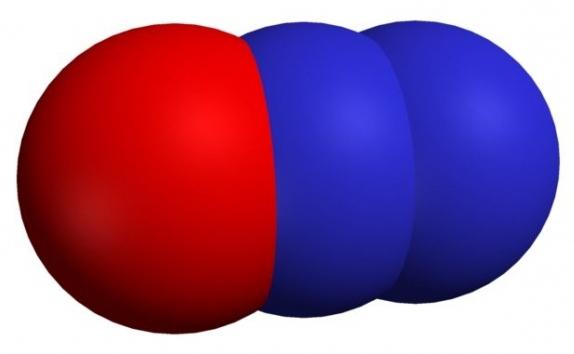
Строение молекулы линейное:
N2O (I) — бесцветный газ со слабым запахом и сладковатым вкусом.
- растворяется в воде, но не реагирует с ней;
- разлагается при слабом нагревании:
2N2O → 2N2+O2 - реагирует с водородом со взрывом:
N2O+H2 → N2+H2O - получают разложением нитрата аммония:
NH4NO3 → N2O+2H2O - применяют в смеси с кислородом в качестве «веселящего газа», как средство общего наркоза в медицине, а также для получения азидов:
N2O+NaNH2 → NaN3+H2O
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Оксид азота NO(II)
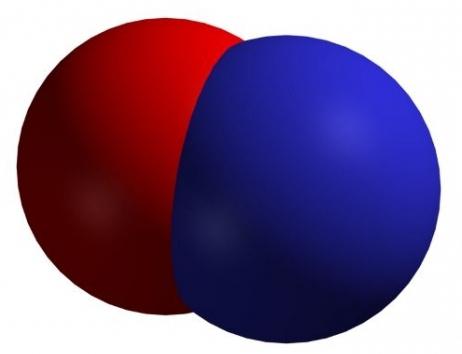
Молекула имеет вид:
Оксид азота NO(II) димеризуется (образуется новое вещество путём соединения двух структурных элементов) только при низких температурах.
- Бесцветный газ, без запаха.
- Малорастворим в воде.
- Легко окисляется на воздухе с образованием диоксида азота:
2NO+O2=2NO2. - Взаимодействует с другими окислителями (CrO3,Cl2, KMnO4).
- Реагирует с активными металлами, водородом:
K+NO=KNO
2NO+2H2=N2+2H2O
NO(II) содержится в выхлопных газах автомобилей с двигателями внутреннего сгорания — проходя через каталитический конвертор, состоящий из нагретых до высокой температуры керамических ячеек, оксиды азота восстанавливаются, а СО окисляется:
2NO+2CO → N2+2CO2
В природе NO(II) образуется во время грозы в результате взаимодействия азота с кислородом при высокой температуре:
N2+O2=2NO.
В промышленных целях NO(II) получают каталитическим окислением аммиака (в роли катализатора используется платина):
4N -3 H3+5O2 0 → 4N +2 O -2 +6H2O
В лабораторных условиях NO(II)получают действием разбавленной азотной кислотой на медь:
3Cu 0 +8HN +5 O3 = 3Cu +2 (NO3)2+2N -2 O↑+4H2O
Монооксид азота используют для получения азотной кислоты.
Видео:Опыты по химии. Получение оксида азота (II); окисление его кислородомСкачать

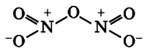
Оксид азота N2O3(III)
Связь N + -O — образована по донорно-акцепторному механизму.
Оксид азота N2O3(III) при н.у. является темно-синей жидкостью. При низких температурах (ниже -100°C) кристаллизуется.
Оксид азота N2O3(III) является кислотным оксидом, в значительной степени диссоциирует и реагирует со щелочами:
N2O3 ↔ NO2+NO
N2O3+2NaOH = 2NaNO2+H2O
Оксид азота N2O3(III) взаимодействует с водой с образованием азотистой кислоты:
N2O3+H2O = 2HNO2
Азотистая кислота является слабой кислотой, и существует только в водном растворе.
Соли азотистой кислоты — нитриты NaNO2, KNO2 являются устойчивыми соединениями, проявляя, как кислотные, так и восстановительные свойства, поскольку атом азота в них имеет «среднее» значение степени окисления (+3).
Видео:Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Оксид азота NO2(IV)
Связи N-O располагаются под углом друг к другу, при этом они носят промежуточный «полуторный» характер, при этом имеется еще и один неспаренный электрон, как и у NO (см. выше).
При н.у. оксид азота NO2(IV) является ядовитым газом (хорошо растворимым в воде) бурого цвета, с характерным запахом.
Оксид азота NO2(IV) — смешанный оксид, ему соответствуют две кислоты: азотистая и азотная, поэтому, реакция взаимодействия с водой имеет следующий вид:
2N +4 O2+H2O = HN +3 O2+HN +5 O3
При нагревании до 50°C неустойчивая азотистая кислота не образуется:
3NO2+H2O = 2HNO3+NO
На воздухе NO2 взаимодействует с водой с образованием только азотной кислоты:
4N +4 O2+O2 0 +2H2O ↔ 4HN +5 O3 -2
Оксид азота NO2(IV) взаимодействует с растворами щелочей с образованием воды и двух солей — нитрата и нитрита:
2N +4 O2+2NaOH = NaN +3 O2+NaN +5 O3+H2O
В избытке кислорода образуется только нитрат натрия:
4N +4 O2+4NaOH+O2 0 = 4NaN +5 O3 -2 +2H2O
При температуре ниже 22°C молекулы оксида азота NO2(IV) легко соединяются попарно (димеризуются), в результате чего образуется бесцветная жидкость, превращающаяся в кристаллы при дальнейшем охлаждении до температуры ниже -10,2°C.
В промышленных условиях оксид азота NO2(IV) получают путем окисления NO кислородом:
2NO+O2=2NO2
В лабораторных условиях оксид азота NO2(IV) получают окислением меди азотной кислотой (концентрированной), либо разложением нитрата свинца (меди):
Cu+4HNO3(конц) = Cu(NO3)2+2NO2↑+2H2O
2Pb(NO3)2 = 2PbO+4NO2↑+O2↑
Оксид азота NO2(IV) применяют в производстве азотной кислоты.
Видео:Химия 9 класс (Урок№14 - Азот: свойства и применение. Аммиак. Физические и химические свойства.)Скачать

Оксид азота N2O5(V)
Связи N + -O — образуются по донорно-акцепторному механизму: атом азота отдает электрон, играя роль донора и приобретая положительный заряд, атом кислорода присоединяет электрон, выступая в роли акцептора и приобретая отрицательный заряд. Атомы азота проявляют степень окисления +5 (валентность 4).
Оксид азота N2O5(V) (азотный ангидрид, пентаоксид диазота) является кристаллическим веществом белого цвета, легко разлагающееся при нормальных условиях:
2N2O5 = 4NO2+O2
Оксид азота N2O5(V) является кислотным оксидом, который при растворении в воде образует азотную кислоту:
N2O5+H2O = 2HNO3
Оксиды азота N2O3 и N2O5 практического применения не имеют.
Другие соединения азота:
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Код кнопки: 
Политика конфиденциальности Об авторе
📺 Видео
Применение ингаляционного оксида азотаСкачать

Упражнения для выработки Оксида АзотаСкачать

Оксиды азота. Оксид азота(II)Скачать

Оксиды азота. Физические свойства. Способы получения | ХимияСкачать

Проклятая химическая реакция 😜 #shortsСкачать

Оксиды азота для соткиСкачать

О НЁМ НЕ ГОВОРЯТ НА УРОКАХ ХИМИИ. ОКСИД АЗОТА (III)!Скачать

Азотная кислота на ОГЭ по химии | ОГЭ 2023 | УмскулСкачать

Оксиды азота. Оксид азота(V)Скачать

Оксиды азота. Оксид азота(IV)Скачать

Азот: химические свойства и особенности | Химия ОГЭ 2023 | УмскулСкачать

13. Химические свойства оксидов азотаСкачать