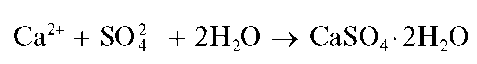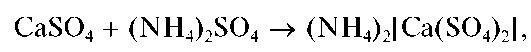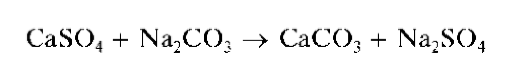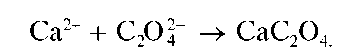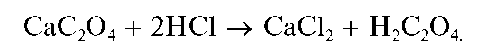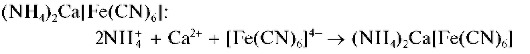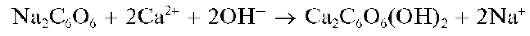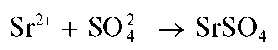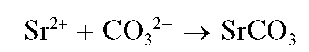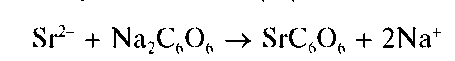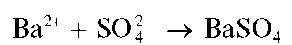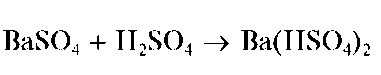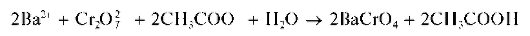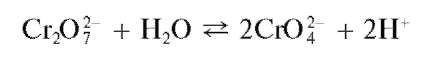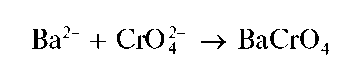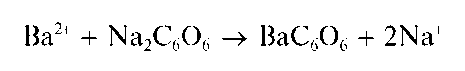| Оксалат кальция | |
|---|---|
 | |
| Систематическое наименование | Оксалат кальция |
| Традиционные названия | Щавелевокислый кальций |
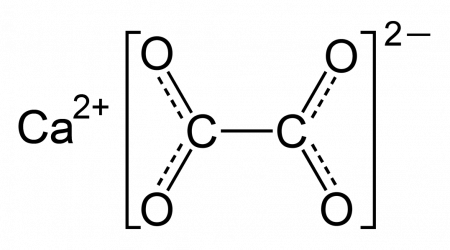
| Хим. формула | CaC2O4 |
| Рац. формула | CaC2O4 |
| Состояние | Бесцветные кристаллы |
| Молярная масса | 128,10 г/моль |
| Плотность | 2,2 г/см³ |
| Растворимость | |
| • в воде | 0,00067 18 г/100 мл |
| Рег. номер CAS | 25454-23-3 |
| PubChem | 16212978 |
| Рег. номер EINECS | 209-260-1 |
| SMILES | |
| ChEBI | 60579 |
| ChemSpider | 30549 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
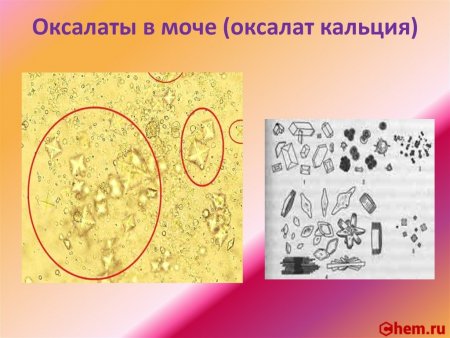
Оксалат кальция — соль щелочноземельного металла кальция и органической двухосновной щавелевой кислоты с формулой CaC2O4, бесцветные кристаллы, образует кристаллогидрат.
Видео:Взаимодействие карбоната кальция с соляной кислотой I ЕГЭ по химииСкачать

Содержание
Видео:ОКСИДЫ, КИСЛОТЫ, СОЛИ И ОСНОВАНИЯ ХИМИЯ 8 класс / Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Получение
- Обменными реакциями:
CaCl2 + (NH4)2C2O4 → CaC2O4↓ + 2NH4Cl
Видео:КИСЛОТЫ В ХИМИИ — Химические Свойства Кислот. Реакция Кислот с Основаниями, Оксидами и МеталламиСкачать

Физические свойства
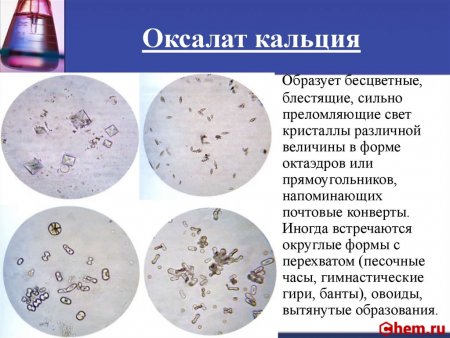
Оксалат кальция образует бесцветные кубические кристаллы. Из водных растворов образует кристаллогидрат CaC2O4•H2O — бесцветные моноклинные кристаллы. В литературе есть упоминание о кристаллогидрате CaC2O4•3H2O.
Видео:75. Ионные реакции в растворах электролитовСкачать

Химические свойства
Реагирует с сильными кислотами:
Чистую щавелевую кислоту можно получить, действуя серной кислотой на оксалат кальция.
Видео:Витамины при онкологии ОПАСНЫ? Рак и витамины группы ВСкачать

—>Аналитические группы катионов —>
III аналитическая группа: Ca 2+ ,Sr 2+ ,Ba 2+
При действии группового реагента (водного раствора серной кислоты ^SO.j) катионы третьей аналитической группы осаждаются в виде малорастворимых в воде сульфатов кальция CaSO4,стронцияSrSO4 и бария BaSO4 (свинец осаждается в виде сульфата PbSO4). Числовые значения произведений растворимости этих сульфатов при комнатной температуре равны: Ks°(CaSO4) = 2,5 10 -5 ,Ks° (SrSO4) = 3,2 10 -7 , Ks°(BaSO4) = 1,110 -10 ,Ks°(PbSO4) = 1,6 10 -8 . При действии группового реагента катионы кальция неполностью осаждаются из водного рас-творавформеосадкасульфата кальция — частьионов Ca 2 + остается в растворе. Для более полного осаждения катионов кальция в форме сульфата кальция при действии группового реагента к анализируемому раствору прибавляют этанол, в присутствии которого растворимость сульфата кальция уменьшается.
Сульфаты кальция, стронция и бария практически нерастворимы в разбавленных кислотах, щелочах. Сульфат бария заметно растворяется в концентрированной серной кислоте с образованием кислой соли Ba(HSO4)2 Сульфат кальция растворим в водном растворе сульфата аммония (NH4)2SO4 с образованием комплекса (NH4)2[Ca(SO4)2]; сульфаты стронция и бария — не растворяются.
Аналитические реакции катиона кальция Ca 2+
Реакция с сульфат-ионами. Катионы кальция образуют с сульфат-ионами SO4 2- белый осадок малорастворимого в воде сульфата кальция, который при медленной кристаллизации выделяется в форме игольчатых кристаллов гипса — дигидрата сульфата кальция-CaSO4*2H2O:
Для увеличения полноты осаждения к раствору прибавляют равный объем этанола — в водно-этанольной среде растворимость сульфата кальция уменьшается по сравнению с растворимостью в чистой воде.
Осадок сульфата кальция нерастворим в кислотах и щелочах, но растворяется в насыщенном водном растворе сульфата аммония с образованием комплекса (NH4)2[Ca(SO4)2]:
что позволяет отделить катионы Ca 2+ от катионов Sr 2+ иBa 2+ .
При нагревании с растворимыми карбонатами, например, с раствором соды Na2CO3, белый осадок сульфата кальция переходит в белый же осадок карбоната кальция:
Карбонат кальция растворим в кислотах, поэтому нагревание CaSO4 с раствором соды с последующим растворением образующегося CaCO3 используют для отделения катионов кальция (вместе с катионами стронция и бария) от других катионов и перевода их в раствор.
Реакцию катионов кальция с сульфат-ионами обычно проводят как микрокристаллоскопическую. Предельное разбавление равно 2,5-10 4 мл/г.
Методика. Каплю раствора хлорида кальция CaCl2 наносят на предметное стекло, прибавляют каплю раствора серной кислоты и слегка упаривают смесь. Под микроскопом наблюдают образовавшиеся игольчатые кристаллы гипса CaSO4•2H2Oв виде красивых сросшихся пучков или звездочек.
Реакция с оксалатом аммония (фармакопейная). Катионы Ca 2+ образуют с оксалатом аммония (NH4)2C2O4 белый кристаллический осадок оксалата кальция CaC2O4:
Реакцию проводят в слабокислой среде (рН = 6-6,5) в присутствии уксусной кислоты, в которой оксалат кальция не растворяется. В конце проведения реакции можно добавить аммиак.
Осадок CaC2O4 нерастворим в растворе аммиака, но растворяется в разбавленных минеральных кислотах с образованием щавелевой кислоты H2C2O4, например:
Открываемый минимум — около 100 мкг, предельное разбавление — 6 10 4 мл/г (подругимданным
Мешают катионы Sr 2+ ,Ba 2+ ,Mg 2+ , дающие аналогичные осадки.
Методика. В пробирку вносят 3 капли раствора CaCl2, прибавляют каплю раствора уксусной кислоты и 3 капли раствора оксалата аммония. Выпадает белый кристаллический осадок оксалата кальция.
Реакция с гексацианоферратом(П) калия. Катионы Ca 2+ образуют с гексацианоферратом(П) калия K4[Fe(CN)6] при нагревании раствора до кипения в присутствии катионов аммония белый кристаллический осадок смешанного гексацианоферрата(П) аммония и кальция Осадок нерастворим в уксусной кислоте.
Открываемый минимум равен 25 мкг, предельное разбавление — 2-10 3 мл/г.
Мешают катионы Ba 2+ и другие катионы, образующие осадки фер-роцианидов.
Методика. В пробирку вносят 3-4 капли насыщенного водного раствора CaCl2, 2-3 капли раствора аммиака. Нагревают раствор до кипения и прибавляют 5-6 капель свежеприготовленного насыщенного раствора K4[Fe(CN)6]. Выпадает белый кристаллический осадок.
Реакция сродизонатом натрия. Катионы Ca 2+ образуют со свежеприготовленным раствором родизоната натрия Na2C6O6 в щелочной среде осадок фиолетового комплекса, состав которого, по-видимому, можно описать формулой Ca2C6O6(OH)2:
Реакция довольно чувствительна: предел обнаружения — 1 мкг, предельное разбавление — 5-10 4 мл/г. Катионы Sr 2+ иBa 2+ не мешают, так как в щелочной среде не образуют осадки с родизонатом натрия.
Реакцию можно проводить капельным методом на фильтровальной бумаге.
Методика. В пробирку вносят 3-4 капли раствора CaCl2,3-4 капли раствора NaOH и
2 капли свежеприготовленного 0,2 % раствора ро-дизоната натрия. Выпадает фиолетовый осадок.
При проведении реакции на фильтровальной бумаге поступают следующим образом. На лист фильтровальной бумаги наносят каплю щелочного раствора CaCl2 и каплю свежеприготовленного 0,2 % раствора Na2C6O6 Образуется пятно (или осадок) фиолетового цвета.
Окрашивание пламени газовой горелки (фармакопейный тест). Соли (или другие соединения) кальция окрашивают пламя газовой горелки в кирпично-красный цвет.
Методика. На кончике платиновой или нихромовой проволоки, смоченной раствором HCl, вносят в пламя газовой горелки несколько кристалликов соли кальция или каплю раствора CaCl2 Пламя окрашивается в кирпично-красный цвет.
Другие реакции катионов кальция. Катионы Ca 2+ образуют также осадки при реакциях в растворах: с растворимыми карбонатами — белый осадок CaCO3 (растворяется в кислотах), с гидрофосфатом натрия
Na2HPO4 — белый CaHPO4 (растворяется в кислотах), с хроматами — желтый CaCrO4, с фторидами — белый студенистый CaF2 (малорастворимый в кислотах и разлагающийся при нагревании с концентрированной серной кислотой).
Аналитические реакции катиона стронция Sr 2+
Реакция с сульфат-ионами. Катионы Sr 2+ образуют с сульфат-ионами белый осадок сульфата стронция SrSO4:
Осадок нерастворим в щелочах, в растворе сульфата аммония (NH4)2SO4 (в отличие от сульфата кальция, который растворяется в этом реагенте).
Осадок сульфата стронция образуется и при прибавлении «гипсовой воды» (насыщенный водный раствор сульфата кальция) к растворам, содержащим соли стронция, поскольку растворимость в воде сульфата стронция ниже растворимости сульфата кальция. Добавление «гипсовой воды» приводит к образованию осадка SrSO4 лишь при нагревании; без нагревания осадок SrSO4 выделяется только при длительном стоянии. Мешают катионы Ba 2+ .
При нагревании осадка SrSO4 с раствором соды он, как и сульфат кальция, переходит в карбонат стронция SrCO3, также нерастворимый в кислотах.
а) Реакция с «гипсовой водой». В пробирку вносят 4 капли раствора хлорида стронция SrCl2, прибавляют 5-6 капель «гипсовой воды», нагревают на водяной бане и оставляют на
10-15 минут. Постепенно выделяется белый осадок сульфата стронция.
б) Реакция с серной кислотой. В пробирку вносят 1-2 капли раствора SrCl2, прибавляют 2-3 капли раствора серной кислоты. Выпадает белый кристаллический осадок сульфата стронция.
Реакция с карбонат-ионами. Катионы Sr 2+ образуют при нагревании с карбонат-ионами CO3 2- белый кристаллический осадок карбоната стронция:
Осадок растворяется в кислотах.
Методика. В пробирку вносят 3-5 капель раствора SrCl2,прибавля-ют столько же капель раствора карбоната аммония (NH4)2CO3 иосто-рожно нагревают пробирку с раствором. Выпадает белый осадок карбоната стронция.
Реакция с родизонатом натрия. Катионы Sr 2+ образуют с родизона-том натрия Na2C6O6 в нейтральной среде бурый осадок родизоната стронция, по-видимому, состава SrC6O6:
Реакцию проводят капельным методом на фильтровальной бумаге. Предел обнаружения — 7 мкг.
Катионы бария также образуют бурый осадок с родизонатом натрия. Однако родизонат стронция, в отличие от родизоната бария, растворим в хлороводородной кислоте, тогда как родизонат бария при взаимодействии с HO превращается в ярко-красный гидрородизонат бария.
Методика. На лист фильтровальной бумаги наносят каплю раствора SrCl2 и каплю свежеприготовленного 0,2 % раствора родизоната натрия. Наблюдается образование красно-бурого пятна.
На пятно наносят каплю раствора HO. Окраска пятна исчезает (в присутствии катионов бария окраска не исчезает, а переходит из бурой в ярко-красную).
Окрашивание пламени газовой горелки. Соли (и другие соединения) стронция при внесении в бесцветное пламя газовой горелки окрашивают пламя в карминово-красный цвет. Методика аналогична описанной выше для теста на другие катионы.
Другие реакции катионов стронция. Катионы Sr 2+ образуют также осадки при реакциях в растворах: c оксалатом аммония (NH4)2C2O4 — белый SrC2O4 (частично растворяется в уксусной кислоте), с гидрофосфатом натрия Na2HPO4 — белый SrHPO4 (растворяется в кислотах), с хроматом калия K2CrO4 — желтый SrCrO4 (растворяется в уксусной кислоте; реакция высокочувствительна: предел обнаружения — 0,8 мкг).
Применяют также довольно чувствительную (предельное разбавление — 10 4 мл/г) микрокристаллоскопическую реакцию образования сине-зеленых кубических кристаллов K2Sr[Cu(NO2)6].
Аналитические реакции катионов бария Ba 2+
Катионы бария Ba 2+ образуют с сульфат-ионами белый кристаллический осадок сульфата бария BaSO4:
Осадок нерастворим в щелочах и кислотах, за исключением концентрированной серной кислоты, в которой он заметно растворяется с образованием гидросульфата бария Ba(HSO4)2:
При нагревании с растворами карбонатов (например, соды Na2CO3) сульфат бария превращается в малорастворимый в воде карбонат бария BaCO3, который растворяется в кислотах.
Предел обнаружения каионов бария данной реакцией составляет 10 мкг. Мешают катионы Ca 2+ ,Sr 2+ ,Pb 2+ .
Методика. В пробирку вносят 2-3 капли раствора BaCl2,прибавля-ют по каплям раствор H2SO4 Выпадает белый мелкокристаллический осадок сульфата бария.
Реакция с дихромат-ионами. Катионы Ba 2+ образуют с дихромат-ионами Cr2O7 2- в присутствии ацетат-ионов желтый осадок хромата бария BaCrO4:
Образование хромата бария BaCrO4, а не дихромата BaCr2O7,вэтой реакции объясняется тем, что хромат бария менее растворим в воде, чем дихромат бария.
В водных растворах дихроматов устанавливается равновесие
В присутствии катионов Ba 2+ образуется и выпадает в осадок малорастворимый хромат BaCrO4,тогда как дихроматBa2Cr2O7 в осадок не выпадает вследствие его более высокой растворимости. В результате равновесие смещается вправо, и в растворе накапливаются ионы водорода, что, однако, препятствует более глубокому смещению равновесия. Поэтому для нейтрализации ионов водорода в раствор вводят ацетат натрия CH3COONa. Ацетат-ионы CH3COO — , образующиеся при электролитической диссоциации ацетата натрия, связывают ионы водорода в малодиссоциированную слабую уксусную кислоту CH3COOH, вследствие чего равновесие образования хромат-ионов из дихромат-ионов смещается вправо. При этом возрастает полнота осаждения хромата бария.
Осадок хромата бария растворяется в сильных кислотах, но не растворяется в уксусной кислоте.
Мешают Ag + ,Pb 2+ ,Cd 2+ ,Co 2+ ,Ni 2+ и другие катионы, дающие осадки хроматов. Катионы Ca 2+ ,Sr 2+ не мешают открытию катионов бария.
Методика. В пробирку вносят 5 капель раствора BaCl2, прибавляют 5 капель раствора дихромата калия K2Cr2O7 и 4-5 капель раствора ацетата натрия CH3COONa. Выпадает желтый кристаллический осадок хромата бария.
Хромат бария образуется также при реакции катионов Ba 2+ с хромат-ионами:
Однако при реакции с дихромат-ионами в присутствии ацетат-ионов катионы бария осаждаются практически количественно.
Реакция с родизонатом натрия. Катионы Ba 2+ реагируют с родизона-том натрия Na2C6O6 в нейтральной среде с образованием красно-бурого осадка родизоната бария:
При прибавлении раствора хлороводородной кислоты красно-бурый осадок родизоната бария превращается в ярко-красный гидроро-дизонат бария Ba (HC6O6)2.
Предел обнаружения — 0,25 мкг. Мешают катионы Pb 2+ .
Реакцию проводят капельным методом на фильтровальной бумаге. Методика аналогична описанной для реакции катионов стронция с родизонатом натрия.
Окрашивание пламени газовой горелки. Соли и другие соединения бария окрашивают пламя газовой горелки в желто-зеленый цвет. Методика — такая же, как и в других вышеописанных случаях.
Другие реакции катионов бария. Катионы Ba 2+ образуют также осадки при реакциях: с растворимыми оксалатами — белый BaC2O4 (растворяется в HCl, HNO3, при нагревании — также и в CH3COOH); с гидрофосфатом натрия Na2HPO4 — белый BaHPO4 (растворяется в кислотах); с растворимыми карбонатами — белый BaCO3 (растворяется в кислотах); с сульфитами — белый BaSO3 (растворяется в кислотах).
Катионы Ba 2+ образуют окрашенные комплексы с некоторыми органическими реагентами, например, с 8-оксихинолином (желто-зеленый), с сульфоназом III (сине-зеленый) и др.
🔍 Видео
Химия 8 класс Взаимодействие карбоната натрия и соляной кислотыСкачать

Хлороводородная кислота. 9 класс.Скачать

Реакция карбоната кальция и соляной кислотыСкачать

ОСНОВАНИЯ В ХИМИИ — Химические свойства оснований. Реакции оснований с кислотами и солямиСкачать

Химия 8 класс. Хлороводород и соляная кислотаСкачать

Соляная кислота. Свойства и особенности. То чего вы не знали.Скачать

Практическая работа №2 Изучение свойств соляной кислотыСкачать

Степень электролитической диссоциации. Сильные и слабые электролиты. 9 класс.Скачать

Опыты по химии. Соляная кислота и металлыСкачать

Реакция нейтрализации гидроксида натрия соляной (хлороводородной) кислотойСкачать

Решение задач по уравнениям реакций, если одно из реагирующих веществ взято в избытке. 1 ч. 9 класс.Скачать

Zn + 2HCl → ZnCl2 + H2 | Реакция цинка и соляной кислотыСкачать

Получение ОКСИДА КАЛЬЦИЯ. Разложение КАРБОНАТА КАЛЬЦИЯ ( МЕЛА). Реакция с водой. Опыты по химииСкачать

Овсянка вымывает кальций, повышает сахар и разрушает организм?Скачать

Получение соляной кислотыСкачать