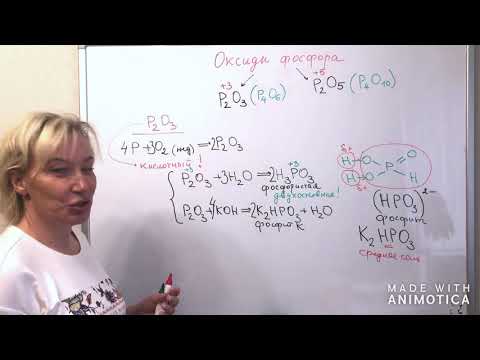- Фосфор
- Положение в периодической системе химических элементов
- Электронное строение фосфора
- Физические свойства и нахождение в природе
- Соединения фосфора
- Способы получения фосфора
- Химические свойства фосфора
- Фосфин
- Строение молекулы и физические свойства
- Способы получения фосфина
- Химические свойства фосфина
- Фосфиды
- Способы получения фосфидов
- Химические свойства фосфидов
- Оксиды фосфора
- Оксид фосфора (III)
- Оксид фосфора (V)
- Фосфорная кислота
- Строение молекулы и физические свойства
- Способы получения
- Химические свойства
- Фосфористая кислота
- Соли фосфорной кислоты — фосфаты
- Фосфор. Фосфин
- Фосфор
- Химические свойства
- Применение фосфора
- Фосфин
- Скачать:
- Похожее
- Добавить комментарий Отменить ответ
- Фосфор
- 🎦 Видео
Фосфор
Положение в периодической системе химических элементов
Фосфор расположен в главной подгруппе V группы (или в 15 группе в современной форме ПСХЭ) и в третьем периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение фосфора
Электронная конфигурация фосфора в основном состоянии :
Атом фосфора содержит на внешнем энергетическом уровне 3 неспаренных электрона и одну неподеленную электронную пару в основном энергетическом состоянии. Следовательно, атом фосфора может образовывать 3 связи по обменному механизму. Однако, в отличие от азота, за счет вакантной 3d орбитали атом фосфора может переходить в возбужденное энергетическое состояние.
Электронная конфигурация фосфора в возбужденном состоянии:
При этом один электрон из неподеленной электронной пары на 3s-орбитали переходит на переходит на 3d-орбиталь. Для атома фосфора в возбужденном энергетическом состоянии характерна валентность V.
Таким образом, максимальная валентность фосфора в соединениях равна V (в отличие от азота). Также характерная валентность фосфора в соединениях — III.
Степени окисления атома фосфора – от -3 до +5. Характерные степени окисления -3, 0, +1, +3, +5.
Физические свойства и нахождение в природе
Фосфор образует различные простые вещества (аллотропные модификации).
Белый фосфор — это вещество состава P4. Мягкий, бесцветный, ядовитый, имеет характерный чесночный запах. Молекулярная кристаллическая решетка, а следовательно, невысокая температура плавления (44°С), высокая летучесть. Очень реакционно способен, самовоспламеняется на воздухе.
Покрытие бумаги раствором белого фосфора в сероуглероде. Спустя некоторое время, когда сероуглерод испаряется, фосфор воспламеняет бумагу (процесс лег в основу различных фокусов с самовозгоранием или получением огня из ничего):
Белый фосфор можно расплавить в ёмкости с тёплой водой, поскольку он имеет температуру плавления в 44,15 °C.
Красный фосфор – это модификация с атомной кристаллической решеткой . Формула красного фосфора Pn, это полимер со сложной структурой. Твердое вещество без запаха, красно-бурого цвета, не ядовитое. Это гораздо более устойчивая модификация, чем белый фосфор. В темноте не светится. Образуется из белого фосфора при t=250-300 о С без доступа воздуха.
Черный фосфор – то наиболее стабильная термодинамически и химически наименее активная форма элементарного фосфора. Чёрный фосфор — это чёрное вещество с металлическим блеском, жирное на ощупь и весьма похожее на графит, полностью нерастворимое в воде или органических растворителях.
Известны также такие модификации, как желтый фосфор и металлический фосфор. Желтый фосфор – это неочищенный белый фосфор. При очень высоком давлении фосфор переходит в новую модификацию – металлический фосфор , который очень хорошо проводит электрический ток.
В природе фосфор встречается только в виде соединений. В основном это апатиты (например, Ca3(PO4)2), фосфориты и др. Фосфор входит в состав важнейших биологических соединений —фосфолипидов.
Соединения фосфора
Типичные соединения фосфора:
| Степень окисления | Типичные соединения |
| +5 | оксид фосфора (V) P2O5 ортофосфорная кислота H3PO4 метафосфорная кислота HPO3 Галогенангидриды: PОCl3, PCl5 |
| +3 | Оксид фосфора (III) P2O3 Галогенангидриды: PCl3 |
| +1 | Фосфорноватистая кислота H3PO2 Соли фосфорноватистой кислоты — гипофосфиты: MeH2PO2 |
| -3 | Фосфин PH3 Фосфиды металлов MeP |
Способы получения фосфора
1. Белый фосфор получают из природных фосфатов , прокаливая их с коксом и песком в электрической печи:
2. Вместо фосфатов можно использовать другие неорганические соединения фосфора, например , метафосфорную кислоту.
4HPO3 + 10C → P4 + 2H2O + 10 CO
3. Красный и черный фосфор получают из белого фосфора.
Химические свойства фосфора
При нормальных условиях фосфор довольно химически активен.
1. Фосфор проявляет свойства окислителя (с элементами, которые расположены ниже и левее в Периодической системе) и свойства восстановителя (с элементами, расположенными выше и правее). Поэтому фосфор реагирует с металлами и неметаллами .
1.1. При взаимодействии с кислородом воздуха образу
ются оксиды – ангидриды соответствующих кислот :
Горение белого фосфора:
Горение красного фосфора:
1.2. При взаимодействии фосфора с галогенами образуются галогениды с общей формулой PHal3 и PHal5:
Фосфор реагирует с бромом:
1.3. При взаимодействии фосфора с серой образуются сульфиды:
1.4. При взаимодействии с металлами фосфор проявляет свойства окислителя, продукты реакции называют фосфидами.
Например , кальций и магний реагируют с фосфором с образованием фосфидов кальция и магния:
Еще пример : натрий взаимодействует с фосфором с образованием фосфида натрия:
P + 3Na → Na3P
1.5. С водородом фосфор непосредственно не взаимодействует.
2. Со сложными веществами фосфор реагирует, проявляя окислительные и восстановительные свойства. Фосфор диспропорционирует при взаимодействии с некоторыми веществами.
2.1. При взаимодействии с окислителями фосфор окисляется до оксида фосфора (V) или до фосфорной кислоты.
Например , азотная кислота окисляет фосфор до фосфорной кислоты:
Серная кислота также окисляет фосфор:
Соединения хлора, например , бертолетова соль , также окисляют фосфор:
Реакция красного фосфора с бертолетовой солью. Этот процесс заложен в принципе возгорания спички при трении её о шершавую поверхность коробка.
Некоторые металлы-сильные окислители также окисляют фосфор. Например , оксид серебра (I) :
2.2. При растворении в щелочах фосфор диспропорционирует до гипофосфита и фосфина.
Например , фосфор реагирует с гидроксидом калия:
Или с гидроксидом кальция:
Фосфин
Строение молекулы и физические свойства
Фосфин PH3 – это бинарное соединение водорода с фосфором, относится к летучим водородным соединениям. Следовательно, фосфин газ, с неприятным запахом, бесцветный, мало растворимый в воде, химически нестойкий и ядовитый. Водородные связи между молекулами фосфина не образуются. В твердом состоянии имеет молекулярную кристаллическую решетку.
Геометрическая форма молекулы фосфина похожа на структуру аммиака — правильная треугольная пирамида. Но валентный угол H-P-H меньше, чем угол H-N-H в аммиаке и составляет 93,5 о .
У атома фосфора в фосфине на внешнем энергетическом уровне остается неподеленная электронная пара. Эта электронная пара оказывает значительное влияние на свойства фосфина, а также на его структуру. Электронная структура фосфина — тетраэдр , с атомом фосфора в центре.
Способы получения фосфина
В лаборатории фосфин получают водным или кислотным гидролизом фосфидов – бинарных соединений фосфора и металлов.
Например , фосфин образуется при водном гидролизе фосфида кальция:
Или при кислотном гидролизе, например , фосфида магния в соляной кислоте:
Еще один лабораторный способ получения фосфина – диспропорционирование фосфора в щелочах.
Например , фосфор реагирует с гидроксидом калия с образованием гипофосфита калия и фосфина:
Химические свойства фосфина
1. В водном растворе фосфин проявляет очень слабые основные свойства (за счет неподеленной электронной пары). Принимая протон (ион H + ), он превращается в ион фосфония. Основные свойства фосфина гораздо слабее основных свойств аммиака. Проявляются при взаимодействии с безводными кислотами .
Например , фосфин реагирует с йодоводородной кислотой:
Соли фосфония неустойчивые, легко гидролизуются.
2. Фосфин PH3 – сильный восстановитель за счет фосфора в степени окисления -3. На воздухе самопроизвольно самовоспламеняется:
3. Как сильный восстановитель, фосфин легко окисляется под действием окислителей.
Например , азотная кислота окисляет фосфин. При этом фосфор переходит в степень окисления +5 и образует фосфорную кислоту.
Серная кислота также окисляет фосфин:
С фосфином также реагируют другие соединения фосфора, с более высокими степенями окисления фосфора.
Например , хлорид фосфора (III) окисляет фосфин:
2PH3 + 2PCl3 → 4P + 6HCl
Фосфиды
Фосфиды – это бинарные соединения фосфора и металлов или некоторых неметаллов .
Способы получения фосфидов
Фосфиды получают при взаимодействии фосфора с металлами . При этом фосфор проявляет свойства окислителя.
Например , фосфор взаимодействует с магнием и кальцием:
Фосфор взаимодействует с натрием:
P + 3Na → Na3P
Химические свойства фосфидов
1. Фосфиды легко разлагаются водой или кислотами с образованием фосфина.
Например , фосфид кальция разлагается водой:
Фосфид магния разлагается соляной кислотой:
2. Фосфиды металлов проявляют сильные восстановительные свойства за счет фосфора в степени окисления -3 .
Оксиды фосфора
| Оксиды азота | Цвет | Фаза | Характер оксида |
| P2O3 Оксид фосфора (III), фосфористый ангидрид | белый | твердый | кислотный |
| P2O5 Оксид фосфора(V), фосфорный ангидрид | белый | твердый | кислотный |
Оксид фосфора (III)
Оксид фосфора (III) – это кислотный оксид . Белые кристаллы при обычных условиях. Пары состоят из молекул P4O6.
Получить оксид фосфора (III) можно окислением фосфора при недостатке кислорода :
Химические свойства оксида фосфора (III):
Оксид фосфора (III) очень ядовит и неустойчив. Для P2O3 (P4O6) характерны два типа реакций.
1. Поскольку фосфор в оксиде фосфора (III) проявляет промежуточную степень окисления, то он принимает участие в окислительно-восстановительных процессах, повышая либо понижая степень окисления атома фосфора. Характерны для P2O3 реакции диспропорционирования.
Например , оксид фосфора (III) диспропорционирует в горячей воде:
2. При взаимодействии с окислителями P2O3 проявляет свойства восстановителя.
Например , N2O окисляется кислородом:
3. С другой стороны Р2О3 проявляет свойства кислотного оксида (ангидрид фосфористой кислоты), взаимодействуя с водой с образованием фосфористой кислоты:
а со щелочами – с образованием солей (фосфитов):
Оксид фосфора (V)
Оксид фосфора (V) – это кислотный оксид. В нормальных условиях образует белые кристаллы. В парах состоит из молекул P4О10. Очень гигроскопичен (используется как осушитель газов и жидкостей).
Способы получения. Оксид фосфора (V) получают сжиганием фосфора в избытке кислорода.
Химические свойства.
1. Оксид фосфора (V) – очень гигроскопичное вещество, которое используется для осушения газов. Обладая высоким сродством к воде, оксид фосфора (V) дегидратирует до ангидридов неорганические и органические кислоты.
Например , оксид фосфора (V) дегидратирует серную, азотную и уксусную кислоты:
2. Фосфорный ангидрид является типичным кислотным оксидом , взаимодействует с водой с образованием фосфорных кислот:
В зависимости от количества воды и от других условий образуются мета-фосфорная, орто-фосфорная или пиро-фосфорная кислота:
Видеоопыт взаимодействия оксида фосфора с водой можно посмотреть здесь.
3. Как кислотный оксид, оксид фосфора (V) взаимодействует с основными оксидами и основаниями .
Например , оксид фосфора (V) взаимодействует с гидроксидом натрия. При этом образуются средние или кислые соли:
Еще пример : оксид фосфора взаимодействует с оксидом бария (при сплавлении):
Фосфорная кислота
Строение молекулы и физические свойства
Фосфор в степени окисления +5 образует несколько кислот: орто-фосфорную H3PO4, мета-фосфорную HPO3, пиро-фосфорную H4P2O7.
Фосфорная кислота H3PO4 – это кислота средней силы, трехосновная, прочная и нелетучая. При обычных условиях фосфорная кислота – твердое вещество, хорошо растворимое в воде и гигроскопичное.
Валентность фосфора в фосфорной кислоте равна V.
При температуре выше +213 °C орто-фосфорная кислота переходит в пирофосфорную H4P2O7.
При взаимодействии высшего оксида фосфора с водой на холоде образуется метафосфорная кислота HPO3, представляющая собой прозрачную стекловидную массу.
Способы получения
Наибольшее практическое значение из фосфорных кислот имеет орто-фосфорная кислота.
1. Получить орто-фосфорную кислоту можно взаимодействием оксида фосфора (V) с водой:
2. Еще один способ получения фосфорной кислоты — вытеснение фосфорной кислоты из солей (фосфатов, гидрофосфатов и дигидрофосфатов) под действием более сильных кислот (серной, азотной, соляной и др.) .
Промышленный способ получения фосфорной кислоты обработка фосфорита концентрированной серной кислотой:
3. Фосфорную кислоту также можно получить жестким окислением соединений фосфора в водном растворе в присутствии кислот.
Например , концентрированная азотная кислота окисляет фосфор до фосфорной кислоты:
Химические свойства
Фосфорная кислота – это кислота средней силы (по второй и третьей ступени слабая) .
1. Фосфорная кислота частично и ступенчато диссоциирует в водном растворе.
HPO4 2– ⇄ H + + PO4 3–
2. Фосфорная кислота реагирует с основными оксидами, основаниями, амфотерными оксидами и амфотерными гидроксидами.
Например , фосфорная кислота взаимодействует с оксидом магния:
Еще пример : при взаимодействии фосфорной кислоты с гидроксидом калия образуются фосфаты, гидрофосфаты или дигидрофосфаты:
3. Фосфорная кислота вытесняет более слабые кислоты из их солей (карбонатов, сульфидов и др.). Также фосфорная кислота вступает в обменные реакции с солями.
Например , фосфорная кислота взаимодействует с гидрокарбонатом натрия:
4. При нагревании H3PO4 до 200°С происходит отщепление от нее молекулы воды с образованием пирофосфорной кислоты H2P2O7:
5. Фосфорная кислота взаимодействует с металлами, которые расположены в ряду активности металлов до водорода. При этом образуются соль и водород.
Например , фосфорная кислота реагирует с магнием:
Фосфорная кислота взаимодействует также с аммиаком с образованием солей аммония:
7. Качественная реакция на фосфат-ионы и фосфорную кислоту — взаимодействие с нитратом серебра. При этом образуется ярко-желтый осадок фосфата серебра:
Видеоопыт взаимодействия фосфата натрия и нитрата серебра в растворе (качественная реакция на фосфат-ион) можно посмотреть здесь.
Фосфористая кислота
Фосфористая кислота H3PO3 — это двухосновная кислородсодержащая кислота. При нормальных условиях бесцветное кристаллическое вещество, хорошо растворимое в воде.
Валентность фосфора в фосфористой кислота равна V, а степень окисления +3.
Получение фосфористой кислоты.
Фосфористую кислоту можно получить гидролизом галогенидов фосфора (III).
Например , гидролизом хлорида фосфора (III):
Фосфористую кислоту можно получить также взаимодействием оксида фосфора (III) с водой:
Химические свойства.
1. Фосфористая кислота H3PO3 в водном растворе — двухосновная кислота средней силы. Взаимодействует с основаниями с образованием солей-фосфитов.
Например , при взаимодействии с гидроксидом натрия фосфористая кислота образует фосфит натрия:
2. При нагревании фосфористая кислота разлагается на фосфин (Р -3 ) и фосфорную кислоту (Р +5 ):
3. За счет фосфора в степени окисления +3 фосфористая кислота проявляет восстановительные свойства .
Например , H3PO3 окисляется перманганатом калия в кислой среде:
Еще пример : фосфористая кислота окисляется соединениями ртути (II):
Соли фосфорной кислоты — фосфаты
Фосфорная кислота образует разные типы солей: средние – фосфаты, кислые – гидрофосфаты, дигидрофосфаты.
1. Качественная реакция на фосфаты — взаимодействие с нитратом серебра. При этом образуется желтый осадок фосфата серебра.
2. Нерастворимые фосфаты растворяются под действием сильных кислот, либо под действием фосфорной кислоты.
Например , фосфат кальция реагирует с фосфорной кислотой с образованием дигидрофосфата кальция:
Фосфат кальция растворяется под действием серной кислоты:
3. За счет фосфора со степенью окисления +5 фосфаты проявляют слабые окислительные свойства и могут взаимодействовать с восстановителями.
Например , фосфат кальция при сплавлении реагирует с углеродом с образованием фосфида кальция и угарного газа:
Фосфат кальция также восстанавливается алюминием при сплавлении:
4. Гидрофосфаты могут взаимодействовать и с более сильными кислотами, и с щелочами . Под действием фосфорной кислоты гидрофосфаты переходят в дигидрофосфаты.
Например , гидрофосфат калия взаимодействует с фосфорной кислотой с образованием дигидрофосфата калия:
Под действием едкого кали гидрофосфат калия образует более среднюю соль — фосфат калия:
5. Дигидрофосфаты могут взаимодействовать с более сильными кислотами и щелочами , но не реагируют с фосфорной кислотой.
Например , дигидрофосфат натрия взаимодействует с избытком гидроксида натрия с образованием фосфата:
Видео:Химия фосфора | Химия ЕГЭ | УмскулСкачать

Фосфор. Фосфин
Фосфор
Следующий за азотом элемент пятой группы, фосфор, был открыт на несколько столетий раньше своего предшественника по подгруппе. По иронии судьбы фосфор открывали несколько раз, причём всякий раз получали его из мочи. Есть упоминания о том, что арабский алхимик Альхильд Бехиль открыл фосфор при перегонке мочи в смеси с глиной, известью и углём. Однако достоверное открытие и описание свойств этого вещества принадлежит немецкому алхимику-любителю Хеннигу Бранду. В 1669 г. Бранд был занят поиском магической жидкости, с помощью которой можно превращать неблагородные металлы в золото. В одном из экспериментов он пытался получить ее из большого количества мочи, предварительно собранной в солдатских казармах. При её нагревании Бранду удалось выделить тяжелое красное масло, которое перегонялось с образованием твёрдого остатка. Нагревая последний без доступа воздуха, он заметил образование белого дыма, оседавшего на стенках сосуда и ярко светившегося в темноте. Бранд и назвал полученное им вещество фосфором, что в переводе с греческого означает «светоносец».

Несколько лет «рецепт приготовления» фосфора хранился в строжайшей тайне и был известен лишь нескольким алхимикам. В 1680 г. это вещество независимо от Бранда выделил Р.Бойль.
В несколько модифицированном виде старинный метод получения фосфора использовали и в XVIII столетии: нагреванию подвергались смесь мочи с оксидом свинца, поваренной солью, поташом и углем. Лишь в 1774 г. К. В. Шееле разработал способ получения фосфора из рога и костей животных.
В наши дни фосфор производят в электрических печах, восстанавливая апатит углём в присутствии кремнезёма:
Пары фосфора при этой температуре почти полностью состоят из молекул Р2, которые при охлаждении конденсируются в молекулы Р4.
При конденсации паров образуется белый (желтый) фосфор, который состоит из молекул Р4, имеющих форму тетраэдра. Это очень реакционноспособное мягкое воскообразное вещество бледно-желтого цвета, растворимое в сероуглероде и бензоле. На воздухе фосфор воспламеняется при 34 о С. Он обладает уникальной способностью светиться в темноте за счет медленного окисления до низших оксидов. Именно белый фосфор и был в своё время выделен Брандом.
Если белый фосфор нагревать без доступа воздуха, он переходит в красный (впервые его получили лишь в 1847 г.). Название красный фосфор относится сразу к нескольким модификациям, различающихся по плотности и окраске: она колеблется от оранжевой до тёмно-красной и даже фиолетовой. Все разновидности красного фосфора нерастворимы в органических растворителях, по сравнению с белым фосфором они менее реакционноспособны (воспламеняются на воздухе при t>200 о С) и имеют полимерное строение: это тетраэдры Р4, связанные друг с другом в бесконечные цепи. Несколько отличен от них «фиолетовый фосфор», который состоит из группировок Р8 и Р9, уложенных в длинные трубчатые структуры с пятиугольным сечением.
При повышенном давлении белый фосфор переходит в чёрный фосфор, построенный из объёмных шестиугольников с атомами фосфора в вершинах, связанных друг с другом в слои. Впервые это превращение осуществил в 1934 г. американский физик Перси Уильямс Бриджмен. Структура чёрного фосфора напоминает графит, с той лишь разницей, что слои, образованные атомами фосфора, не плоские, а «гофрированные». Черный фосфор – это наименее активная модификация фосфора. При нагревании без доступа воздуха он, как и красный, переходит в пар, из которого конденсируется белый фосфор.
Белый фосфор очень ядовит: смертельная доза около 0,1 г. Из-за опасности самовоспламенения на воздухе его хранят под слоем воды. Красный и чёрный фосфор менее ядовиты, так как нелетучи и практически нерастворимы в воде.

Химические свойства
Наиболее химически активным является белый фосфор (в уравнениях реакций с участием белого фосфора для простоты записывают как Р, а не Р4, тем более, что аналогичные реакции возможны и с участием красного фосфора, молекулярный состав которого неопределен). Фосфор непосредственно соединяется со многими простыми и сложными веществами. В химических реакциях фосфор, как и азот, может быть и окислителем, и восстановителем.
Как окислитель фосфор взаимодействует со многими металлами с образованием фосфидов, например:
Обратите внимание, что непосредственно с водородом фосфор практически не соединяется.
Как восстановитель фосфор взаимодействует с кислородом, галогенами, серой (т.е. с более электроотрицательными неметаллами). При этом в зависимости от условий проведения реакций могут образовываться как соединения фосфора (III), так и соединения фосфора (V).
а) при медленном окислении или при недостатке кислорода фосфор окисляется до оксида фосфора (III), или фосфористого ангидрида Р2О3:
При сгорании фосфора в избытке кислорода (или воздуха) образуется оксид фосфора (V), или фосфорный ангидрид Р2О5:
б) в зависимости от соотношения реагентов при взаимодействии фосфора с галогенами и серой образуются соответственно галогениды и сульфиды трех- и пятивалентного фосфора; например:
Следует отметить, что с йодом фосфор образует только соединение PI3.
Роль восстановителя фосфор играет в реакциях с кислотами-окислителями:
— с концентрированной азотной кислотой:
— с концентрированной серной кислотой:
С другими кислотами фосфор не взаимодействует.
При нагревании с водными растворами щелочей фосфор подвергается диспропорционированию, например:
Кроме фосфина РН3 в результате этих реакций образуются соли фосфорноватистой кислоты Н3РО2 – гипофосфиты, в которых фосфор имеет характерную степень окисления +1.
Применение фосфора
Основная часть производимого в мире фосфора расходуется на производство фосфорной кислоты, из которой получают удобрения и другие продукты. Красный фосфор используется при изготовлении спичек, он содержится в массе, которая наносится на спичечную коробку.
Фосфин
Наиболее известным водородным соединением фосфора является фосфин РН3. Фосфин – бесцветный газ с чесночным запахом, очень ядовит. Хорошо растворимый в органических растворителях. В отличие от аммиака малорастворим в воде. Практического значения фосфин не имеет.
Получение
Выше был рассмотрен способ получения фосфина при взаимодействии фосфора с водными растворами щелочей. Другой способ – действие соляной кислоты на фосфиды металлов, например:
Химические свойства
- Кислотно – основные свойства
Будучи малорастворим в воде, фосфин образует с ней неустойчивый гидрат, который проявляет очень слабые основные свойства:
Соли фосфония образуются только с сильными кислотами:
- Окислительно – восстановительные свойства
Как и азот в аммиаке, фосфор в молекуле фосфина имеет низшую степень окисления – 3. Однако для фосфора эта степень окисления менее устойчива, чем для азота, поэтому фосфин проявляет более ярко выраженные восстановительные свойства, чем аммиак. Так, фосфин при температуре около 150 о С самовоспламеняется на воздухе:
Фосфин восстанавливает соли некоторых малоактивных металлов до свободных металлов, например:
Скачать:
Скачать бесплатно реферат на тему: «Фосфор» Фосфор.doc (278 Загрузок)
а также на тему: «Фосфор и его соединения» Фосфор-и-его-соединения.doc (286 Загрузок)
Весь список рефератов можно посмотреть здесь
*на изображении записи фотография белого фосфора
Похожее
Добавить комментарий Отменить ответ
Репетитор по химии. Занятия проходят онлайн по Скайпу. По всем вопросам пишите в Ватсапп: +7 928 285 70 42
Видео:Химия 9 класс (Урок№16 - Фосфор. Аллотропия фосфора. Свойства фосфора. Оксид фосфора(V).)Скачать

Фосфор
Фосфор (греч. phos — свет + phoros — несущий) — химический элемент, принадлежащий к Vа группе и 3 периоду. Простое желтоватое вещество, легко воспламеняющееся и светящееся.
Основное и возбужденное состояние фосфора
При возбуждении атома фосфора электроны на s-подуровне распариваются и переходят на d-подуровень.
Природные соединения
В промышленности фосфор получают в ходе сплавления фосфата кальция, песка и угля.
Химическая активность фосфора значительно выше, чем у азота. Активность также определяется аллотропной модификацией: наиболее активен белый фосфор, излучающий видимый свет из-за окисления кислородом.
В жидком и газообразном состоянии до 800 °C фосфор состоит из молекул P4. Свыше 800 °C молекулы P4 распадаются до P2.
- Реакции с неметаллами
C неметаллами фосфор часто проявляет себя как восстановитель и окислитель. Легко окисляется кислородом.
Схожим образом происходит взаимодействие фосфора и хлора.
2P + 3Cl2 → 2PCl3 (недостаток хлора)
2P + 5Cl2 → 2PCl5 (избыток хлора)
Реакции с водородом крайне затруднена. Тем не менее, в ходе разложения фосфидов металлов можно получить ядовитый газ — фосфин — боевое отравляющее вещество.
2P + 3Ca → Ca3P2 (фосфид кальция)
Реакция с водой
При взаимодействии с водой фосфор вступает в реакцию диспропорционирования (так называются реакции, в которых одно и то же вещество является и окислителем, и восстановителем).
Реакция с щелочами
При добавлении фосфора в растворы щелочей также происходит реакция диспропорционирования.
При поджигании спичек происходит реакция между фосфором и бертолетовой солью, которая выступает в качестве окислителя.
Оксид фосфора V — P2O5
Кислотный оксид, пары которого имеют формулу P4O10. Твердый оксид характеризуется белым цветом.
Активно реагирует с водой с образованием фосфорной кислоты. При недостатке воды образует метафосфорную кислоту.
Реагирует с основными оксидами и основаниями, образуя соли фосфорной кислоты. Какая именно получится соль — определяет соотношение основного оксида/основания и кислотного оксида.
6KOH + P2O5 = 2K3PO4 + 3H2O (фосфат калия, избыток щелочи — соотношение 6:1)
4KOH + P2O5 = 2K2HPO4 + H2O (гидрофосфат калия, незначительный избыток кислотного оксида — соотношение 4:1)
2KOH + P2O5 = 2KH2PO4 + H2O (дигидрофосфат калия, избыток кислотного оксида — соотношение 2:1)
Обладает выраженным водоотнимающим (дегидратационным) свойством: легко извлекает воду из других соединений.
Фосфорные кислоты
Существует несколько кислородсодержащих фосфорных кислот:
- Ортофосфорная кислота — H3PO4 (трехосновная кислота, соли — фосфаты PO4 3- )
- Метафосфорная кислота — HPO3 (одноосновная кислота, соли — метафосфаты PO3 — )
- Фосфористая — H3PO3 (двухосновная кислота, соли — фосфиты HPO3 2- )
- Фосфорноватистая — H3PO2 (одноосновная кислота, соли гипофосфиты — H2PO2 — )
Фосфорноватистая кислота способна вытеснять из солей малоактивные металлы, при этом превращаясь в ортофосфорную кислоту.
Ортофосфорная кислота
В твердом виде представляет собой кристаллы белого цвета, хорошо растворимые в воде.
Фосфорную кислоту получают из фосфатов, воздействуя на них серной кислотой. Также известны способы гидролиза пентахлорида фосфора, взаимодействия оксида фосфора V с водой.
Фосфорная кислота может образоваться при окислении фосфора сильной кислотой:
За счет кислотных свойств отлично реагирует с основными оксидами, основаниями. При различных соотношениях кислоты и основания получаются различные соли (фосфаты, гидрофосфаты и дигидрофосфаты).
Реакции с солями
Реакции идут, если выделяется газ, выпадает осадок или образуется слабый электролит (вода). Например, характерный осадок желтого цвета — фосфат серебра — образуется в результате реакции с нитратом серебра.
В реакции с карбонатами образуется нестойкая угольная кислота, которая распадается на воду и углекислый газ.
Реакции с металлами
Металлы, стоящие в ряду напряжений до водорода, способны вытеснить водород из фосфорной кислоты.
При сильном нагревании ортофосфорная кислота теряет воду и переходит в метафосфорную кислоту.
Соли фосфорной кислоты
Соли фосфорной кислоты получаются в ходе реакции ортофосфорной кислоты и оснований.
Фосфаты являются хорошими удобрениями, которые повышают урожайность. Перечислим наиболее значимые:
- Фосфоритная мука — Ca3(PO4)2
- Простой суперфосфат — смесь Ca(H2PO4)2*H2O и CaSO4
- Двойной суперфосфат — Ca(H2PO4)2*H2O
- Преципитат — CaHPO4*2H2O
- Костная мука — продукт переработки костей домашних животных Ca3(PO4)2
- Аммофос — в основном состоит из моноаммонийфосфата — NH4H2PO4
© Беллевич Юрий Сергеевич 2018-2022
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
🎦 Видео
Химические свойства фосфора | ХимияСкачать

Химия 9 класс (Урок№14 - Азот: свойства и применение. Аммиак. Физические и химические свойства.)Скачать

Фосфор. 9 класс.Скачать

Фосфор. Химические свойстваСкачать

ОГЭ/Характеристика азота и фосфора/9 класс химияСкачать

Химия 9 класс: ФосфорСкачать

Химия фосфора | Химия ЕГЭ 2022 | УмскулСкачать

Азот и фосфор VA группа | Химия ЕГЭ, ЦТСкачать

Фосфор. Аллотропия фосфора. Свойства фосфора. Оксид фосфора(V). Фосфорная кислота и её соли.Скачать

Окислительно-восстановительные реакции. 1 часть. 9 класс.Скачать

Окислительно- восстановительные реакции, 9 класс, часть 2Скачать

Химия 9 класс — Как определять Степень Окисления?Скачать

Окислительно восстановительные реакции | Химия 8 класс #52 | ИнфоурокСкачать

8 класс. ОВР. Окислительно-восстановительные реакции.Скачать

Окислительные и восстановительные свойстваСкачать

Ортофорфорная кислота. Соли фосфорной кислоты. 9 класс.Скачать

Химия. 9 класс. Фосфор. Соединения фосфора /03.03.2021/Скачать

9 класс. Урок 6. Оксиды фосфора.Скачать