Задание 9. Сера является окислителем в реакции, уравнение которой:
Степень окисления определяют, как заряд атома элемента в соединении, который возник бы на данном атоме, если предположить, что все связи в соединении ионные.
Вещества, атомы (молекулы или ионы) которых присоединяют электроны, называются окислителями. Вещества, атомы (молекулы или ионы) которых отдают электроны, называются восстановителями.

2) 

3) 
(сера не изменяет степени окисления, следовательно, реакция не является окислительно-восстановительной)
4) 

Сера принимает электроны только в реакции под номером 1, то есть только в этом случае является окислителем.
- Окислителем и восстановителем являются атомы серы в реакции уравнение которой
- Как написать хороший ответ?
- Окислительно-восстановительные реакции
- Что такое ОВР
- Примеры веществ-окислителей
- Примеры веществ-восстановителей
- Окислительно-восстановительная двойственность
- Кислородсодержащие соединения серы в степени окисления +4
- Пероксид водорода
- Простое вещество йод
- Азотистая кислота и нитриты
- Классификация окислительно-восстановительных реакций
- Основные правила составления ОВР
- Химия, Биология, подготовка к ГИА и ЕГЭ
- Реакции ОВР
- 📹 Видео
Видео:Окислительно-восстановительные реакции. 1 часть. 9 класс.Скачать

Окислителем и восстановителем являются атомы серы в реакции уравнение которой
Вопрос по химии:
Определи чем являются атомы серы (окислителем, восстановителем,окислителем и восстановителем) в реакции, уравнение которой
2H2SO4+Cu=CuSO4+SO2+2H2O.
Трудности с пониманием предмета? Готовишься к экзаменам, ОГЭ или ЕГЭ?
Воспользуйся формой подбора репетитора и занимайся онлайн. Пробный урок — бесплатно!
Ответы и объяснения 1
Знаете ответ? Поделитесь им!
Как написать хороший ответ?
Чтобы добавить хороший ответ необходимо:
- Отвечать достоверно на те вопросы, на которые знаете правильный ответ;
- Писать подробно, чтобы ответ был исчерпывающий и не побуждал на дополнительные вопросы к нему;
- Писать без грамматических, орфографических и пунктуационных ошибок.
Этого делать не стоит:
- Копировать ответы со сторонних ресурсов. Хорошо ценятся уникальные и личные объяснения;
- Отвечать не по сути: «Подумай сам(а)», «Легкотня», «Не знаю» и так далее;
- Использовать мат — это неуважительно по отношению к пользователям;
- Писать в ВЕРХНЕМ РЕГИСТРЕ.
Есть сомнения?
Не нашли подходящего ответа на вопрос или ответ отсутствует? Воспользуйтесь поиском по сайту, чтобы найти все ответы на похожие вопросы в разделе Химия.
Трудности с домашними заданиями? Не стесняйтесь попросить о помощи — смело задавайте вопросы!
Химия — одна из важнейших и обширных областей естествознания, наука о веществах, их составе и строении, их свойствах, зависящих от состава и строения, их превращениях, ведущих к изменению состава — химических реакциях, а также о законах и закономерностях, которым эти превращения подчиняются.
Видео:8 класс. ОВР. Окислительно-восстановительные реакции.Скачать

Окислительно-восстановительные реакции
О чем эта статья:
11 класс, ЕГЭ/ОГЭ
Видео:ОВР и Метод Электронного Баланса — Быстрая Подготовка к ЕГЭ по ХимииСкачать

Что такое ОВР
Окислительно-восстановительная реакция (ОВР) — это реакция, которая протекает с изменением степеней окисления.
В такой реакции всегда участвуют вещество-окислитель и вещество-восстановитель. Другие вещества могут выступать в качестве среды, в которой протекает данная реакция.
Конечно, в каждом правиле есть исключения. Например, реакция диспропорционирования галогенов в горячем растворе щелочи выглядит так: Br2 + KOH = KBrO3 + KBr + H2O. Здесь и окислителем, и восстановителем является простое вещество бром (Br2).
Теперь посмотрим внимательнее на вещества — участники окислительно-восстановительных реакций.
Окислитель — вещество, в состав которого входит ион или атом, который в процессе реакции будет принимать электроны, тем самым понижая свою степень окисления.
Восстановитель — вещество, в состав которого входит ион или атом, который в процессе реакции будет отдавать электроны, тем самым повышая свою степень окисления.
Из определений понятно, что реакция включает два противоположных по действиям явления: процесс окисления и процесс восстановления. Процесс восстановления — это процесс принятия электронов, а процесс окисления — процесс отдачи электронов. Оба процесса протекают одновременно: окислитель восстанавливается, а восстановитель окисляется.
Вот мы и узнали общие закономерности протекания окислительно-восстановительных реакций. Теперь давайте разберемся, какие вещества могут быть окислителями, а какие — восстановителями, и может ли одно вещество проявлять те и другие свойства.
Видео:Химия 9 класс — Как определять Степень Окисления?Скачать

Примеры веществ-окислителей
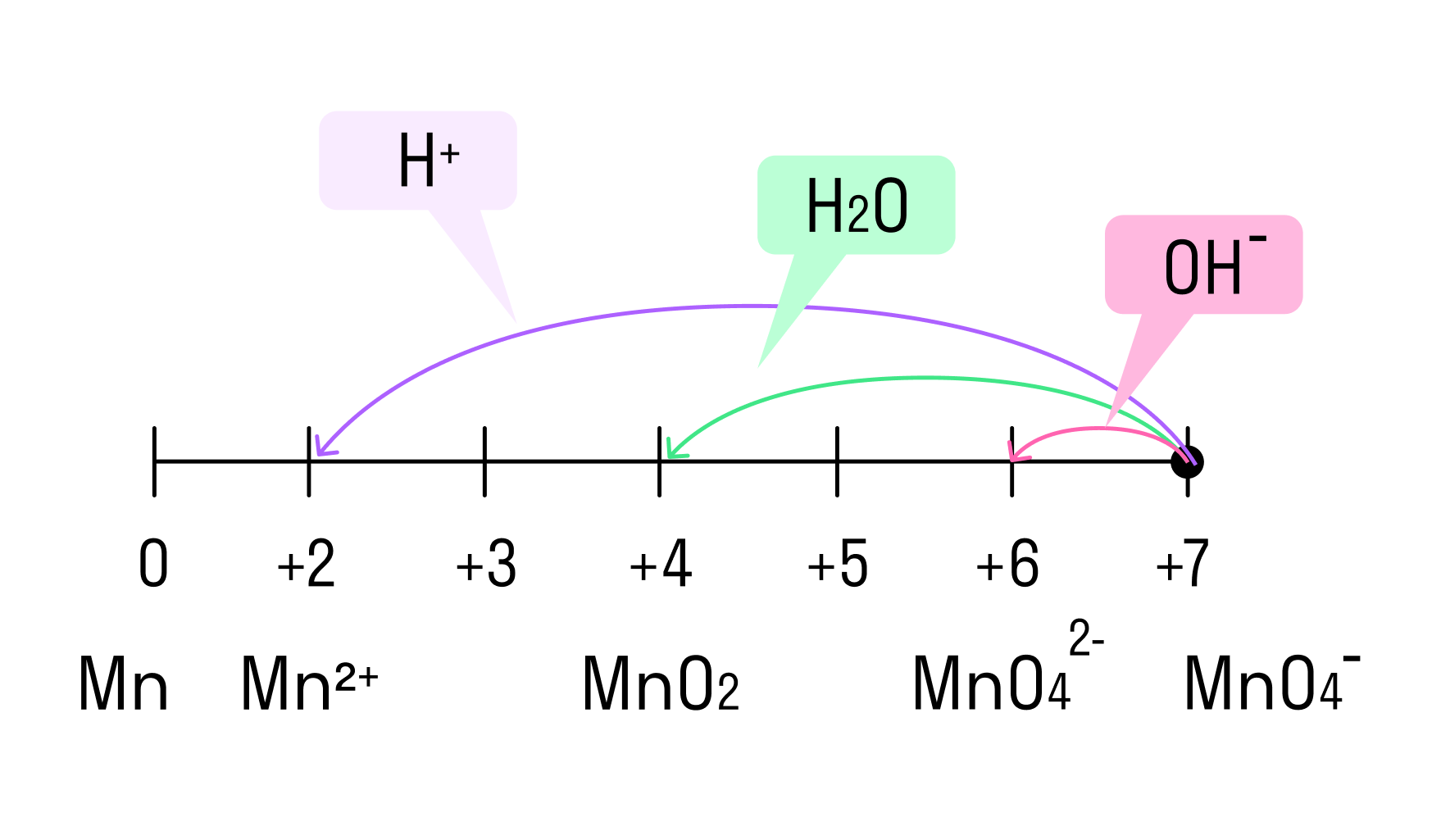
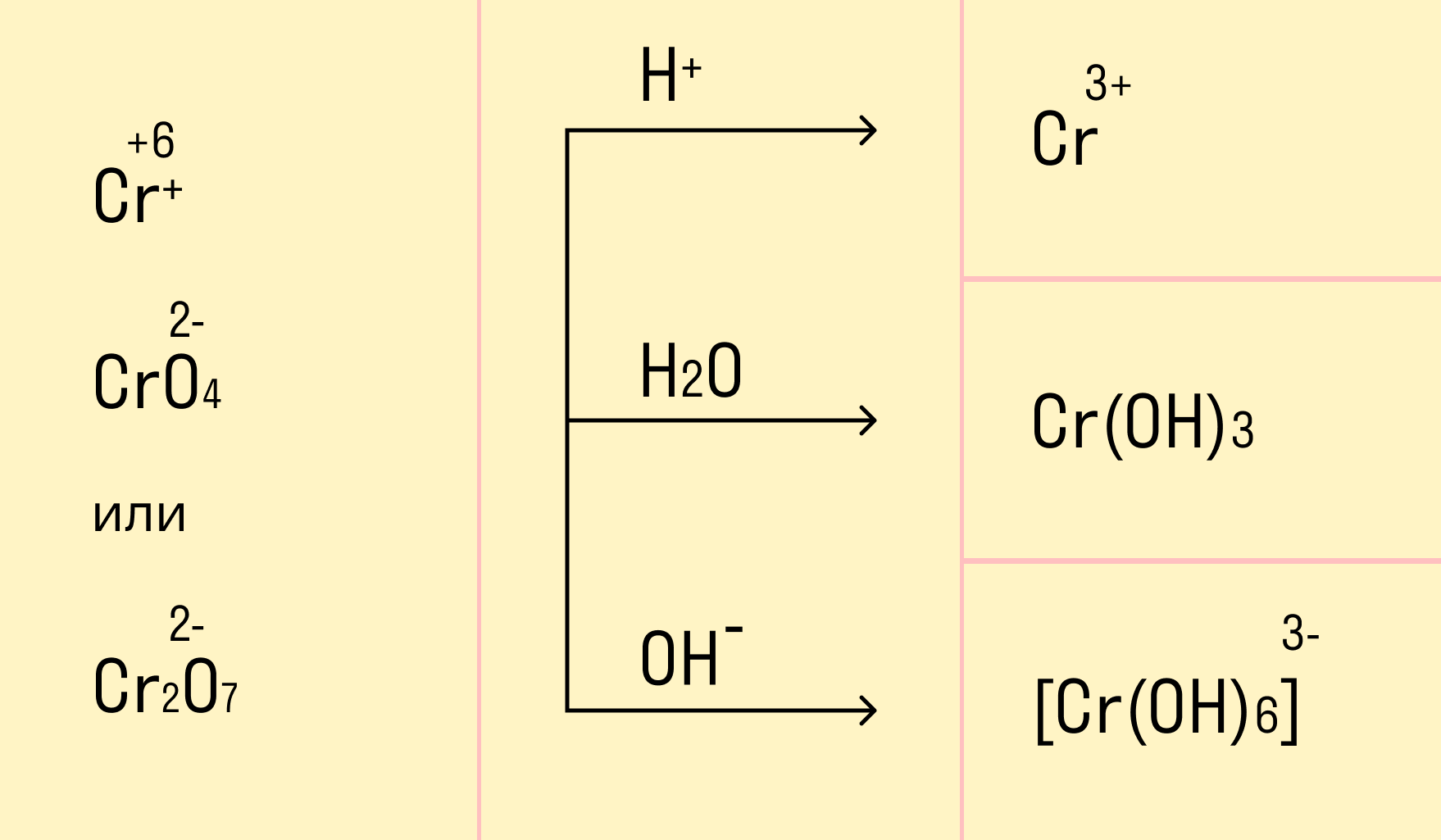
Только окислителями могут быть элементы в высшей своей степени окисления. Например, S +6 в серной кислоте (H2SO4), N +5 в азотной кислоте (HNO3) или солях-нитратах, Cr +6 в хроматах (CrO4 2− ) и дихроматах (Cr2O7 2− ) соответственно, а также Mn +7 (MnO 4− ).
В зависимости от среды проведения реакции Mn +7 и Cr +6 ведут себя по-разному. Рассмотрим на схемах:
И марганец, и хром в кислой среде (H + ) образуют соли той кислоты, которая образовывала среду. В нейтральной среде (H2O) марганец превращается в оксид бурого цвета, а хром — в серо-зеленый нерастворимый в воде гидроксид. В щелочной среде (OH − ) марганец превращается в манганат (MnO4 2− ), а хром — в комплексное соединение светло-зеленого цвета.
Только окислителями могут быть простые вещества-неметаллы. Например, представители VIIA группы — галогены. Проявляя окислительные свойства в кислой среде, галогены восстанавливаются до соответствующих им галогеноводородных кислот: HF, HCl, HBr, HI. В щелочной среде образуются соли галогеноводородных кислот.
Кислород превращается в анион с устойчивой степенью окисления −2. А сера ведет себя как окислитель по отношению к водороду и металлам, образуя при этом сероводород и сульфиды.
Только окислителями могут быть и протон водорода (H + ) и катионы металлов в их высших степенях окисления при нескольких возможных. Ион Н + при взаимодействии с восстановителями переходит в газообразный водород (H2), а катионы металлов — в ионы с более низкой степенью окисления: 2CuCl2 + 2KI = CuCl + 2KCl + I2.
Рассмотрим как ведут себя сильные кислоты-окислители — азотная и серная. В зависимости от их концентрации меняются и продукты реакции.
Эти кислоты проявляют окислительные способности и с некоторыми неметаллами, окисляя их до соответствующих кислот в высшей степени окисления неметалла-восстановителя.
Для удобства мы собрали цвета переходов важнейших веществ-окислителей в одном месте.
Видео:ЭТОТ метод поможет на уроках ХИМИИ / Химия 9 классСкачать

Примеры веществ-восстановителей
Типичными восстановителями могут быть щелочные (IA) и щелочноземельные (IIA) металлы, цинк и алюминий, а также катионы металлов в своих низших степенях окисления при нескольких возможных. Например:
Типичными восстановителями также могут быть бескислородные кислоты и их соли. Например, H2S + 4Cl2 + 4H2O = 8HCl + H2SO4.
Гидриды активных металлов (щелочных и щелочноземельных) тоже являются типичными восстановителями. Например, NaH + H2O = NaOH + H2.
Для удобства мы собрали цвета переходов важнейших веществ-восстановителей в одном месте.
Видео:Химия 9 класс (Урок№11 - Сера. Серовород. Сульфиды.)Скачать

Окислительно-восстановительная двойственность
Окислительно-восстановительная двойственность — это способность атома проявлять как свойства окислителя, так и свойства восстановителя в зависимости от условия протекания химической реакции.
Разберем вещества, атомы которых обладают окислительно-восстановительной двойственностью.
По отношению к водороду и металлам сера играет роль окислителя: S + H2 = H2S.
При взаимодействии с сильными окислителями повышает свою степень окисления до +4 или +6: S + KMnO4 = K2SO4 + MnO2.
Кислородсодержащие соединения серы в степени окисления +4
Сера в сульфитах и сернистой кислоте при взаимодействии с сильными окислителями повышает степень окисления до +6: SO2 + 2HNO3 (конц) = H2SO4 + 2NO2.
С восстановителями соединения серы проявляют окислительные свойства, восстанавливаясь до степени окисления 0 или −2: SO2 + C = CO2 + S.
Пероксид водорода
Атом кислорода в пероксиде водорода находится в промежуточной степени окисления –1, и в присутствии восстановителей может понижать степень окисления до –2: 4H2O2 + PbS = PbSO4 + 4H2O.
Атом кислорода в пероксиде водорода находится в промежуточной степени окисления –1, и в присутствии окислителей может повышать степень окисления до 0: 3H2O2 + 2KMnO4 = 3O2 + 2MnO2 + 2KOH + 2H2O.
Простое вещество йод
Окислительная способность проявляется у йода в реакции с такими восстановителями, как сероводород, фосфор и металлы: I2 + H2S = S + 2HI.
Йод при взаимодействии с более сильными окислителями играет роль восстановителя: I2 + 5Cl2 + 6H2O = 2HIO3 + 10HCl.
Азотистая кислота и нитриты
При взаимодействии с более сильными окислителями азот повышает степень окисления до +5 и превращается либо в азотную кислоту из азотистой, либо в нитрат-анион из нитрит-аниона: 5NaNO2 + 2KMnO4 + 3H2SO4 = 5NaNO3 + 2MnSO4 + K2SO4 + 3H2O.
При взаимодействии с сильными восстановителями обычно происходит восстановление до NO (иногда до других соединений азота в более низких степенях окисления): 2HNO2 + 2HI = 2NO + I2 + 2H2O.
Для удобства мы собрали представителей типичных окислителей и восстановителей в одну схему.
Видео:Учимся составлять электронный баланс/овр/8классСкачать

Классификация окислительно-восстановительных реакций
Окислительно-восстановительные реакции можно поделить на четыре типа:
Рассмотрим каждую по отдельности.
Межмолекулярная ОВР — это реакция, окислитель и восстановитель которой являются различными веществами.
2KI + Br2 = 2KBr + I2, где Br2 — окислитель, а KI — восстановитель (за счёт I −1 ).
Внутримолекулярная ОВР — это реакция, в которой один атом является окислителем, а другой восстановителем в рамках одного соединения.
Пример такой окислительно-восстановительной реакции:
где Cl +5 — окислитель, а O −2 — восстановитель.
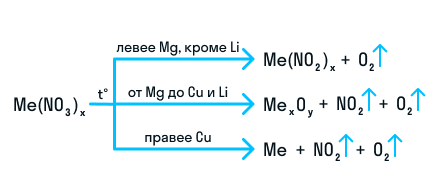
Термическое разложение нитратов — это внутримолекулярная ОВР. Вот схема разложения нитратов в зависимости от металла, входящего в состав соли.
Исключение — разложение нитрата железа (II): 4Fe(NO3)2 = 2Fe2O3 + 8NO2 + O2. Здесь железо окисляется до +3 вопреки правилам. Иначе разлагается при нагревании и нитрат аммония: NH4NO3 = N2O + 2H2O.
Окислительно-восстановительная реакция диспропорционирования — это реакция, в ходе которой один и тот же атом является и окислителем, и восстановителем. Например, 3HNO2 = HNO3 + 2NO + H2O, где N +3 переходит в N +5 , являясь восстановителем, и N +3 переходит в N +2 , являясь окислителем.
Окислительно-восстановительная реакция контрпропорционирования — это реакция, в которой атомы одного и того же химического элемента в разных степенях окисления входят в состав разных веществ, при этом образуя новые молекулы одного и того же продукта.
Видео:Окислительно-восстановительные реакции с нуля!| Екатерина Строганова | 100балльный репетиторСкачать

Основные правила составления ОВР
Подобрать среди исходных веществ окислитель и восстановитель, а также вещество, которое отвечает за среду — при необходимости. Для этого нужно расставить степени окисления элементов и сравнить их окислительно-восстановительные свойства.
Составить уравнение реакции и записать продукты реакции. Следует помнить, что в кислой среде образуются соли одно-, двух- и трехзарядных катионов, а для создания среды чаще всего используют серную кислоту. В кислой среде невозможно образование оснóвных оксидов и гидроксидов, так как они вступят в реакцию с кислотой. В щелочной среде не могут образовываться кислоты и кислотные оксиды, а образуются соли.
Уравнять методом электронного баланса или методом полуреакций.
Составим алгоритм для уравнивания окислительно-восстановительных реакций методом электронного баланса.
Главное условие протекания ОВР — общее число электронов, отданных восстановителем, должно быть равно общему числу электронов, принятых окислителем.
Определите атомы, которые меняют свои степени окисления в ходе реакции.
Выпишите, сколько электронов принял окислитель и отдал восстановитель. Если восстановителей несколько, выписываем все.
Найдите НОК для суммарно отданных/принятых электронов.
Расставьте первые полученные коэффициенты перед окислителем и одним или несколькими восстановителями.
Уравняйте все присутствующие металлы в уравнении реакции.
Уравняйте кислотные остатки.
Уравняйте водород — в обеих частях его должно быть одинаковое количество.
Проверьте себя по кислороду — если все посчитано верно, то он сойдется.
Видео:ОВР для чайников — Как определить Окислитель и Восстановитель #shorts #youtubeshortsСкачать

Химия, Биология, подготовка к ГИА и ЕГЭ
Вопрос А 14 ГИА (ОГЭ) по химии —
Степень окисления химических элементов. Окислитель и восстановитель.
| Восстановители | Окислители | |
|
Ответ: промежуточная с.о. у углерода в CO = +2 Самые сильные окислительные свойства проявляет соединение хлора: Ответ: вещество с высшей с.о. хлора = +7 Видео:ОВР / разбор задания из ОГЭ /химия #857Скачать  Реакции ОВР
Любая окислительно-восстановительная реакция представляет собой единство двух противоположных превращений — окисления и восстановления, происходящих одновременно и без отрыва одного от другого Обычно составление таких уравнений, и тем более — определение степеней ок-я и участников овр не вызывает трудностей. Есть только несколько исключений. которые нужно запомнить: H2O2 — степень ок-я кислорода = -1 OF2 — степень ок-я кислорода = +2 в гидридах металлов степень ок-я водорода = -1 Fe3O4 — условная запись состава минерала FeO•Fe2O3, т.е. у железа с.о. +2 и +3
S +6 +2e — -> S +4 — окислитель
| с.о. восстановителя |
|
|
Ответ: 1-1, 2-1, 3-3
Установите соответствие между схемой окислительно-восстановительной реакции и изменением степени окисления окислителя в ней
- K2Cr2O7 + KCl + H2SO4 -> Cr2(SO4)3 + Cl2 + K2SO4
- Cl2 + Ca(OH)2 + -> CaCl2 + Ca(ClO)2 + H2O
- H2 + Li -> LiH
- +6 -> +3
- +3 -> +6
- 0 -> -1
- 0 -> +1
Ответ: 1 — 1, 2 — 3, 3 — 3
Укажите схему реакции, которая идет без изменения с.о.:
- KNO3 -> KNO2 + O2;
- CaCO3 -> CaO + CO2;
- FeO + O2 -> Fe2O3
- J2 + J2 -> HJ
📹 Видео
ОВР Окислительно-восстановительные реакции. Как определить окислитель и восстановительСкачать

Окислительно-восстановительные реакции (ОВР). Что надо знать и как их решатьСкачать

66. Окислительно-восстановительные реакции.Скачать

Когда ждать суперизвержение? Вулканолог Павел ПлечовСкачать

Окислительно восстановительные реакции | Химия 8 класс #52 | ИнфоурокСкачать

Окислительно-восстановительные реакции. Видеоурок по химии 9 классСкачать

Сера: химические свойства, аллотропия и её соединения #сера #химшкола #неметаллы #егэхимияСкачать

Окислительно-восстановительные реакции в кислой среде. Упрощенный подход.Скачать

Химия, 9 класс, тема "Окислительно-восстановительные реакции" (учитель Швецова Елена Евгеньевна)Скачать

Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать