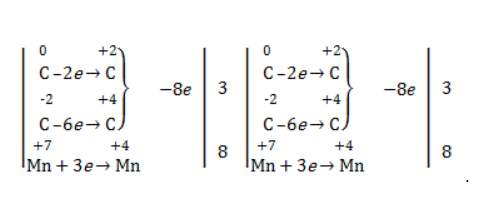Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. Содержание
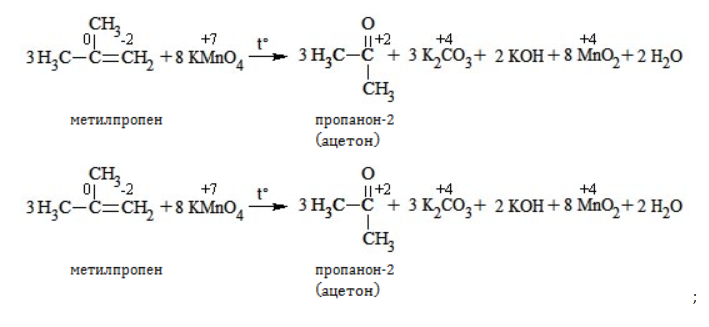
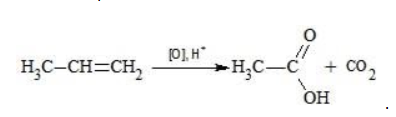
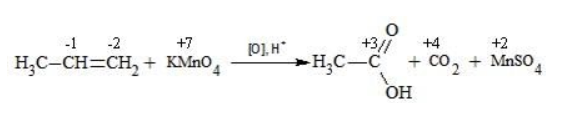
Видео:Окисление органических веществ | Химия ЕГЭ для 10 класса | УмскулСкачать  Окисление алкенов перманганатом калияВ отличие от предельных углеводородов, алкены характеризуются высокой химической активностью, обусловленной особенностями строения молекулы. При обычных условиях алкены охотно вступают в реакции неполного окисления с превращением в органические соединения других классов. Универсальный реагент в процессах окисления алкенов – перманганат калия. Видео:Окисление пропилбензола перманганата калия в кислой средеСкачать  Понятие о неполном окисленииВ химии органических соединений под окислением понимается взаимодействие, при котором происходит обеднение реагента водородом или обогащение кислородом, сопровождающееся отдачей электронов молекулой. Обратный процесс называется восстановлением. Полное окисление происходит при горении углеводородов с разрушением молекулы. Продуктами в этом случае являются углекислый газ и вода. При неполном окислении продуктами становятся различные вещества. Высокая реакционная способность алкенов обусловливается присутствием в молекуле двойной связи. Один из ее компонентов – слабая Определение степеней окисленияДля того чтобы правильно записать уравнение реакции неполного окисления алкена, нужно определить степени окисления атомов до вступления во взаимодействие и после него. Они рассчитываются исходя из электроотрицательности элементов. Например, при окислении пропена перманганатом калия
В общем виде результат можно записать следующим образом: Расчет степеней окисления в кислородсодержащих соединениях производится аналогично с учетом большей электроотрицательности кислорода. Видео:Окисление органических соединений перманганатом калияСкачать  Влияние среды на окислительСостав раствора (наряду с температурой) определяет, до какого соединения окислится восстановитель – алкен. Окислитель в растворах с различным уровнем кислотности (щелочности) также ведет себя неодинаково. Неорганическая соль В нейтральной и слабощелочной среде марганец приобретает степень окисления +4 +4: Кислород из перманганат-аниона присоединяется к алкену по месту двойной связи. Под воздействием серной кислоты марганец восстанавливается до степени окисления +2 +2: При окислении со щелочью (гидроксид лития достаточно высокой концентрации) марганец восстановится до +6 +6: Видео:10 класс (профиль).Ч.2.Окисление алкенов раствором марганцовки в кислой среде.Скачать  Мягкое окислениеПроцесс в нейтральной или слабощелочной среде при обычной температуре представляет собой так называемое мягкое окисление перманганатом калия, или гидроксилирование. В алкене разрывается
Продукт реакции – диол (двухатомный спирт). Например, окисление этилена перманганатом калия приводит к образованию этиленгликоля: Для составления полного уравнения нужно:
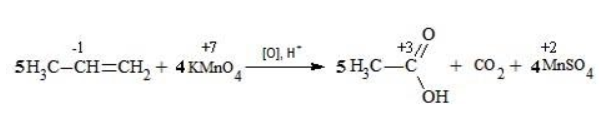
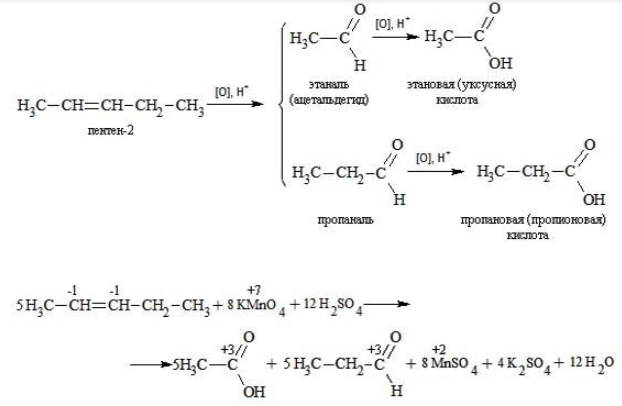
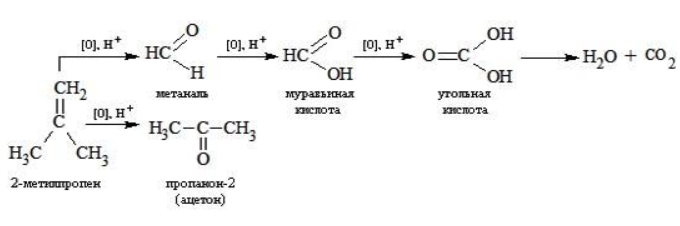
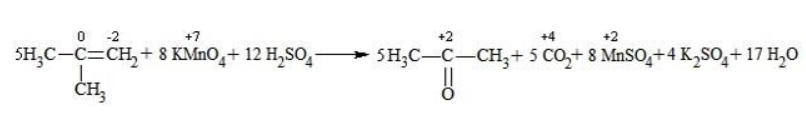
Реакция окисления пропена в нейтральной среде перманганатом калия составляется аналогично: Дальше мягкое окисление не идет, так как Видео:Лабораторная работа №16. Свойства уксусной кислоты. 9 класс.Скачать  Жесткое окислениеЖесткими называют процессы окисления, протекающие в нейтральном растворе в условиях повышенной температуры, а также при добавлении кислоты или щелочи. В этих случаях двойная связь в алкене разрушается полностью, а продуктами реакции становятся кетоны, кислоты (с промежуточным окислением до альдегида) либо соли. Окисление перманганатом калия в кислой средеПропен в содержащем кислоту растворе Степени окисления участвующих в реакции углеродных атомов и марганца составят: Электронный баланс определяется только с учетом углерода, вошедшего в состав кислоты: Сначала расставляются коэффициенты в окислителе, восстановителе и в продуктах окисления: Затем вписываются недостающие вещества и полностью рассчитываются коэффициенты: Еще один пример жесткого окисления алкенов перманганатом калия с серной кислотой – реакция с участием пентена-2. Молекула расщепляется по месту двойной связи, и ее фрагменты окисляются через промежуточное образование альдегидов до двух кислот: Электронный баланс составляется для двух углеродных атомов алкена, поскольку оба они являются восстановителями. Правило, по которому осуществляется окисление углерода, отражено в таблице: Так, в 2-метилпропене первичный атом окисляется через промежуточные формальдегид (метаналь) и муравьиную кислоту полностью – до углекислого газа, а третичный – только до ацетона: Окисление алкенов в щелочной средеПри нагревании с концентрированной щелочью алкены окисляются до солей: Если один из углеродных атомов – первичный, он окисляется до углекислого газа: Окисление в нейтральном раствореВ условиях высокой температуры образующаяся щелочь вступает в реакцию, в результате которой окисление алкенов продолжается до образования кетонов или солей. Так, при жестком окислении пропена в нейтральной среде получаются те же продукты, что и в присутствии концентрированного гидроксида калия: ацетат Кетон – результат окисления третичного углеродного атома, и дальнейшую реакцию они не поддерживают. Например, при окислении метилпропена как конечный продукт образуется ацетон: Видео:Окисление Этанола Перманганатом Калия В Сернокислой Среде.Скачать  ЗаключениеВзаимодействие с раствором перманганата калия в мягких или жестких условиях является показателем высокой реакционной способности алкенов, которая обусловлена присутствием в молекуле легко разрываемой -связи. Реакции мягкого и жесткого окисления относятся к числу характерных химических свойств алкенов как ненасыщенных углеводородов. Видео:ОВР в органических реакциях на примере окисления алкенов растворами перманганата калияСкачать  Жесткое окисление алкенов. Как записать уравнение?Видео:Окисление алкенов в кислой средеСкачать  Жесткое окисление алкенов в кислой средеДанный процесс чаще всего осуществляют, действуя на алкены подкисленным раствором перманганата калия, либо дихромата калия. В качестве средообразователя всегда используют серную кислоту. При таком окислении происходит полный разрыв углеродного скелета по двойной связи, и в зависимости от особенностей строения продуктами окисления могут быть различные вещества. Давайте сначала разберемся с тем, какие углеродсодержащие продукты образуются при жестком окислении алкенов с различным строением. Представим, что у нас стоит задача определить продукты окисления для следующих двух веществ: Обратите внимание, что углеродные атомы при двойной связи обозначены разными цветами. Атом углерода, выделенный красным цветом, является первичным, то есть связан только с одним другим атомом углерода. Атом углерода, выделенный желтым цветом, является вторичным, то есть связан с двумя другими атомами углерода. Атом углерода, выделенный зеленым цветом, является третичным, то есть связан с тремя другими атомами углерода. Жесткое окисление подразумевает разрыв углеродного скелета по месту двойной связи: Следует запомнить, что первичные атомы углерода (красные) при таком окислении переходят в углекислый газ. Теперь осталось разобраться с остальными продуктами реакции. Если в качестве окислителя используется сернокислый раствор перманганата калия, то продуктами будут также MnSO4, K2SO4 и H2O. Если же в качестве окислителя взяли сернокислый раствор дихромата калия, продуктами будут Cr2(SO4)3, K2SO4 и H2O. Давайте разберем все эти случаи. Начнем с реакции пропена с сернокислым раствором перманганата калия. Пропен + KMnO4 +H2SO4Исходя из вышесказанного, запишем схему этой реакции: Осталось расставить коэффициенты. Определим, какие атомы изменили степени окисления. В случае марганца ничего сложного нет: степень окисления его в перманганате была +7, стала равна +2. Также степени окисления меняют те атомы углерода, у которых изменилось окружение. В схеме эти атомы обозначены желтым и красным цветами. Определим степени окисления этих атомов методом блоков. Изолируем друг от друга фрагменты молекулы по углерод-углеродным связям следующим образом: Далее, условно примем, что заряд каждого выделенного блока равен нулю (как у нейтральной молекулы). Степень окисления водорода в органических веществах всегда равна +1. Обозначим степени окисления «желтого» атома С как х, «красного» — как y: Далее, учитывая, что заряд каждого блока мы приняли равным нулю, мы можем составить и решить два уравнения: Аналогично рассчитаем степень окисления «желтого» атома углерода в уксусной кислоте и «красного» в молекуле углекислого газа, учитывая, что степень окисления кислорода в органических веществах всегда равна -2 (кроме органических пероксидов, изучение которых в не входит в программу ЕГЭ): Далее, аналогично, составим и решим два уравнения, учитывая, что заряд выделенного блока мы приняли равным нулю, а заряд молекулы углекислого газа, как и у любой другой молекулы, также нейтрален. Таким образом, «желтый» атом углерода имел степень окисления до реакции, равную -1, а после +3. «Красный» атом углерода изменил свою степень окисления с -2, на +4. Учитывая, что марганец изменил свою степень окисления с +7 на +2, еще раз запишем схему реакции и составим электронный баланс. «Желтый» и «красный» атомы углерода, очевидно, всегда будут в соотношении 1 к 1, независимо от коэффициента перед органическим веществом, потому запишем их в одной строчке «полуреакции» окисления. Перенесем коэффициенты из баланса: Поскольку в левой части схемы мы видим два атома калия, в правой части схемы перед сульфатом калия коэффициент 1, ставить который не нужно. В правой части уравнения мы видим 3 сульфатных остатка, поэтому ставим перед серной кислотой коэффициент 3: Осталось поставить коэффициент перед водой в правой части. Это можно сделать по кислороду или водороду на выбор. Поскольку мы уравняли число сульфатных остатков в левой и правой частях, то кислород в них можно не учитывать. Считаем только кислород в остальных соединениях. Слева мы видим 8 атомов кислорода (не считая кислород в серной кислоте). В правой части не считая воду — 4 атома кислорода. Поэтому перед водой коэффициент будет равен 4: Сравнивая количества всех элементов слева и справа, видим, что все коэффициенты расставлены верно. 2-метилпропен + KMnO4 + H2SO4Аналогично предыдущему примеру рассчитаем степени окисления углеродных атомов, которые изменили свою степень окисления: Учитывая, что заряд каждого выделенного блока мы приняли равным нулю, составим и решим уравнения: Аналогично поступим с продуктами окисления: составим и решим уравнения: Таким образом, «зеленый» атом углерода до реакции имел степень окисления, равную 0, после +2, «красный» изменил свою степень окисления с -2 на +4. Далее запишем схему окисления и составим электронный баланс: Перенесем коэффициенты из электронного баланса в схему: Далее мы видим, что в левой части схемы 8 атомов калия, потому перед сульфатом калия поставим коэффициент 4. Теперь можно заметить, что в правой части уравнения 12 сульфатных групп (8 в сульфате марганца, 4 в сульфате калия). Поэтому перед серной кислотой в левой части нужно поставить коэффициент 12: Осталось поставить коэффициент перед водой. Сделаем это по кислороду. Количество сульфатных групп мы уравняли, потому кислород в них можно не учитывать. Слева мы видим 32 атома кислорода (8*4). В правой части уравнения, не считая воды и сульфатных групп, 15 атомов кислорода (5 в молекуле кетона и 10 в 5 молекулах углекислого газа). Таким образом, перед водой необходимо поставить коэффициент 17. Посчитав водород слева и справа, мы убеждаемся, что коэффициенты расставлены верно. Пропен + K2Cr2O7 + H2SO4Состав продуктов будет точно таким же, как и в случае окисления перманганатом, за исключением того, что вместо сульфата марганца (II) образуется сульфат хрома (III). Запишем схему реакции и составим электронный баланс. Перенесем коэффициенты из баланса в схему: Далее уравняем калий, поставив коэффициент 5 перед сульфатом калия: В правой части мы видим 20 сульфатных групп. Следовательно, перед формулой серной кислоты нужно поставить коэффициент 20: Осталось поставить последний коэффициент перед формулой воды. Сделаем это, как и в двух предыдущих случаях, по кислороду, не считая кислород в сульфатных группах, поскольку их количества уравнены. В левой части мы видим 35 атомов кислорода. В правой части, не считая воды, 12 атомов кислорода (6 в трех молекулах CH3COOH и 6 в трех молекулах CO2). Таким образом, перед формулой воды нужно поставить коэффициент 23: Посчитав водород слева и справа, мы убеждаемся, что коэффициенты расставлены верно. 2-метилпропен + K2Cr2O7 + H2SO4Запишем схему реакции и электронный баланс: Перенесем коэффициенты из баланса в схему: Перед сульфатом калия поставим коэффициент 4, чтобы уравнять количества атомов калия в левой и правой частях схемы: Перед серной кислотой поставим коэффициент 16, чтобы уравнять количество сульфатных групп: Последний коэффициент перед водой поставим по кислороду, игнорируя сульфатные группы, поскольку их количество уравнено. Слева мы видим 28 атомов кислорода. Справа, не считая воды, 9 атомов кислорода. Таким образом, перед водой необходимо поставить коэффициент 19. Далее, подсчитав водород в обеих частях уравнения, убеждаемся, что коэффициенты расставлены верно. 📸 ВидеоОКИСЛЕНИЕ АЛКЕНОВ ЕГЭ / жёсткое, мягкое окисление в органике с KMnO4Скачать  Вся теория по карбоновым кислотам для ЕГЭ | Химия ЕГЭ для 10 класса | УмскулСкачать  Окислительно-восстановительные реакции в кислой среде. Упрощенный подход.Скачать  Окисление алкенов с Тасей | Химия ЕГЭСкачать  Получение ЛЕДЯНОЙ УКСУСНОЙ кислоты!Скачать  Алкины.Окисление алкинов с KMnO4 и K2Cr2O7. Все 9 реакций ЕГЭСкачать  Окисление гомологов бензола в кислой средеСкачать  Алкены.Окисление алкенов с KMnO4 и K2Cr2O7. Все 14 реакций ЕГЭ.Скачать  Уравнивание реакции взаимодействия алкенов с перманганатом калия в кислой средеСкачать  11.2. Карбоновые кислоты: Способы получения. ЕГЭ по химииСкачать  Взаимодействие уксусной кислоты с металламиСкачать  Жёсткое окисление веществ на ЕГЭСкачать  |

 -связь – легко разрушается с образованием у углеродных атомов свободной валентности (неспаренного электрона). За счет оттягивания или отрыва освободившихся электронов и происходит окислительно-восстановительный процесс.
-связь – легко разрушается с образованием у углеродных атомов свободной валентности (неспаренного электрона). За счет оттягивания или отрыва освободившихся электронов и происходит окислительно-восстановительный процесс.

 вступающий в реакцию пропен
вступающий в реакцию пропен 
 углерод, обладающий большей электроотрицательностью, смещает к себе электронные пары двух связей
углерод, обладающий большей электроотрицательностью, смещает к себе электронные пары двух связей 



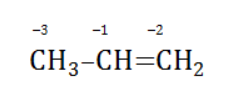

 в водном растворе диссоциирует на катион металла
в водном растворе диссоциирует на катион металла  и собственно окислитель – перманганат-анион
и собственно окислитель – перманганат-анион  . В ходе реакции марганец восстанавливается от степени окисления +7 +7 до той или иной величины в зависимости от среды.
. В ходе реакции марганец восстанавливается от степени окисления +7 +7 до той или иной величины в зависимости от среды.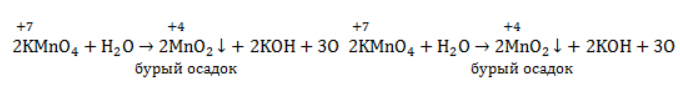
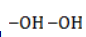 . Источниками их формирования служат:
. Источниками их формирования служат: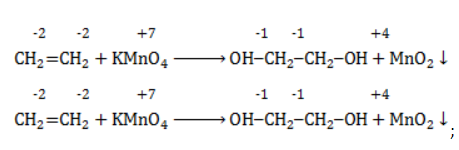

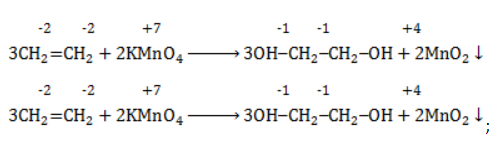
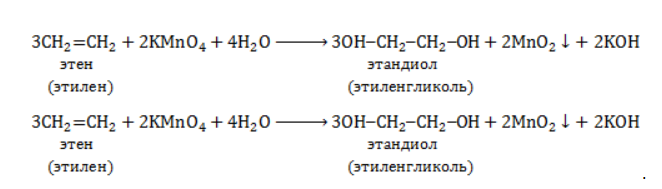
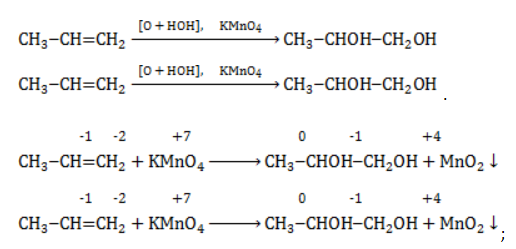
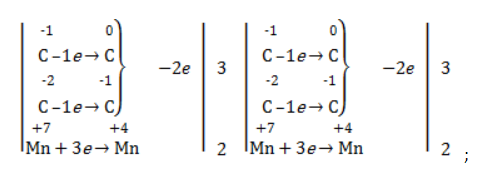
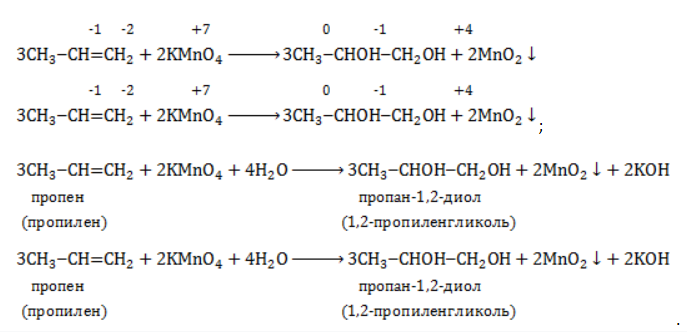
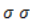 -связи в молекуле в мягких условиях сохраняются. Раствор перманганата теряет окраску, а оксид марганца выпадает в виде бурого осадка. Гидроксилирование, известное также как реакция Вагнера, служит для выявления в молекулах двойной связи.
-связи в молекуле в мягких условиях сохраняются. Раствор перманганата теряет окраску, а оксид марганца выпадает в виде бурого осадка. Гидроксилирование, известное также как реакция Вагнера, служит для выявления в молекулах двойной связи.
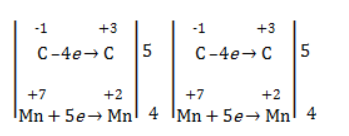


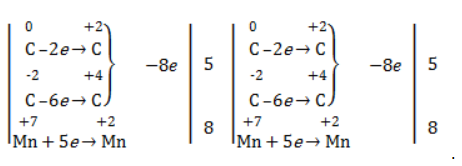

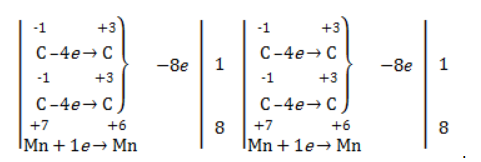




 .
.