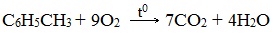Все реакции толуола (метилбензола) можно подразделить на два типа: реакции, затрагивающие бензольное кольцо и реакции, затрагивающие метильную группу.
Реакции замещения
1. Реакции с участием бензольного кольца
Метилбензол вступает во все реакции замещения, в которых участвует бензол, и проявляет при этом более высокую реакционную способность, реакции протекают с большой скоростью.
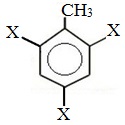
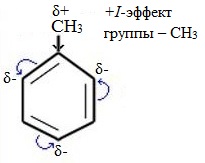
Метильный радикал, содержащийся в молекуле толуола, является ориентантом I рода, поэтому в результате реакций замещения в бензольном ядре получаются орто- и пара- производные толуола или при избытке реагента – трипроизводные общей формулы:
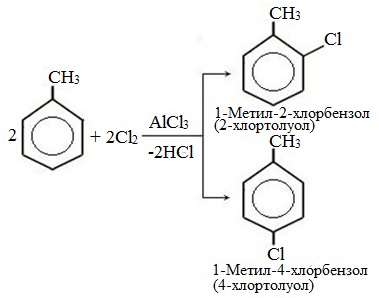
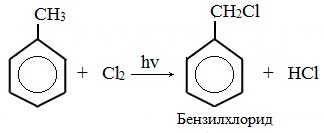
а) галогениерование
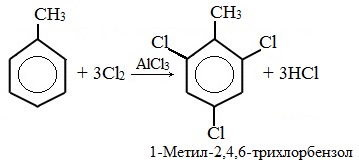
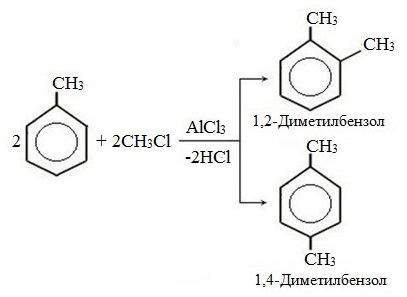
При избытке галогена можно получить ди- и три-замешенные производные в соответствии с правилами ориентации:
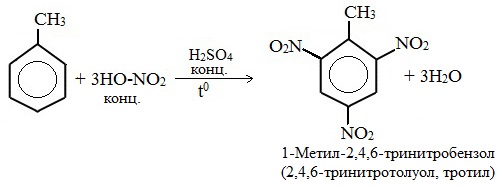
б) нитрование
Например, при нитровании толуола С6Н5CH3 (70°С) происходит замещение не одного, а трех атомов водорода с образованием 2,4,6-тринитротолуола:
Здесь ярко проявляется взаимное влияние атомов в молекуле на реакционную способность вещества. С одной стороны, метильная группа СH3 (за счет +I-эффекта) повышает электронную плотность в бензольном кольце в положениях 2, 4 и 6 и облегчает замещение именно в этих положениях:
С другой стороны, под влиянием бензольного кольца метильная группа СH3 в толуоле становится более активной в реакциях окисления и радикального замещения по сравнению с метаном СH4.
в) сульфирование
г) алкилирование
2. Реакции с участием боковой цепи
Метильная группа в метилбензоле может вступать в реакции, характерные для алканов:
Это объясняется тем, что на лимитирующей стадии легко (при невысокой энергии активации) образуется радикал бензил ·CH2-C6H5. Он более стабилен, чем алкильные свободные радикалы (·СН3, ·СH2R), т.к. его неспаренный электрон делокализован за счет взаимодействия с π- электронной системой бензольного кольца:
Реакции присоединения
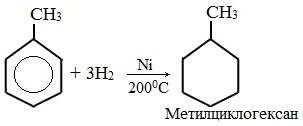
а) гидрирование
Реакции окисления
а) горение
б) неполное окисление
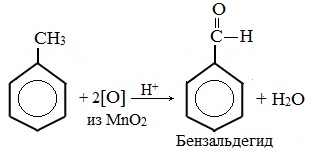
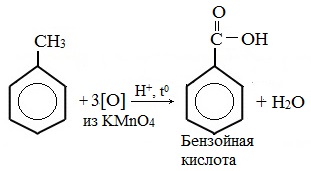
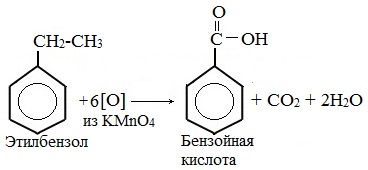
В отличие от бензола его гомологи подвергаются окислению легче предельных углеводородов. При этом окислению подвергаются лишь радикалы, связанные с бензольным кольцом, в случае толуола — метильная группа. Мягкие окислите (MnО2) окисляют ее до альдегидной группы, более сильные окислители (KMnO4) вызывают дальнейшее окисление до кислоты:
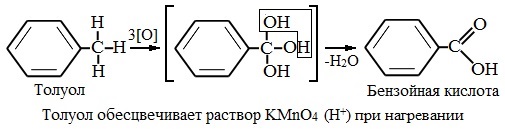
Толуол, в отличие от метана, окисляется в мягких условиях (обесцвечивает подкисленный раствор KMnO4 при нагревании).
Любой гомолог бензола с одной боковой цепью окисляется KMnO4 и другим сильным окислителем в бензойную кислоту:
Гомологи, содержащие две боковые цепи, дают двухосновные кислоты:
Видео:ОВР и Метод Электронного Баланса — Быстрая Подготовка к ЕГЭ по ХимииСкачать

Процесс окисления
Практическое значение реакций окисления чрезвычайно велико. В промышленности органического синтеза путем окисления получают разнообразные многотонажные полупродукты: синтетические жирные кислоты, малеиновый и фталевый ангидриды, окиси этилена и пропилена, ацетальдегид и др. Как правило, в указанных производствах используются наиболее прогрессивные методы: непрерывные технологические схемы, высокоэффективные катализаторы и производственное оборудование.
Рассмотрим окисление ароматических углеводородов. Ароматические углеводороды достаточно устойчивы к окислению. Во многих случаях окисления проводят при высокой температуре и на катализаторах. При окислении толуола и его производных хромовой кислотой, азотной кислотой, перманганатом калия и другими сильными окислителями образуются соответствующие карбоновые кислоты, например карбоновая кислота:
Данная реакция протекает по радикальному механизму. Первоначально происходит отрыв атома водорода от метильной группы с образованием радикала бензильного типа, который далее реагирует с кислородом воздуха с образованием пероксид- радикала. При взаимодействии этого радикала с исходным углеводородом образуются гидропероксид и радикал бензильного типа. Образовавшийся гидропероксид затем разлагается практически полностью до альдегида, который в этих условиях быстро превращается в кислоту:
В этих же условиях (кислород воздуха, температура 1500 °С, катализатор) окисляется п-ксилол, но при этом окислению подвергается одна метильная группа. При 260 — 280 °С и давлении 7 МПа окисляется и вторая метильная группа с образованием терефталевой кислоты:
Окисление бихроматом калия в серной кислоте применяется в производстве орто- и яс//ж/-нитробензойных кислот:
Установлено, что чем ниже температура реакции, тем выше должна быть концентрация серной кислоты.
Окисление метильной группы до карбоксильной кислородом воздуха требует применения катализаторов. Так, окисление толуола до бензойной кислоты кислородом воздуха протекает при температуре 140 °С и давлении 0,4 МПа в присутствии нафтена кобальта.
Большое значение в химико-фармацевтической промышленности получил синтез гетероаналога бензойной кислоты — никотиновой кислоты. Никотиновая кислота (|3-пиридинкарбоновая кислота, витамин РР) может быть получена окислением Р-пиколина ((3-метил пиридина) различными окислителями, в том числе перманганатом калия, в щелочной среде с последующим подкислением и выходом до 90 %.
Никотиновую кислоту получают также в виде ее амида методом окислительного аминирования. Этот метод не требует использования дефицитного и дорогостоящего перманганата калия. Процесс осуществляется непрерывно:
Реакция окисления ароматических углеводородов может протекать по двум направлениям: с разрушением углеводородного скелета молекулы и уменьшением числа атомов углерода или с разрывом связей углерод-углерод, но без изменения числа атомов углерода. Таким путем получают малеиновый и фталевый ангидриды, антрахинон и некоторые другие соединения. Для синтеза химико-фармацевтических препаратов из перечисленных соединений наибольшее значение имеет малеиновый ангидрид. Его получают окислением бензола воздухом в паровой фазе. Реакция протекает при высокой температуре в присутствии катализатора:
В качестве побочных продуктов при таких условиях окисления образуется шрс/-бензохинон:
Расщепление ароматического кольца происходит при окислении нафталина до фталевого ангидрида, где наблюдается разрыв связи С-С и уменьшение числа атомов углерода (деструктивное окисление):
В химико-фармацевтическом производстве указанный прием используется, например, при получении имидазол-4,5- дикарбоновой кислоты (синтез этимизола):
При окислении аценафтена получают нафталевую кислоту, при этом происходит разрыв связи С-С, но число атомов углерода остается прежним:
В заключение следует отметить, что качество и выход целевого продукта в каждом отдельном случае зависят от природы исходного сырья и окислителя, условий проведения процесса.
Видео:8 класс. ОВР. Окислительно-восстановительные реакции.Скачать

Окисление толуола уравнение условия проведения процесса технология проведения процесса
При изучении химических свойств бензола отмечают большую устойчивость его по отношению к окислителям. Легко показать на опыте химическую устойчивость бензола по сравнению с непредельными углеводородами, но не удается показать сравнение его в этом отношении с предельными углеводородами. Этот пробел может быть восполнен частично при ознакомлении со свойствами гомологов бензола. У гомологов бензола прежде всего окисляются боковые цепи, бензольное же ядро оказывается не затронутым, следовательно, можно предположить, что бензол по отношению к окислителям оказывается более устойчивым, чем предельные углеводороды.
В демонстрационной пробирке к 2-3 мл толуола добавляют такой же объем раствора перманганата калия, слегка подкисленного серной кислотой. Смесь взбалтывают и нагревают. Фиолетовая окраска перманганата калия исчезает. Произошло окисление толуола в бензойную кислоту:
Параллельно воспроизводят демонстрировавшийся ранее опыт с бензолом. Смесь его с раствором перманганата калия при нагревании не меняет окраски. Пробирки с веществами следует пронести по классу, чтобы учащиеся могли лучше наблюдать результаты опыта.
Опыт с толуолом можно продолжить, чтобы показать учащимся не только процесс окисления, но и продукт этой реакции окисления, отличный от толуола. После обесцвечивания раствора горячую жидкость фильтруют через бумажный фильтр и охлаждают в струе воды. Выделяются белые кристаллы бензойной кислоты С6Н5СООН.
🌟 Видео
РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Как выучить Химию с нуля за 10 минут? Принцип Ле-ШательеСкачать

Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Электролиз. 10 класс.Скачать

Составление ур-й окислительно-восст. реакций методом ионно-электронного баланса. 1ч. 10 класс.Скачать

Окислительно-восстановительные реакции в кислой среде. Упрощенный подход.Скачать

Окислительно-восстановительные реакции. Видеоурок по химии 9 классСкачать

Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Окислительно-восстановительные реакции. 1 часть. 10 класс.Скачать
Решение ОВР методом полуреакцийСкачать

Обратимость и необратимость химических реакций. Химическое равновесие. 1 часть. 9 класс.Скачать

ЭТОТ метод поможет на уроках ХИМИИ / Химия 9 классСкачать

Химия | Молекулярные и ионные уравненияСкачать

Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Химические уравнения. СЕКРЕТНЫЙ СПОСОБ: Как составлять химические уравнения? Химия 8 классСкачать

Химические уравнения - Как составлять уравнения реакций // Составление Уравнений Химических РеакцийСкачать

Учимся составлять электронный баланс/овр/8классСкачать

НИТРОВАНИЕ БЕНЗОЛА, ТОЛУОЛА, БЕНЗОЙНОЙ КИСЛОТЫСкачать