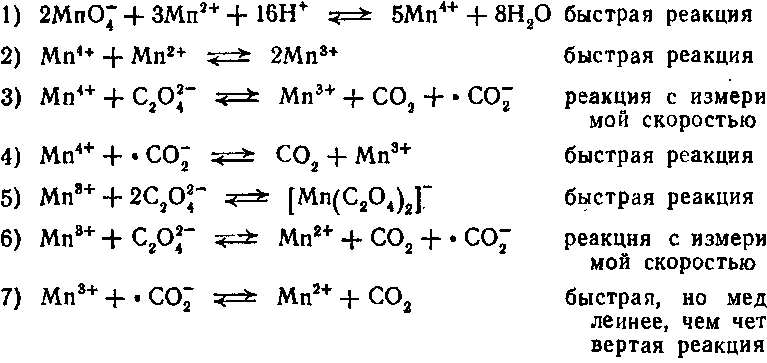Индуцированная реакция окисления оксалатов перманганатом калия довольно сложна. Механизм реакции пока еще полностью не выяснен. Реакция, по всей вероятности, является сопряженной, причем марганец(II) выполняет роль индуктора (поэтому реакцию относят к типу автокаталитических). В отсутствие марганца(II) реакция характеризуется длительным индукционным периодом, в течение которого происходит накопление ионов марганца в различной степени окисления. В присутствии марганца (II) реакция протекает практически мгновенно. По-видимому, наиболее вероятна следующая схема процесса [12]:
Марганец(III), кроме указанного комплекса с окса-лат-ионом, образует также комплексы состава

которые разлагаются с измеримой скоростью и замедляют окислительно-восстановительные реакции.
Щавелевая кислота, насыщенный раствор. Перманганат калия, 0,01 н. раствор. Сульфат марганца, 20%-иый раствор.
Выполнение опыта. В цилиндр поместить 200 мл раствора перманганата калия и 200 мл воды. На лекции разделить раствор на две части. К первой части добавить раствор щавелевой кислоты. Цвет не меняется. Ко второй части добавить столько же щавелевой кислоты и 50 мл раствора сульфата марганца. Раствор буреет, затем желтеет и, наконец, полностью обесцвечивается. Отметить, что приблизительно через 1 ч раствор и в первом цилиндре также обесцвечивается.
Примечание. Для успеха лекционного опыта рекомендуется в раствор сульфата марганца добавить равный объем 18 н. раствора серной кислоты.
- Acetyl
- Химические свойства алкадиенов
- Химические свойства сопряженных алкадиенов
- 1. Реакции присоединения
- 1.1. Гидрирование
- 1.2. Галогенирование алкадиенов
- 1.3. Гидрогалогенирование алкадиенов
- 1.5. Полимеризация
- 2. Окисление алкадиенов
- 2.1. Мягкое окисление алкадиенов
- 2.2. Жесткое окисление
- 2.3. Горение алкадиенов
- 📺 Видео
Видео:Щавелевая Кислота - КАЧЕСТВЕННАЯ РЕАКЦИЯСкачать

Acetyl
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. Видео:Окисление Кетонов Перманганатом Калия В Сернокислой СредеСкачать  Химические свойства алкадиеновАлкадиены – это непредельные (ненасыщенные) нециклические углеводороды, в молекулах которых присутствуют две двойные связи между атомами углерода С=С. Общая формула алкадиенов CnH2n-2 (как у алкинов, а также циклоалкенов), где n ≥ 3. Наличие двух двойных связей между атомами углерода очень сильно влияет на свойства углеводородов. В этой статье мы подробно остановимся на свойствах, способах получения и особенностях строения алкадиенов. Видео:Окисление органических соединений перманганатом калияСкачать  Химические свойства сопряженных алкадиеновСопряженные алкадиены – непредельные нециклические углеводороды, в молекулах которых две двойные связи образуют сопряженную систему. Химические свойства алкадиенов похожи на свойства алкенов. Алкадиены также легко вступают в реакции присоединения и окисления.
Видео:Реакция Гидрокарбоната Натрия и Щавелевой Кислоты. Реакция NaHCO3 и H2C2O4Скачать  1. Реакции присоединенияДля алкадиенов характерны реакции присоединения по одной из двойных связей С=С, либо по обоим связям. Реакции с водой, галогенами и галогеноводородами протекают по механизму электрофильного присоединения. При присоединении одной молекулы реагента к алкадиену рвется только одна двойная связь. При присоединении двух молекул реагента к алкадиену разрываются обе двойные связи.
1.1. ГидрированиеГидрирование алкадиенов протекает в присутствии металлических катализаторов, при нагревании и под давлением. При присоединении одной молекулы водорода к дивинилу образуется смесь продуктов (бутен-1 и бутен-2): Соотношение продуктов 1,2- и 1,4- присоединения зависит от условий реакции.
При полном гидрировании дивинила образуется бутан: 1.2. Галогенирование алкадиеновПрисоединение галогенов к алкадиенам происходит даже при комнатной температуре в растворе (растворители — вода, CCl4).
Побочным продуктом бромирования дивинила является 3,4-дибромбутен-1: При полном бромировании дивинила образуется 1,2,3,4-тетрабромбутан: 1.3. Гидрогалогенирование алкадиеновАлкадиены взаимодействуют с галогеноводородами. При присоединении хлороводорода к бутадиену-1,3 преимущественно образуется 1-хлорбутен-2: 3-Хлорбутен-1 образуется в небольшом количестве. При присоединении полярных молекул к алкадиенам образуется смесь изомеров. При этом выполняется правило Марковникова.
1.5. ПолимеризацияПолимеризация — это процесс многократного соединения молекул низкомолекулярного вещества (мономера) друг с другом с образованием высокомолекулярного вещества (полимера). nM → Mn (M – это молекула мономера)
Продукт полимеризации дивинила (бутадиена) называется искусственным каучуком: При полимеризации изопрена образуется природный (натуральный) каучук: Видео:Окисление органических веществ | Химия ЕГЭ для 10 класса | УмскулСкачать  2. Окисление алкадиеновРеакции окисления в органической химии сопровождаются увеличением числа атомов кислорода (или числа связей с атомами кислорода) в молекуле и/или уменьшением числа атомов водорода (или числа связей с атомами водорода). В зависимости от интенсивности и условий окисление можно условно разделить на мягкое и жесткое. 2.1. Мягкое окисление алкадиеновМягкое окисление алкадиенов протекает при низкой температуре в присутствии перманганата калия. При этом раствор перманганата обесцвечивается. В молекуле алкадиена разрываются только π-связи и окисляются атомы углерода при двойных связях. При этом образуются четырехатомные спирты.
2.2. Жесткое окислениеПри жестком окислении под действием перманганатов или соединений хрома (VI) происходит полный разрыв двойных связей С=С и связей С-Н у атомов углерода при двойных связях. При этом у окисляемых атомов углерода образуются связи с атомами кислорода. Так, если у атома углерода окисляется одна связь, то образуется группа С-О-Н (спирт). При окислении двух связей образуется двойная связь с атомом углерода: С=О, при окислении трех связей — карбоксильная группа СООН, четырех — углекислый газ СО2. Можно составить таблицу соответствия окисляемого фрагмента молекулы и продукта:
При окислении бутадиена-1,3 перманганатом калия в среде серной кислоты возможно образование щавелевой кислоты и углекислого газа: 2.3. Горение алкадиеновАлкадиены, как и прочие углеводороды, горят в присутствии кислорода с образованием углекислого газа и воды. В общем виде уравнение сгорания алкадиенов выглядит так: 📺 ВидеоКак и когда применять щавелевую кислоту для борьбы с клещем Варроа? (КПБ)Скачать  Алкины.Окисление алкинов с KMnO4 и K2Cr2O7. Все 9 реакций ЕГЭСкачать  Перманганат калия: химические свойства, качественные реакции, ОВР в органике и неорганикеСкачать  Необычное окисление ацетилена #органическаяхимия #ацетиленСкачать  Щавелевая кислота убивает пчел.Скачать  Взаимодействие ацетилена с раствором перманганата калияСкачать  Окисление ВСЕХ органических веществ за 4 часа | Химия ЕГЭ 2023 | УмскулСкачать  КОНТРОЛЬ СЕМЕЙ ПОСЛЕ ОБРАБОТКИ ЩАВЕЛЕВОЙ КИСЛОТОЙ 3,5.Скачать  Получение щавелевой кислоты из сахараСкачать  Сублиматор щавелевой кислоты Щавелевая кислота и аскосферозСкачать  Получение пирофорного железа Щавелевая кислота гидроксид калия железный купорос Желтый осадок Искры!Скачать  Реакция НИТРАТА СЕРЕБРА и ЩАВЕЛЕВОЙ КИСЛОТЫ.Reaction of SILVER NITRATE and OXALIC ACID.Опыты химияСкачать  Профессор Кашковский про обработку щавелевой кислотой во время взяткаСкачать  Профессор Кашковский про обработку щавелевой кислотой на сахарном сиропеСкачать  сублиматор для испарения щавелевой кислотыСкачать  |