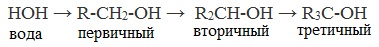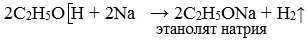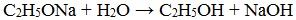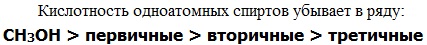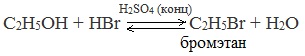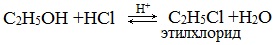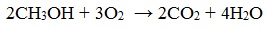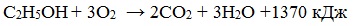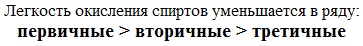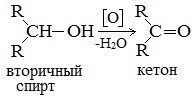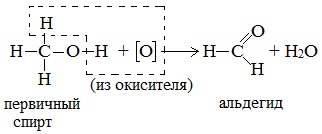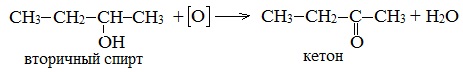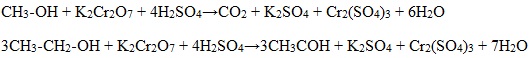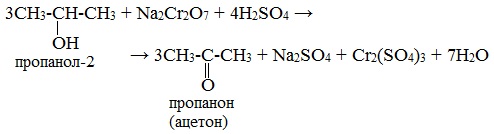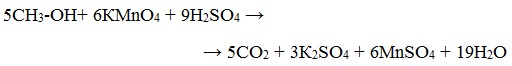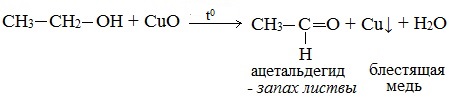Метанол CH3OH, метиловый спирт – это органическое вещество, предельный одноатомный спирт .
Общая формула предельных нециклических одноатомных спиртов: CnH2n+2O.
- Строение метанола
- Водородные связи и физические свойства метанола
- Изомерия метанола
- Химические свойства метанола
- 1.1. Взаимодействие с раствором щелочей
- 1.2. Взаимодействие с металлами (щелочными и щелочноземельными)
- 2. Реакции замещения группы ОН
- 2.1. Взаимодействие с галогеноводородами
- 2.2. Взаимодействие с аммиаком
- 2.3. Этерификация (образование сложных эфиров)
- 2.4. Взаимодействие с кислотами-гидроксидами
- 3. Реакции замещения группы ОН
- 3.2. Межмолекулярная дегидратация
- 4. Окисление метанола
- 4.1. Окисление оксидом меди (II)
- 4.2. Окисление кислородом в присутствии катализатора
- 4.3. Жесткое окисление
- 4.4. Горение метанола
- 5. Дегидрирование спиртов
- Получение метанола
- 1. Щелочной гидролиз галогеналканов
- 2. Гидратация алкенов
- 3. Гидрирование карбонильных соединений
- 4. Промышленное получение метанола из «синтез-газа»
- Составление уравнений окислительно-восстановительных реакций с участием органических веществ
- Окисление метанола перманганатом калия в кислой среде уравнение
- Реакции замещения
- Реакции этерификации
- Реакции отщепления
- Реакции окисления
- Качественные реакции на спирты
- 🌟 Видео
Видео:Окисление органических соединений перманганатом калияСкачать

Строение метанола
В молекулах спиртов, помимо связей С–С и С–Н, присутствуют ковалентные полярные химические связи О–Н и С–О.
| Электроотрицательность кислорода (ЭО = 3,5) больше электроотрицательности водорода (ЭО = 2,1) и углерода (ЭО = 2,4). |
Электронная плотность обеих связей смещена к более электроотрицательному атому кислорода:
| Атом кислорода в спиртах находится в состоянии sp 3 -гибридизации. |
В образовании химических связей с атомами C и H участвуют две 2sp 3 -гибридные орбитали, а еще две 2sp 3 -гибридные орбитали заняты неподеленными электронными парами атома кислорода.
Поэтому валентный угол C–О–H близок к тетраэдрическому и составляет почти 108 о .
Водородные связи и физические свойства метанола
Спирты образуют межмолекулярные водородные связи. Водородные связи вызывают притяжение и ассоциацию молекул спиртов:
Поэтому метанол – жидкость с относительно высокой температурой кипения (температура кипения метанола +64,5 о С).
Водородные связи образуются не только между молекулами метанола, но и между молекулами метанола и воды. Поэтому метанол очень хорошо растворимы в воде. Молекулы метанола в воде гидратируются:
| Чем больше углеводородный радикал, тем меньше растворимость спирта в воде. Чем больше ОН-групп в спирте, тем больше растворимость в воде. |
Метанол смешивается с водой в любых соотношениях.
Видео:Окисление Этанола Перманганатом Калия В Сернокислой Среде.Скачать

Изомерия метанола
Для метанола не характерно наличие структурных изомеров – ни изомеров углеродного скелета, ни изомеров положения гидроксильной группы, ни межклассовых изомеров.
Видео:Окисление этанола раствором перманганата калияСкачать

Химические свойства метанола
Метанол – органическое вещество, молекула которого содержит, помимо углеводородной цепи, одну группу ОН.
1. Кислотные свойства метанола
| Метанол – неэлектролит, в водном растворе не диссоциирует на ионы; кислотные свойства у него выражены слабее, чем у воды. |
1.1. Взаимодействие с раствором щелочей
Метанол с растворами щелочей практически не реагирует, т. к. образующиеся алкоголяты почти полностью гидролизуются водой.
Равновесие в этой реакции так сильно сдвинуто влево, что прямая реакция не идет. Поэтому метанол не взаимодействуют с растворами щелочей.
1.2. Взаимодействие с металлами (щелочными и щелочноземельными)
Метанол взаимодействуют с активными металлами (щелочными и щелочноземельными). При этом образуются алкоголяты. При взаимодействии с металлами спирты ведут себя, как кислоты.
| Например, метанол взаимодействует с калием с образованием метилата калия и водорода . |
Метилаты под действием воды полностью гидролизуются с выделением спирта и гидроксида металла.
| Например, метилат калия разлагается водой: |
CH3OK + H2O → CH3-OH + KOH
Видео:Окислительно-восстановительные реакции в кислой среде. Продвинутый подход.Скачать

2. Реакции замещения группы ОН
2.1. Взаимодействие с галогеноводородами
При взаимодействии метанола с галогеноводородами группа ОН замещается на галоген и образуется галогеналкан.
| Например, метанол реагирует с бромоводородом. |
2.2. Взаимодействие с аммиаком
Гидроксогруппу спиртов можно заместить на аминогруппу при нагревании спирта с аммиаком на катализаторе.
| Например, при взаимодействии метанола с аммиаком образуется метиламин. |
2.3. Этерификация (образование сложных эфиров)
Метанол вступает в реакции с карбоновыми кислотами, образуя сложные эфиры.
| Например, метанол реагирует с уксусной кислотой с образованием метилацетата (метилового эфира уксусной кислоты): |
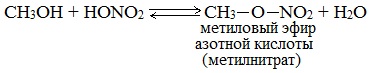
2.4. Взаимодействие с кислотами-гидроксидами
Спирты взаимодействуют и с неорганическими кислотами, например, азотной или серной.
| Например, метанол взаимодействует с азотной кислотой : |
Видео:Окисление Толуола Перманганатом Калия В Сернокислой СредеСкачать

3. Реакции замещения группы ОН
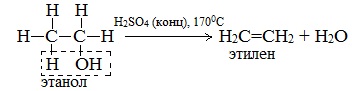
В присутствии концентрированной серной кислоты от метанола отщепляется вода. Процесс дегидратации протекает по двум возможным направлениям: внутримолекулярная дегидратация и межмолекулярная дегидратация.
3.2. Межмолекулярная дегидратация
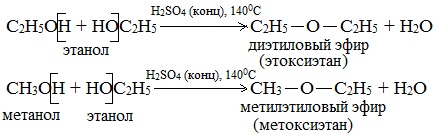
При низкой температуре (меньше 140 о С) происходит межмолекулярная дегидратация по механизму нуклеофильного замещения: ОН-группа в одной молекуле спирта замещается на группу OR другой молекулы. Продуктом реакции является простой эфир.
| Например, при дегидратации метанола при температуре до 140 о С образуется диметиловый эфир: |
Видео:Окисление органических веществ | Химия ЕГЭ для 10 класса | УмскулСкачать

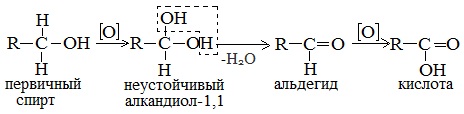
4. Окисление метанола
Реакции окисления в органической химии сопровождаются увеличением числа атомов кислорода (или числа связей с атомами кислорода) в молекуле и/или уменьшением числа атомов водорода (или числа связей с атомами водорода).
В зависимости от интенсивности и условий окисление можно условно разделить на каталитическое, мягкое и жесткое.
| Метанол окисляется сначала в формальдегид, затем в углекислый газ: Метанол → формальдегид → углекислый газ |
Типичные окислители — оксид меди (II), перманганат калия KMnO4, K2Cr2O7, кислород в присутствии катализатора.
Легкость окисления спиртов уменьшается в ряду:
метанол
4.1. Окисление оксидом меди (II)
Метанол можно окислить оксидом меди (II) при нагревании. При этом медь восстанавливается до простого вещества. Метанол окисляется до метаналя.
| Например, метанол окисляется оксидом меди до муравьиного альдегида |
4.2. Окисление кислородом в присутствии катализатора
Метанол можно окислить кислородом в присутствии катализатора (медь, оксид хрома (III) и др.). Метанол окисляется до метаналя.
4.3. Жесткое окисление
При жестком окислении под действием перманганатов или соединений хрома (VI) метанол окисляется до углекислого газа.
| Спирт/ Окислитель | KMnO4, кислая среда | KMnO4, H2O, t |
| Метанол СН3-ОН | CO2 | K2CO3 |
| Например, при взаимодействии метанола с перманганатом калия в серной кислоте образуется углекислый газ |
4.4. Горение метанола
При сгорании спиртов образуются углекислый газ и вода и выделяется большое количество теплоты.
| Например, уравнение сгорания метанола: |
Видео:Окисление Спирта Дихроматом Аммония В Сернокислой Среде.Скачать

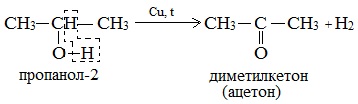
5. Дегидрирование спиртов
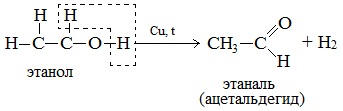
При нагревании спиртов в присутствии медного катализатора протекает реакция дегидрирования. При дегидрировании метанола образуется альдегид.
Видео:Окисление Кетонов Перманганатом Калия В Сернокислой СредеСкачать

Получение метанола
Видео:Спирты: химические свойства | Химия ЕГЭ для 10 класса | УмскулСкачать

1. Щелочной гидролиз галогеналканов
При взаимодействии галогеналканов с водным раствором щелочей образуются спирты. Атом галогена в галогеналкане замещается на гидроксогруппу.
| Например, при нагревании хлорметана с водным раствором гидроксида натрия образуется метанол |
Видео:окисление алкенов в кислой средеСкачать

2. Гидратация алкенов
Гидратация (присоединение воды) алкенов протекает в присутствии минеральных кислот. При присоединении воды к алкенам образуются спирты.
Однако получить метанол гидратацией алкенов нельзя.
Видео:Спирты. Окисление с KMnO4 и K2Cr2O7. Все 12 реакций ЕГЭ.Скачать

3. Гидрирование карбонильных соединений
Присоединение водорода к альдегидам и кетонам протекает при нагревании в присутствии катализатора. При гидрировании альдегидов образуются первичные спирты, при гидрировании кетонов — вторичные спирты, а из формальдегида образуется метанол.
| Например, при гидрировании формальдегида образуется метанол |
CH2=O + H2 → CH3-OH
Видео:Самый легкий способ уравнять ОВР в органике!Скачать

4. Промышленное получение метанола из «синтез-газа»
Каталитический синтез метанола из монооксида углерода и водорода при 300-400°С и давления 500 атм в присутствии смеси оксидов цинка, хрома и др.
Сырьем для синтеза метанола служит «синтез-газ» (смесь CO и H2), обогащенный водородом:
Видео:Окисление этанола (тест на алкоголь)Скачать

Составление уравнений окислительно-восстановительных реакций с участием органических веществ
В связи с введением в качестве единственной формы итоговой аттестации выпускников средней школы единого государственного экзамена (ЕГЭ) и переходом старшей школы на профильное обучение все большую актуальность приобретает подготовка старшеклассников к выполнению наиболее “дорогих” в балльном отношении заданий части “С” теста ЕГЭ по химии. Несмотря на то, что пять заданий части “С” считаются разными: химические свойства неорганических веществ, цепочки превращений органических соединений, расчетные задачи, – все они в той или иной мере связаны именно с окислительно-восстановительными реакциями (ОВР). Если усвоены основные знания теории ОВР, то можно правильно выполнить первое и второе задания полностью, а третье – частично. На наш взгляд, значительная часть успеха при выполнении части “С” заключается именно в этом. Опыт показывает, что если, изучая неорганическую химию, ученики достаточно хорошо справляются с заданиями по написанию уравнений ОВР, то аналогичные задания по органической химии вызывают у них большие трудности. Поэтому на протяжении изучения всего курса органической химии в профильных классах мы стараемся сформировать у старшеклассников навыки составления уравнений ОВР.
При изучении сравнительной характеристики неорганических и органических соединений мы знакомим учащихся с использованием степени окисления (с.о.) (в органической химии прежде всего углерода) и способами ее определения:
1) вычисление средней с.о. углерода в молекуле органического вещества;
2) определение с.о. каждого атома углерода.
Уточняем, в каких случаях лучше использовать тот или иной способ.
Статья опубликована при поддержке компании «ГЕО-Инжиниринг», представляющей на рынке продукцию под брендом «ProfKresla». Сфера деятельности компании — производство, продажа и установка кресел и стульев для различных залов. Высокий профессионализм сотрудников и собственные производственные мощности позволяют быстро и качественно реализовывать проекты любой степени сложности. Всю продукцию под брендом «ProfKresla», будь тоТеатральные кресла, сидения для залов ожидания или стулья для учебных заведений, отличают современный и эргономичный дизайн, а также высокая износостойкость, прочность и комфорт. Из огромного ассортимента продукции, представленного в каталоге на сайте profkresla.ru, Вы всегда сможете подобрать модели, наилучшим образом соответствующие корпоративному стилю, принятому в Вашей компании. Если же у Вас все-таки возникнут трудности с выбором, то специалисты компании всегда готовы дать консультацию, помочь определиться с моделью, после чего подготовить проект, на месте произвести все необходимые замеры и установку.
При изучении темы “Алканы” показываем, что процессы окисления, горения, галогенирования, нитрования, дегидрирования, разложения относятся к окислительно-восстановительным процессам. При написании уравнений реакций горения и разложения органических веществ лучше использовать среднее значение с.о. углерода. Например:
Обращаем внимание на первую половину электронного баланса: у атома углерода в дробном значении с.о. знаменатель равен 4, поэтому расчет передачи электронов ведем по этому коэффициенту.
В остальных случаях при изучении темы “Алканы” определяем значения с.о. каждого атома углерода в соединении, обращая при этом внимание учащихся на последовательность замещения атомов водорода у первичных, вторичных, третичных атомов углерода:
Таким образом мы подводим учащихся к выводу, что в начале протекает процесс замещения у третичных, затем – у вторичных, и, в последнюю очередь – у первичных атомов углерода.
При изучении темы “Алкены” рассматриваем процессы окисления в зависимости от строения алкена и среды протекания реакции.
При окислении алкенов концентрированным раствором перманганата калия KMnO4 в кислой среде (жесткое окисление) происходит разрыв 

Если двойная связь находится на конце молекулы (например, у бутена-1), то одним из продуктов окисления является муравьиная кислота, легко окисляющаяся до углекислого газа и воды:
Подчеркиваем, что если в молекуле алкена атом углерода при двойной связи содержит два углеродных заместителя (например, в молекуле 2-метилбутена-2), то при его окислении происходит образование кетона, т. к. превращение такого атома в атом карбоксильной группы невозможно без разрыва C–C-связи, относительно устойчивой в этих условиях:
Уточняем, что если молекула алкена симметрична и двойная связь содержится в середине молекулы, то при окислении образуется только одна кислота:
Сообщаем, что особенностью окисления алкенов, в которых атомы углерода при двойной связи содержат по два углеродных радикала, является образование двух кетонов:
Рассматривая окисление алкенов в нейтральной или слабощелочной средах, акцентируем внимание старшеклассников на том, что в таких условиях окисление сопровождается образованием диолов (двухатомных спиртов), причем гидроксильные группы присоединяются к тем атомам углерода, между которыми существовала двойная связь:
В аналогичном плане рассматриваем окисление ацетилена и его гомологов в зависимости от того, в какой среде протекает процесс. Так, уточняем, что в кислой среде процесс окисления сопровождается образованием карбоновых кислот:
Реакция используется для определения строения алкинов по продуктам окисления:
В нейтральной и слабощелочной средах окисление ацетилена сопровождается образованием соответствующих оксалатов (солей щавелевой кислоты), а окисление гомологов – разрывом тройной связи и образованием солей карбоновых кислот:
Все правила отрабатываются с учащимися на конкретных примерах, что приводит к лучшему усвоению ими теоретического материала. Поэтому при изучении окисления аренов в различных средах ученики могут самостоятельно высказать предположения, что в кислой среде следует ожидать образования кислот, а в щелочной – солей. Учителю останется только уточнить, какие продукты реакции образуются в зависимости от строения соответствующего арена.
Показываем на примерах, что гомологи бензола с одной боковой цепью (независимо от ее длины) окисляются сильным окислителем до бензойной кислоты по 
Подчеркиваем, что если в молекуле арена несколько боковых цепей, то в кислой среде каждая из них окисляется по a-углеродному атому до карбоксильной группы, в результате чего образуются многоосновные ароматические кислоты:
Полученные навыки составления уравнений ОВР для углеводородов позволяют использовать их при изучении раздела “Кислородсодержащие соединения”.
Так, при изучении темы “Спирты” учащиеся самостоятельно составляют уравнения окисления спиртов, используя следующие правила:
1) первичные спирты окисляются до альдегидов
2) вторичные спирты окисляются до кетонов
3) для третичных спиртов реакция окисления не характерна.
В целях подготовки к ЕГЭ учителю целесообразно дать дополнительные сведения к указанным свойствам, что, несомненно, будет полезным для учащихся.
При окислении метанола подкисленным раствором перманганата калия или дихромата калия образуется CO2, первичные спирты при окислении в зависимости от условий протекания реакции могут образовать не только альдегиды, но и кислоты. Например, окисление этанола дихроматом калия на холоду заканчивается oбразованием уксусной кислоты, а при нагревании – ацетальдегида:
3CH3–CH2OH + K2Cr2O7 + 4H2SO4 
Вновь напомним учащимся о влиянии среды на продукты реакций окисления спиртов, а именно: горячий нейтральный раствор KMnO4 окисляет метанол до карбоната калия, а остальные спирты – до солей соответствующих карбоновых кислот:
При изучении темы “Альдегиды и кетоны” акцентируем внимание учащихся на том, что альдегиды легче, чем спирты, окисляются в соответствующие карбоновые кислоты не только под действием сильных окислителей (кислород воздуха, подкисленные растворы KMnO4 и K2Cr2O7), но и под действием слабых (аммиачный раствор оксида серебра или гидроксида меди(II)):
CH3–CHO + 2[Ag(NH3)2]OH 
Особое внимание уделяем окислению метаналя аммиачным раствором оксида серебра, т.к. в этом случае образуется карбонат аммония, а не муравьиная кислота:
Как показывает наш многолетний опыт, предложенная методика обучения старшеклассников составлению уравнений ОВР с участием органических веществ повышает их итоговый результат ЕГЭ по химии на несколько баллов.
Видео:Реакции окисления спиртов | ХимияСкачать

Окисление метанола перманганатом калия в кислой среде уравнение
Химические свойства спиртов ROH определяются наличием полярных связей 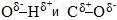
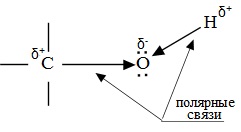
O–H (с отщеплением водорода)
Это могут быть реакции замещения, в которых происходит замена ОН или Н, или реакция отщепления (элиминирования), когда образуется двойная связь.
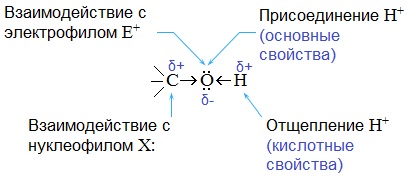
Полярный характер связей С–О и О–Н способствует гетеролитическому их разрыву и протеканию реакций по ионному механизму. При разрыве связи О–Н с отщеплением протона (Н + ) проявляются кислотные свойства гидроксисоединения, а при разрыве связи С–О — свойства основания и нуклеофильного реагента.
С разрывом связи О–Н идут реакции окисления, а по связи С–О – восстановления.
Различают два основных типа реакций спиртов с участием функциональной группы –ОН:
1) Реакции с разрывом связи О-Н:
а) взаимодействие спиртов со щелочными металлами с образованием алкоголятов;
б) реакции спиртов с органическими и минеральными кислотами с образованием сложных эфиров;
в) окисление спиртов под действием дихромата или перманганата калия до карбонильных соединений.
2) Реакции сопровождающиеся разрывом связи С-О:
а) каталитическая дегидратация с образованием алкенов (внутримолекулярная дегидратация) или простых эфиров (межмолекулярная дегидратация);
б) замещение группы –ОН галогеном, например при действии галогеноводородов с образованием алкилгалогенидов.
Спирты – амфотерные соединения.
Реакции замещения
Кислотно-основные свойства  Кислотные свойства уменьшаются в ряду, а основные возрастают:
Кислотные свойства уменьшаются в ряду, а основные возрастают: 
Кислотные свойства
1. Взаимодействие со щелочными и щелочноземельными металлами (Li, Na, K, Ca, Ba, Sr)
Реакции с разрывом связи О-Н
При действии на спирты активных металлов в безводной среде атом водорода гидроксильной группы замещается на металл:
Образующиеся соединения (соли спиртов) называются алкоголятами — производные метилового спирта – метил ат ами, производные этилового спирта – этил ат ами.
Видеоопыт «Взаимодействие спиртов с металлическим натрием»
Алкоголяты химически не стабильны и при действии воды они полностью гидролизуются с образованием исходного спирта и щелочи:
Эта реакция показывает, что спирты по сравнению с водой являются более слабыми кислотами (сильная кислота вытесняет слабую). При взаимодействии с растворами щелочей спирты не образуют алкоголяты.
Спирты не взаимодействуют с водными растворами щелочей.
Основные свойства
2.Взаимодействие с галогенводородными кислотами
Реакции с разрывом связи С-О
Замещение гидроксила ОН на галоген происходит в реакции спиртов с галогеноводородами в присутствии катализатора – сильной минеральной кислоты (например, конц. H2SO4). При этом спирты проявляют свойства слабых оснований:
Видеоопыт «Взаимодействие этилового спирта с бромоводородом»
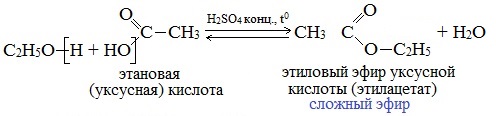
Реакции этерификации
Реакции с разрывом связи О-Н
Спирты вступают в реакции с минеральными и органическими кислотами, образуя сложные эфиры. Реакция обратима (обратный процесс – гидролиз сложных эфиров).
Отличительной особенностью этой реакции является то, что атом Н отщепляется от спирта, а группа ОН – от кислоты:
Реакционная способность одноатомных спиртов в этих реакциях убывает от первичных к третичным.
Реакции отщепления
1. Дегидратация (отщепление воды)
Реакции с разрывом связи С-О
При действии на спирты водоотнимающих реагентов, например, концентрированной серной кислоты, происходит отщепление воды – дегидратация.
Она может протекать по двум направлениям: с участием одной молекулы спирта (внутримолекулярная дегидратация, приводящая к образованию алкенов) или с участием двух молекул спирта (межмолекулярная дегидратация, приводящая к получению простых эфиров).
При переходе от первичных спиртов к третичным увеличивается склонность к отщеплению воды и образованию алкенов и уменьшается способность образовывать простые эфиры.
а) Межмолекулярная дегидратация спиртов с образованием простых эфиров R-O-R’. Эти реакции могут протекать с участием одного спирта или смеси двух и более спиртов:
б) Внутримолекулярная дегидратация спиртов с образованием алкенов. Протекает при более высокой температуре. В отличие от межмолекулярной дегидратации в процессе этих реакций происходит отщепление молекулы воды от одной молекулы спирта:
Такие реакции отщепления называются реакциями элиминирования.
Первый член гомологического ряда алканолов – метанол СН3ОН – не вступает в реакции внутримолекулярной дегидратации.
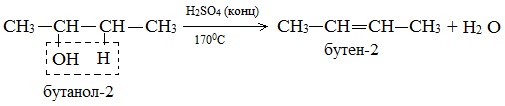
Дегидратация вторичных и третичных спиртов происходит по правилу Зайцева:
2. Дегидрирование
Реакции с разрывом связей О-Н и С-Н
а) При дегидрировании первичных спиртов образуются альдегиды:
Реакция происходит при пропускании нагретых до 300 0 С паров спирта без доступа воздуха над металлическими катализаторами (Cu или металлы платиновой группы – Pd, Pt, Ni). Ni является типичным катализатором дегидрирования или гидрирования, т.е. отщепления или присоединения водорода.
В организме человека этот процесс происходит под действием (алкогольдегидрогеназы).
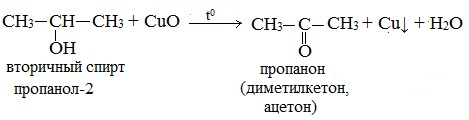
б) При дегидрировании вторичных спиртов образуются кетоны:
Третичные спирты не подвергаются дегидрированию.
Реакции окисления
Для спиртов характерны реакции горения с образованием углекислого газа и воды, а также реакции окисления, приводящие к получению альдегидов, кетонов и карбоновых кислот.
В лабораторных условиях для окисления спиртов обычно используют подкисленные растворы перманганата или дихромата калия, оксид меди и т.д.
1. Горение (полное окисление)
Спирты горят на воздухе с выделением большого количества тепла. С увеличением массы углеводородного радикала – пламя становится всё более коптящим.
При сгорании спиртов выделяется большое количество тепла:
Благодаря высокой экзотермичности реакции горения этанола, он считается перспективным и экологически чистым заменителем бензинового топлива в двигателях внутреннего сгорания. В этом случае энергия химических связей переходит в тепловую энергию, а затем в механическую, что позволяет двигаться автомобилям. В лабораторной практике этанол применяется как горючее для «спиртовок».
2. Неполное окисление
1). В присутствии окислителей [O] – K 2 Cr 2 O 7 или KMnO 4 спирты окисляются до карбонильных соединений:
Первичные спирты при окислении образуют альдегиды, которые затем легко окисляются до карбоновых кислот.
При окислении вторичных спиртов образуются кетоны.
Видеоопыт «Окисление этилового спирта раствором перманганата калия»
Видеоопыт «Окисление этилового спирта кристаллическим перманганатом калия»
Видеоопыт «Каталитическое окисление этанола»
Видеоопыт «Окисление этанола (тест на алкоголь)»
Третичные спирты более устойчивы к действию окислителей. Они окисляются только в жестких условиях (кислая среда, повышенная температура), что приводит к разрушению углеродного скелета молекулы и образованию смеси продуктов (карбоновых кислот и кетонов с меньшей молекулярной массой).
Качественные реакции на спирты
1. Окисление спиртов дихроматом (Na2Cr2O7) или перманганатом (КMnО4)
Качественная реакция на первичные и вторичные спирты!
В кислой среде
Для первичных и вторичных одноатомных спиртов качественной реакцией является взаимодействие их с раствором дихромата натрия. Для повышения скорости реакции ее проводят при нагревании, для создания кислой среды добавляют серную кислоту.
Первичные спирты окисляются дихроматом натрия до альдегидов.
Растворы дихроматов имеют оранжевый цвет и содержат хром в степени окисления +6. В кислой среде они переходят в растворы солей хрома в степени окисления +3 и приобретают зеленый цвет.
На изменении цвета соединений хрома также основана работа алкотестеров, когда пары спирта, содержащиеся в выдыхаемом водителем воздухе, восстанавливают дихромат в стеклянной трубочке.
Вторичные спирты окисляются дихроматом натрия до кетонов.
Третичные спирты в реакции с дихроматами не вступают.
Т.к. перманганат калия в кислой среде более сильный окислитель, чем дихромат, то окисление спирта не останавливается на стадии альдегида и продолжается дальше до карбоновой кислоты.
Раствор перманганата калия содержит марганец в степени окисления +7 и имеет розово-фиолетовый цвет. Если спирт взять в достаточном количестве, то произойдет обесцвечивание раствора. В кислой среде марганец перейдет в степень окисления +2.
Также как и дихроматом натрия, перманганатом калия вторичные спирты могут окисляться до кетонов. Далее возможна деструкция, т.е. разрушение органической молекулы и получение смеси веществ, которые не имеют практического применения.
В жёстких условиях с перманганатом калия третичные спирты окисляются с расщеплением связей С-С и образованием смеси веществ.
Метиловый спирт окисляется перманганатом калия до углекислого газа.
2. Окисление спиртов оксидом меди (II)
Качественная реакция на первичные спирты!
Первичные спирты окисляются оксидом меди (II) до альдегидов.
Видеоопыт «Окисление этилового спирта оксидом меди (II)»
Видеоопыт «Качественная реакция на этанол»
Вторичные спирты окисляются оксидом меди (II) до кетонов.
Третичные спирты оксидом меди (II) не окисляются.
Реакции неполного окисления спиртов по своим результатам аналогичны реакциям дегидрирования.
🌟 Видео
ОВР 10 занятие Окисление спиртов и феноловСкачать

Вся теория по спиртам для ЕГЭ | Химия ЕГЭ для 10 класса | УмскулСкачать

Жёсткое окисление веществ на ЕГЭСкачать

7.4. Спирты: Химические свойства. ЕГЭ по химииСкачать

Уравнивание органических ОВР за 12 минут | ХИМИЯ ЕГЭ | СОТКАСкачать

Окисление алкенов с Тасей | Химия ЕГЭСкачать





























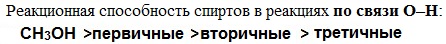

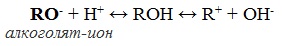 Кислотные свойства уменьшаются в ряду, а основные возрастают:
Кислотные свойства уменьшаются в ряду, а основные возрастают: