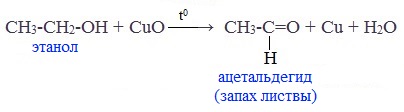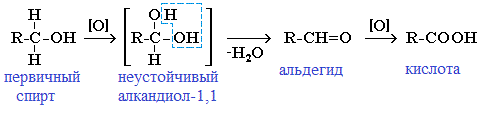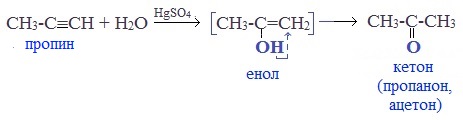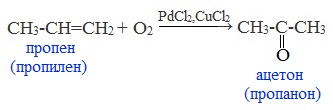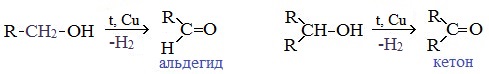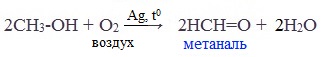1. Окисление спиртов
В лаборатории карбонильные соединения получают окислением спиртов в жестких условиях в присутствии сильных окислителей (дихромата калия К2Cr2O7 или перманганата калия КМnО4) в серной кислоте Н2SO4. В качестве окислителя можно использовать оксид меди (II) при нагревании.
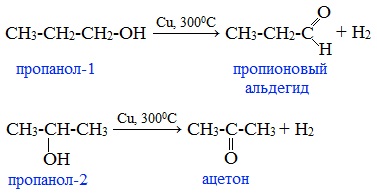
При окислении первичных спиртов образуются альдегиды:
Видеоопыт «Окисление этилового спирта оксидом меди (II)»
Первичные спирты при окислении образуют альдегиды, которые затем легко окисляются до карбоновых кислот:
Чтобы предотвратить превращение альдегида в кислоту, его отгоняют в ходе реакции (tкип альдегида, не образующего межмолекулярные водородные связи, ниже tкип спирта и кислоты).
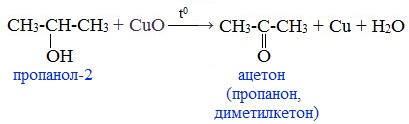
При окислении вторичных спиртов образуются кетоны:
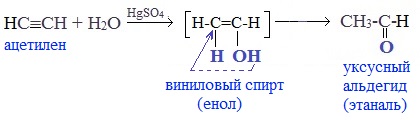
Присоединение воды к ацетилену происходит в присутствии катализатора соли ртути (II) и идет через образование неустойчивого непредельного спирта (енола), который изомеризуется в уксусный альдегид (в случае ацетилена):
Кетоны получают при гидратации других гомологов ряда алкинов:
Раньше это был промышленный способ получения карбонильных соединений. В настоящее время этот способ находит ограниченное применение из-за загрязнения получаемых продуктов токсичными солями ртути и относительной дороговизны.
3. Каталитическое окисление алкенов кислородом воздуха
Этим способом в промышленности получают уксусный альдегид — окислением этилена кислородом воздуха (Вакер-процесс).
Эта реакция протекает в присутствии катализатора – смеси PdCl2 и CuCl2 и температуре 100 0 С:
Этим экономичным способом получают низшие альдегиды и кетоны.
Этот промышленный способ более перспективен, чем гидратация алкинов, при которой используются токсичные ртутные катализаторы.
4. Каталитическое дегидрирование спиртов
В промышленности альдегиды и кетоны получают дегидрированием спиртов, пропуская пары спирта над нагретым катализатором (Cu, соединения Ag, Cr или Zn).
Первичные спирты окисляются до альдегидов, а вторичные – до кетонов.
Этот способ получения объясняет суть названия «альдегид» (от лат. alconol dehydrogenatum – спирт, от которого «отняли» водород).
Этот способ позволяет получать карбонильные соединения, в особенности альдегиды, без побочных продуктов окисления.
В 1835 г. немецкий химик Ю. Либих выделил индивидуальное вещество, молекула которого содержала на два атома водорода меньше, чем этанол. Ученый установил состав этого соединения – С2Н4О и назвал его альдегидом (от лат. al conol dehyd rogenatum — т.е. дегидрированный спирт, «спирт, лишенный водорода»).
В 1867 г. немецкий химик-органик А. Гофман, пропуская пары метилового спирта над раскаленной платиновой спиралью, получил газообразное вещество состава СН2О, молекула которого отличается от открытого Либихом альдегида на группу -СН2— . Именно это соединение (муравьиный альдегид) открывает гомологический ряд альдегидов.
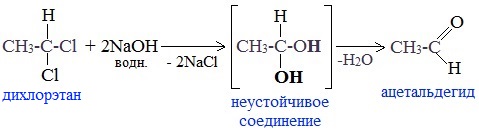
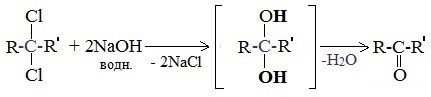
5. Щелочной гидролиз дигалогеналканов
Реакция протекает при действии водных растворов щелочей на дигалогензамещенные углеводороды, содержащие два атома галогена у одного и того же атома углерода.
При щелочном гидролизе дигалогеналканов образуются двухатомные спирты, в которых две группы ОН соединены с одним атомом углерода. Эти вещества неустойчивы и при отщеплении воды, превращаются в карбонильные соединения.
Если два атома галогена связаны с первичным атомом углерода, то образуются альдегиды:
При гидролизе дигалогеналканов, содержащих атомы галогена у вторичного атома углерода, образуются кетоны:
Это лабораторный способ получения карбонильных соединений.
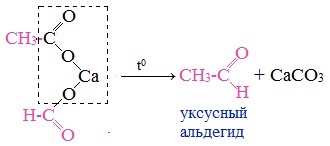
6. Пиролиз солей карбоновых кислот
При пиролизе (термическое разложение) кальциевых, бариевых солей карбоновых кислот образуются соответствующие карбонильные соединения. Из смешанной соли муравьиной и другой карбоновой кислоты получают альдегиды, а в остальных случаях образуются кетоны.
Это лабораторный способ получения карбонильных соединений.
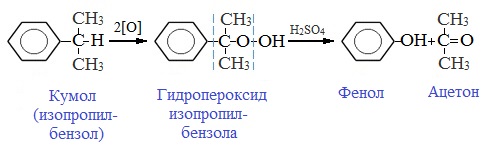
7. Кумольный способ получения ацетона (наряду с фенолом)
Простейший кетон – ацетон – получают кумольным методом вместе с фенолом:
Это промышленный способ получения ацетона.
Преимущества метода: безотходная технология (выход полезных продуктов > 99%) и экономичность. В настоящее время кумольный способ используется как основной в мировом производстве фенола.
Получение формальдегида
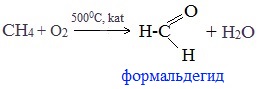
1. Окисление метана
Формальдегид в промышленности можно получить окислением метана кислородом воздуха при высоких температурах с использованием катализатора:
2. Окисление метанола
Основной промышленный способ получения формальдегида – окисление метанола с использованием серебряного катализатора при температуре 650 0 С и атмосферном давлении:
Реакция происходит на раскаленной серебряной сетке, через которую проходят пары ментола, смешанные с воздухом. Реакция настолько экзотермична, что выделяющейся в ходе ее теплоты достаточно для того, чтобы поддерживать сетку в раскаленном состоянии.
В настоящее время разработан перспективный способ высокотемпературного окисления метанола с использованием железомолибденовых катализаторов:
Видео:Реакции окисления этанола. Опыт 4Скачать

Лабораторный опыт 6. Окисление спирта в альдегид. ГДЗ Химия 10-11 класс Цветков.
Какие тут подсказки?
1. На конце медной проволоки сделайте 5-6 витков спирали.
2. Налейте в пробирку не более 1 мл этилового спирта, накалите медную спираль в пламени горелки, чтобы медь покрылась черным налетом оксида, и быстро опустите спираль в пробирку со спиртом. Повторите эту операцию несколько раз. Обратите внимание на запах образующегося альдегида и на изменения, происходящие со спиралью.
3. Составьте уравнения реакций окисления меди при накаливании и окисления спирта в альдегид оксидом меди (II).
Видео:Опыты по химии. Окисление спирта в альдегидСкачать

Окисление этанола в альдегид уравнение
Чтобы предотвратить превращение альдегида в кислоту, его отгоняют в ходе реакции (т. кипения альдегида, не образующего межмолекулярные водородные связи, ниже т.кип. спирта и кислоты)
При окислении вторичных спиртов образуются кетоны
2 . В промышленности альдегиды и кетоны получают дегидрированием спиртов, пропуская пары спирта над нагретым катализатором (Cu, соединения Ag, Cr или Zn).
Этот способ позволяет получать карбонильные соединения, в особенности альдегиды, без побочных продуктов окисления.
3. Гидротация алкинов (реакция Кучерова)
присоединения воды к ацетилену в присутствии солей ртути приводит к образованию ацетальдегида:
Кетоны получают при гидротации других гомологов ряда алкинов:
К альдегидам относятся важнейшие моно- и олигосахариды — глюкоза, лактоза и др. Содержатся А. в эфирных маслах, напр. цитраль — в лемонграссовом (до 80%) и кориандровом маслах, цитронеллаль — в цитронелловом (
30%) и эвкалиптовом, бензальдегид — в масле горького миндаля; плоды ванили содержат 1,5-3% ванилина.
Ацетальдегид производят гл. обр. окислением этилена, а также каталитической гидратацией ацетилена (р-ция Кучерова), акролеин — окислением пропилена, пропионовый и масляный альдегиды — гидроформилированием соотв. этилена и пропилена. А. синтезируют в пром-сти также каталитич. восстановлением карбоновых к-т (гл. обр. высших) муравьиной к-той, гидролизом дигалогенозамещенных углеводородов.
Методы получения альдегидов:
методы окисления или дегидрирования:
дегидрирование спиртов над катализаторами (Ag, Cu) — используется в основном в промышленности;
окисление спиртов хроматами, комплексами триоксида хрома (VI), диметилсульфоксидом, церийаммонийнитратом, иодозобензолом;
восстановление хлорангидридов кислот через соединения Рейсерта;
введение карбонильной группы (формилирование):
гидролиз и расщепление:
присоединение и конденсации:
💡 Видео
Окисление этанола оксидом меди (II). Опыт 3Скачать

Окисление этилового спирта оксидом меди(II)Скачать

Окисление этанола оксидом меди(II). | Лабораторный опыт № 2.Скачать

Окисление этанола раствором перманганата калияСкачать

Окисление этанола (тест на алкоголь)Скачать
Окисление этанола (тест на алкоголь)Скачать

Видеоопыты. Органика 37. Каталитическое окисление этанолаСкачать

Реакции окисления, нуклеофильного присоединения альдегидов и кетонов. 11 класс.Скачать

Качественная реакция на альдегиды с гидроксидом медиСкачать

Видеоопыты. Органика 58. Окисление этанола раствором перманганата калияСкачать

окисление этанола марганцевым ангидридомСкачать

Качественная реакция на этанолСкачать

Окисление Этанола Перманганатом Калия В Сернокислой Среде.Скачать

Химия Органика 035 Окисление этанола тест на алкогольСкачать

10.3. Альдегиды и кетоны: Химические свойства. ЕГЭ по химииСкачать

7.4. Спирты: Химические свойства. ЕГЭ по химииСкачать

Реакции окисления, нуклеофильного присоединения альдегидов и кетонов. Практическая часть. 11 класс.Скачать
Алкотест, качественная реакция на этанолСкачать