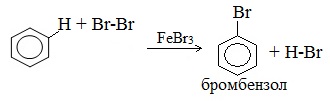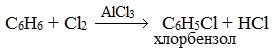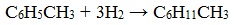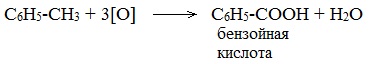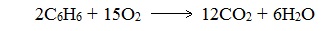Арены (ароматические углеводороды) – это непредельные (ненасыщенные) циклические углеводороды, молекулы которых содержат устойчивые циклические группы атомов (бензольные ядра) с замкнутой системой сопряженных связей.
Общая формула: CnH2n–6 при n ≥ 6.
- Химические свойства аренов
- 1. Реакции присоединения
- 1.1. Гидрирование
- 1.2. Хлорирование аренов
- 2. Реакции замещения
- 2.1. Галогенирование
- 2.2. Нитрование
- 2.3. Алкилирование ароматических углеводородов
- 2.4. Сульфирование ароматических углеводородов
- 3. Окисление аренов
- 3.1. Полное окисление – горение
- 3.2. О кисление гомологов бензола
- 4. Ориентирующее действие заместителей в бензольном кольце
- 5. Особенности свойств стирола
- Окисление бензола перманганатом калия и бромной водой уравнение реакции
- Реакции замещения в бензольном кольце
- Реакции присоединения
- Замещение в боковой цепи
- Замещение в алкилбензолах
- Реакции окисления
- Бензол и его гомологи
- 📽️ Видео
Видео:Отношения бензола к бромной воде и раствору перманганата калияСкачать

Химические свойства аренов
Арены – непредельные углеводороды, молекулы которых содержат три двойных связи и цикл. Но из-за эффекта сопряжения свойства аренов отличаются от свойств других непредельных углеводородов.
Для ароматических углеводородов характерны реакции:
- присоединения,
- замещения,
- окисления (для гомологов бензола).
| Из-за наличия сопряженной π-электронной системы молекулы ароматических углеводородов вступают в реакции присоединения очень тяжело, только в жестких условиях — на свету или при сильном нагревании, как правило, по радикальному механизму |
| Бензольное кольцо представляет из себя скопление π-электронов, которое притягивает электрофилы. Поэтому для ароматических углеводородов характерны реакции электрофильного замещения атома водорода у бензольного кольца. |
Ароматическая система бензола устойчива к действию окислителей. Однако гомологи бензола окисляются под действием перманганата калия и других окислителей.
Видео:6.3. Ароматические углеводороды (бензол и его гомологи): Химические свойства. ЕГЭ по химииСкачать

1. Реакции присоединения
Бензол присоединяет хлор на свету и водород при нагревании в присутствии катализатора.
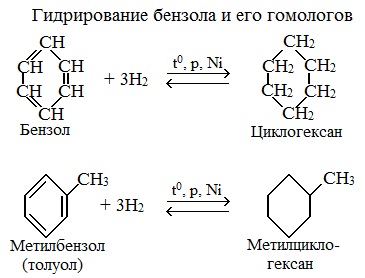
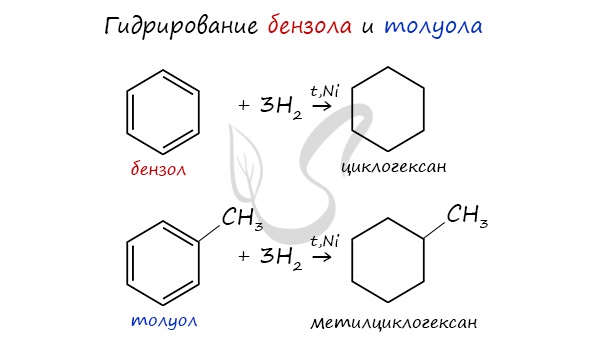
1.1. Гидрирование
Бензол присоединяет водород при нагревании и под давлением в присутствии металлических катализаторов (Ni, Pt и др.).
При гидрировании бензола образуется циклогексан:
При гидрировании гомологов образуются производные циклоалканы. При нагревании толуола с водородом под давлением и в присутствии катализатора образуется метилциклогексан:
1.2. Хлорирование аренов
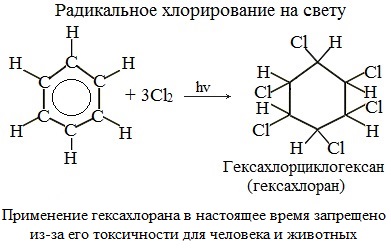
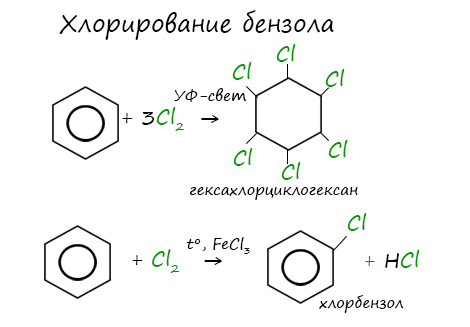
Присоединение хлора к бензолу протекает по радикальному механизму при высокой температуре, под действием ультрафиолетового излучения.
При хлорировании бензола на свету образуется 1,2,3,4,5,6-гексахлорциклогексан (гексахлоран).
Гексахлоран – пестицид, использовался для борьбы с вредными насекомыми. В настоящее время использование гексахлорана запрещено.
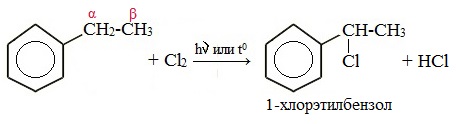
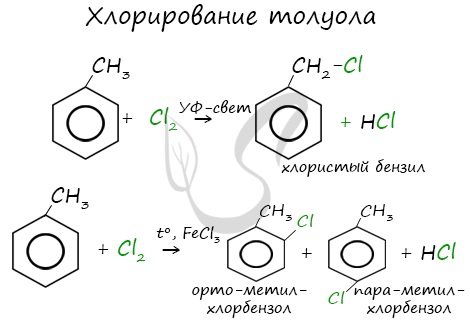
Гомологи бензола не присоединяют хлор. Если гомолог бензола реагирует с хлором или бромом на свету или при высокой температуре (300°C), то происходит замещение атомов водорода в боковом алкильном заместителе, а не в ароматическом кольце.
| Например, при хлорировании толуола на свету образуется бензилхлорид |
| Если у гомолога бензола боковая цепь содержит несколько атомов углерода – замещение происходит у атома, ближайшему к бензольному кольцу («альфа-положение»). |
| Например, этилбензол реагирует с хлором на свету |
Видео:Окисление органических соединений перманганатом калияСкачать

2. Реакции замещения
| Реакции замещения у ароматических углеводородов протекают по ионному механизму (электрофильное замещение). При этом атом водорода замещается на другую группу (галоген, нитро, алкил и др.). |
2.1. Галогенирование
Бензол и его гомологи вступают в реакции замещения с галогенами (хлор, бром) в присутствии катализаторов (AlCl3, FeBr3).
При взаимодействии с хлором на катализаторе AlCl3 образуется хлорбензол:
Ароматические углеводороды взаимодействуют с бромом при нагревании и в присутствии катализатора – FeBr3 . Также в качестве катализатора можно использовать металлическое железо.
Бром реагирует с железом с образованием бромида железа (III), который катализирует процесс бромирования бензола:
| Гомологи бензола содержат алкильные заместители, которые обладают электронодонорным эффектом: из-за того, что электроотрицательность водорода меньше, чем углерода, электронная плотность связи С-Н смещена к углероду. На нём возникает избыток электронной плотности, который далее передается на бензольное кольцо. |
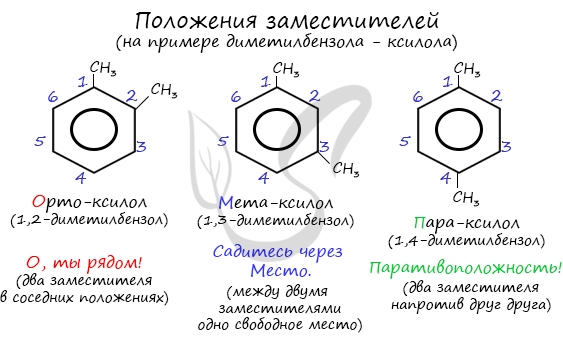
| Поэтому гомологи бензола легче вступают в реакции замещения в бензольном кольце. При этом гомологи бензола вступают в реакции замещения преимущественно в орто— и пара-положения |
| Например, при взаимодействии толуола с хлором образуется смесь продуктов, которая преимущественно состоит из орто-хлортолуола и пара-хлортолуола |
Мета-хлортолуол образуется в незначительном количестве.
При взаимодействии гомологов бензола с галогенами на свету или при высокой температуре (300 о С) происходит замещение водорода не в бензольном кольце, а в боковом углеводородном радикале.
| Если у гомолога бензола боковая цепь содержит несколько атомов углерода – замещение происходит у атома, ближайшему к бензольному кольцу («альфа-положение»). |
Например, при хлорировании этилбензола:
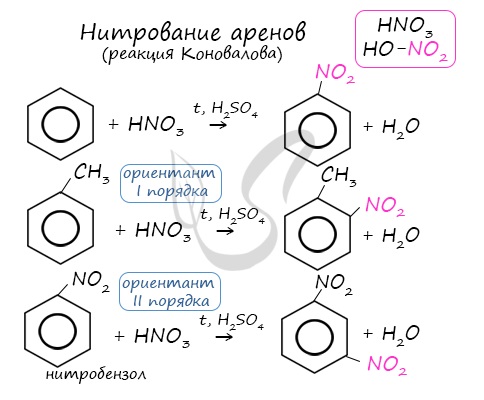
2.2. Нитрование
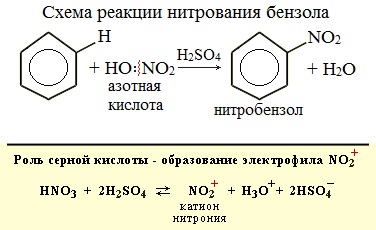
Бензол реагирует с концентрированной азотной кислотой в присутствии концентрированной серной кислоты (нитрующая смесь).
При этом образуется нитробензол:
| Серная кислота способствует образованию электрофила NO2 + : |
Толуол реагирует с концентрированной азотной кислотой в присутствии концентрированной серной кислоты.
В продуктах реакции мы указываем либо о-нитротолуол:
Нитрование толуола может протекать и с замещением трех атомов водорода. При этом образуется 2,4,6-тринитротолуол (тротил, тол):
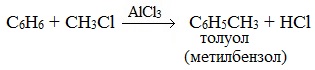
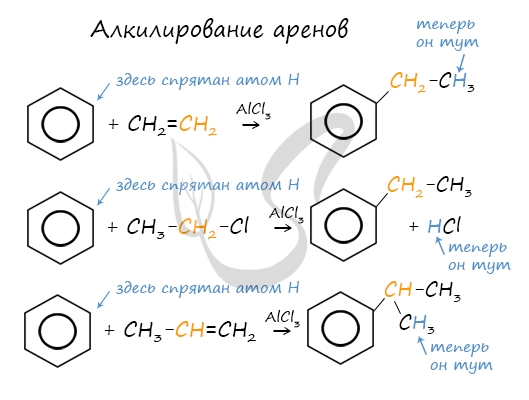
2.3. Алкилирование ароматических углеводородов
- Арены взаимодействуют с галогеналканами в присутствии катализаторов (AlCl3, FeBr3 и др.) с образованием гомологов бензола.
| Например, бензол реагирует с хлорэтаном с образованием этилбензола |
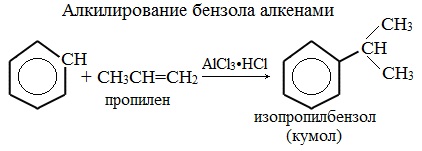
- Ароматические углеводороды взаимодействуют с алкенами в присутствии хлорида алюминия, бромида железа (III), фосфорной кислоты и др.
| Например, бензол реагирует с этиленом с образованием этилбензола |
| Например, бензол реагирует с пропиленом с образованием изопропилбензола (кумола) |
- Алкилирование спиртами протекает в присутствии концентрированной серной кислоты.
| Например, бензол реагирует с этанолом с образованием этилбензола и воды |
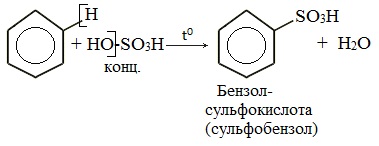
2.4. Сульфирование ароматических углеводородов
Бензол реагирует при нагревании с концентрированной серной кислотой или раствором SO3 в серной кислоте (олеум) с образованием бензолсульфокислоты:
Видео:ЭТО ПОМОЖЕТ разобраться в Органической Химии — Алкены, Урок ХимииСкачать

3. Окисление аренов
Бензол устойчив к действию даже сильных окислителей. Но гомологи бензола окисляются под действием сильных окислителей. Бензол и его гомологи горят.
3.1. Полное окисление – горение
При горении бензола и его гомологов образуются углекислый газ и вода. Реакция горения аренов сопровождается выделением большого количества теплоты.
Уравнение сгорания аренов в общем виде:
При горении ароматических углеводородов в недостатке кислорода может образоваться угарный газ СО или сажа С.
Бензол и его гомологи горят на воздухе коптящим пламенем. Бензол и его гомологи образуют с воздухом и кислородом взрывоопасные смеси.
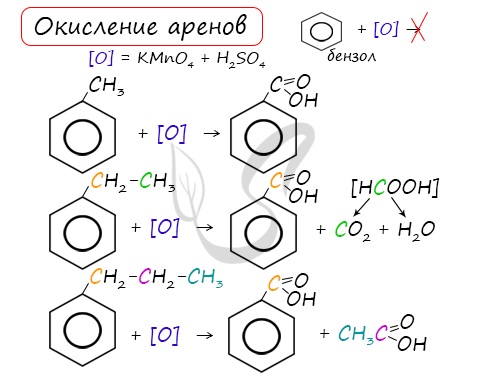
3.2. О кисление гомологов бензола
Гомологи бензола легко окисляются перманганатом и дихроматом калия в кислой или нейтральной среде при нагревании.
При этом происходит окисление всех связей у атома углерода, соседнего с бензольным кольцом, кроме связи этого атома углерода с бензольным кольцом.
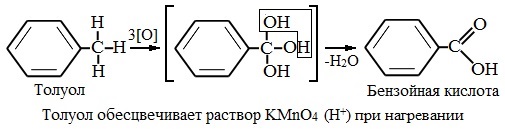
Толуол окисляется перманганатом калия в серной кислоте с образованием бензойной кислоты:
Если окисление толуола идёт в нейтральном растворе при нагревании, то образуется соль бензойной кислоты – бензоат калия:
Таким образом, толуол обесцвечивает подкисленный раствор перманганата калия при нагревании.
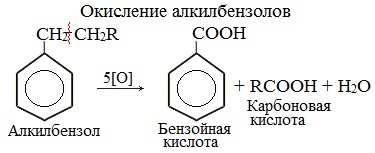
| При окислении других гомологов бензола всегда остаётся только один атом С в виде карбоксильной группы (одной или нескольких, если заместителей несколько), а все остальные атомы углерода радикала окисляются до углекислого газа или карбоновой кислоты. |
| Например, при окислении этилбензола перманганатом калия в серной кислоте образуются бензойная кислота и углекислый газ |
| Например, при окислении этилбензола перманганатом калия в нейтральной кислоте образуются соль бензойной кислоты и карбонат |
Более длинные радикалы окисляются до бензойной кислоты и карбоновой кислоты:
При окислении пропилбензола образуются бензойная и уксусная кислоты:
Изопропилбензол окисляется перманганатом калия в кислой среде до бензойной кислоты и углекислого газа:
Видео:Окисление ВСЕХ органических веществ за 4 часа | Химия ЕГЭ 2023 | УмскулСкачать

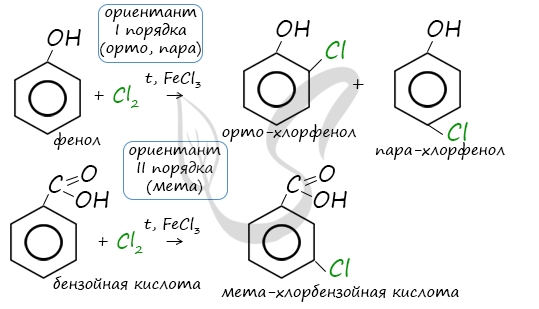
4. Ориентирующее действие заместителей в бензольном кольце
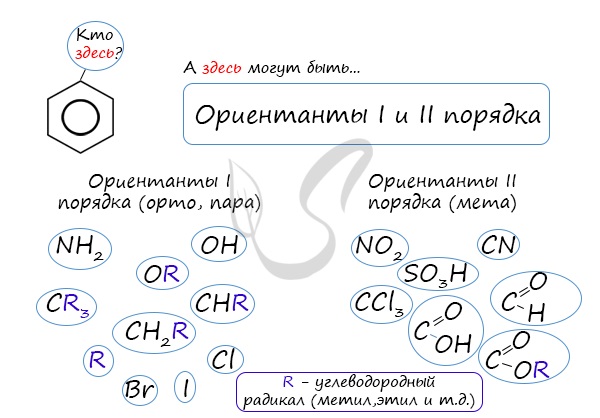
Если в бензольном кольце имеются заместители, не только алкильные, но и содержащие другие атомы (гидроксил, аминогруппа, нитрогруппа и т.п.), то реакции замещения атомов водорода в ароматической системе протекают строго определенным образом, в соответствии с характером влияния заместителя на ароматическую π-систему.
| Заместители подразделяют на две группы в зависимости от их влияния на электронную плотность ароматической системы: электронодонорные (первого рода) и электроноакцепторные (второго рода). |
Типы заместителей в бензольном кольце
| Заместители первого рода | Заместители второго рода |
| Дальнейшее замещение происходит преимущественно в орто— и пара-положение | Дальнейшее замещение происходит преимущественно в мета-положение |
| Электронодонорные, повышают электронную плотность в бензольном кольце | Электроноакцепторные, снижают электронную плотность в сопряженной системе. |
|
|
| Например, толуол реагирует с хлором в присутствии катализатора с образованием смеси продуктов, в которой преимущественно содержатся орто-хлортолуол и пара-хлортолуол. Метильный радикал — заместитель первого рода. |
В уравнении реакции в качестве продукта записывается либо орто-толуол, либо пара-толуол.
| Например, при бромировании нитробензола в присутствии катализатора преимущественно образуется мета-хлортолуол. Нитро-группа — заместитель второго рода |

Видео:3.3. Алкины: Химические свойстваСкачать

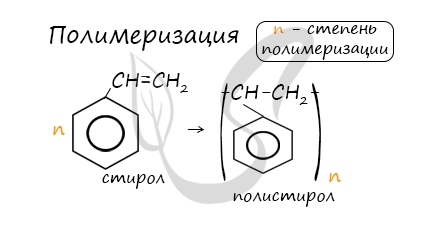
5. Особенности свойств стирола
Стирол (винилбензол, фенилэтилен) – это производное бензола, которое имеет в своем составе двойную связь в боковом заместителе.
Общая формула гомологического ряда стирола: CnH2n-8.
| Молекула стирола содержит заместитель с кратной связью у бензольного кольца, поэтому стирол проявляет все свойства, характерные для алкенов – вступает в реакции присоединения, окисления, полимеризации. |
Стирол присоединяет водород, кислород, галогены, галогеноводороды и воду в соответствии с правилом Марковникова.
| Например, при гидратации стирола образуется спирт: |
| Стирол присоединяет бром при обычных условиях, то есть обесцвечивает бромную воду |
При полимеризации стирола образуется полистирол:
Как и алкены, стирол окисляется водным раствором перманганата калия при обычных условиях. Обесцвечивание водного раствора перманганата калия — качественная реакция на стирол:
При жестком окислении стирола перманганатом калия в кислой среде (серная кислота) разрывается двойная связь и образуется бензойная кислота и углекислый газ:
При окислении стирола перманганатом калия в нейтральной среде при нагревании также разрывается двойная связь и образуется соль бензойной кислоты и карбонат:
Видео:Опыты по химии. Отношение бензола к йодной и бромной водеСкачать

Окисление бензола перманганатом калия и бромной водой уравнение реакции
По химическим свойствам арены отличаются от предельных и непредельных углеводородов. Это объясняется особенностями строения бензольного кольца. Шестиэлектронная π-система является более устойчивой, чем обычные двухэлектронные π-связи. Делокализация шести π-электронов в циклической системе понижает энергию молекулы, что обусловливает повышенную устойчивость (ароматичность) бензола и его гомологов.
Поэтому арены не склонны вступать в реакции присоединения или окисления, которые ведут к нарушению ароматичности.
Видеоопыт «Изучение отношения бензола к бромной воде и раствору перманганата калия»
Для аренов наиболее характерны реакции, идущие с сохранением ароматической системы- реакции замещения атомов водорода, связанных с циклом.
Ароматическое ядро, обладающее подвижной системой π-электронов, является удобным объектом для атаки электрофильными реагентами. Этому способствует также пространственное расположение π-электронного облака с двух сторон плоского σ-скелета молекулы.
Для аренов наиболее характерны реакции, протекающие по механизму электрофильного замещения, обозначаемого символом SЕ (анг. substitution electrophilic). В них участвует как само бензольное ядро, так и связанная с ним боковая цепь. Реакции замещения у аренов протекают легче, чем у предельных углеводородов.
Другие реакции (присоединение, окисление), в которых участвуют делокализованные углерод-углеродные связи бензольного кольца и нарушается его ароматичность идут с трудом.
Реакции замещения в бензольном кольце
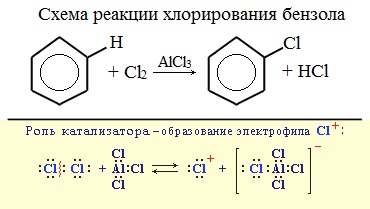
1. Галогенирование
Замещение атома водорода в бензольном кольце на галоген происходит в присутствии катализаторов AlCl3, FeCl3 (с хлором), AlBr3, Fe Br3 (с бромом) при нагревании. Так, при взаимодействии бензола с бромом атом водорода замещается атомом брома.
Важно! Реакция происходит с молекулярным бромом, а не с бромной водой. С бромной водой бензол не реагирует. Бензол не обесцвечивает бромную воду!
Катализатор поляризует молекулу галогена, в результате чего происходит гетеролитический разрыв связи и получаются ионы. Положительно заряженный ион хлора вступает в реакцию с бензолом.
2. Нитрование
Если на бензол действовать смесью концентрированных азотной и серной кислот (нитрующей смесью), то атом водорода замещается на нитрогруппу. Реакция проводится при нагревании.
Образуется тяжелая желтоватая жидкость с запахом горького миндаля — нитробензол, поэтому данная реакция может быть качественной на бензол.
3. Алкилирование галогеналканами
Замещение атома водорода в бензольном кольце на алкильную группу (алкилирование) происходит под действием алкилгалогенидов (реакция Фриделя-Крафтса) или алкенов в присутствии катализаторов AlBr3, FeBr3, AlCl3, FeCl3 (кислот Льюиса) при нагревании.
Эта реакция позволяет ввести углеводородный радикал в бензольное кольцо и может считаться способом получения гомологов бензола.
Алкилирование бензола алкенами
4. Сульфирование
Реакция легко проходит под действием «дымящей» серной кислоты (олеума).
Реакции присоединения
Эти реакции характеризуют арены как непредельные соединения. В реакции присоединения, приводящие к разрушению ароматической структуры бензольного кольца, они вступают с большим трудом. Для их протекания необходимы жесткие условия: высокая температура, наличие катализатора, световое облучение и др.
1.Гидрирование
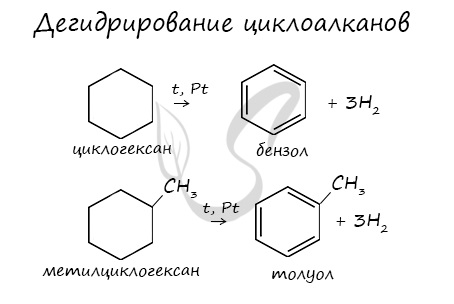
Присоединение водорода к бензолу идет при нагревании и высоком давлении в присутствии металлических катализаторов (Ni, Pt, Pd). Бензол превращается в циклогексан.
Эта реакция является обратной образованию бензола при дегидрировании циклогексана.
Гомологи бензола при гидрировании дают производные циклогексана.
2.Радикальное хлорирование
Галогенирование бензола происходит при взаимодействии его паров с хлором под воздействием ультрафиолетового излучения. При этом бензол присоединяет три молекулы хлора и образует твердый продукт – гексахлорциклогексан или гексахлоран (сильное средство для уничтожения насекомых).
Видеоопыт «Хлорирование бензола (получение гексахлорана)»
Бензол не присоединяет галогеноводороды и воду.
Замещение в боковой цепи
Галогенирование по α-атому углерода в боковой цепи
Реакция идет при нагревании или облучении и всегда по α-углероду. При продолжении галогенирования второй атом галогена снова встанет в α-положение.
Замещение в алкилбензолах
Гомологи бензола (алкилбензолы) С6Н5–R более активно вступают в реакции замещения по сравнению с бензолом.
Реакции окисления
Бензол очень устойчив к окислителям. Он не окисляется даже под действием сильных окислителей (KMnO4, K2Cr2O7 и т.п.). Поэтому он часто используется как инертный растворитель при проведении реакций окисления других органических соединений.
Однако алкильные группы в алкилбензолах окисляются легче предельных углеводородов. Это объясняется влиянием бензольного кольца на атомы в боковой цепи.
1. При действии раствора KMnO4 и нагревании в гомологах бензола окислению подвергаются только боковые цепи.
Окисление других гомологов (этилбензол, пропилбензол и т.д.) также приводит к образованию бензойной кислоты. Разрыв связи при этом происходит между двумя ближайшими к кольцу атомами углерода в боковой цепи.
Видеоопыт «Окисление бензола и толуола»
2. Бензол и его гомологи на воздухе горят коптящим пламенем, что обусловлено высоким содержанием углерода в их молекулах.
Бензол и его летучие гомологи образуют с воздухом и кислородом взрывоопасные смеси.
Видео:Арены: реакции окисления | Химия 10 класс | УмскулСкачать

Бензол и его гомологи
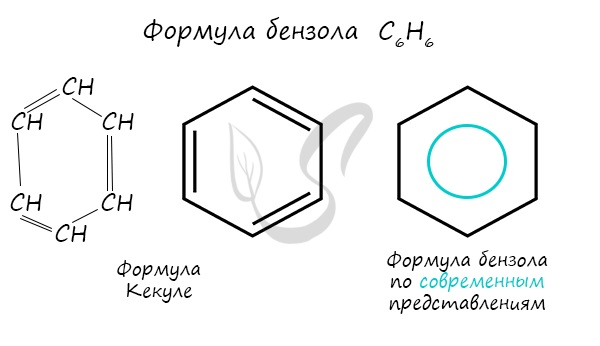
Арены — ароматические углеводороды, содержащие одно или несколько бензольных колец. Бензольное кольцо составляют 6 атомов углерода, между которыми чередуются двойные и одинарные связи.
Важно заметить, что двойные связи в молекуле бензола не фиксированы, а постоянно перемещаются по кругу.
Арены также называют ароматическими углеводородами. Первый член гомологического ряда — бензол — C6H6. Общая формула их гомологического ряда — CnH2n-6.
Долгое время структурная формула бензола оставалась тайной. Предложенная Кекуле формула с тремя двойными связями не могла объяснить то, что бензол не вступает в реакции присоединения. Как уже было сказано выше, по современным представлениям двойные связи в молекуле бензола постоянно перемещаются, поэтому более верно рисовать их в виде кольца.
За счет чередования двойных связей в молекуле бензола формируется сопряжение. Все атомы углерода находятся в состоянии sp 2 гибридизации. Валентный угол — 120°.
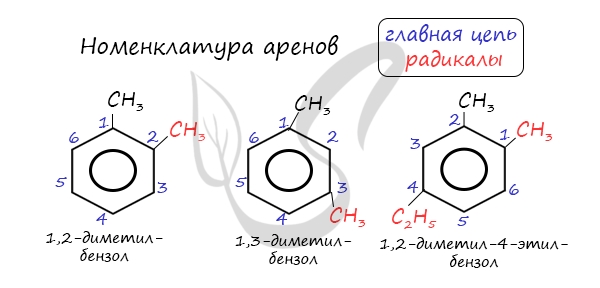
Номенклатура и изомерия аренов
Названия аренов формируются путем добавления названий заместителей к главной цепи — бензольному кольцу: бензол, метилбензол (толуол), этилбензол, пропилбензол и т.д. Заместители, как обычно, перечисляются в алфавитном порядке. Если в бензольном кольце несколько заместителей, то выбирают кратчайший путь между ними.
Для аренов характерна структурная изомерия, связанная с положением заместителей. Например, два заместителя в бензольном кольце могут располагаться в разных положениях.
Название положения заместителей в бензольном кольце формируется на основе их расположения относительно друг друга. Оно обозначается приставками орто-, мета- и пара. Ниже вы найдете мнемонические подсказки для их успешного запоминания 😉
Получение аренов
Арены получают несколькими способами:
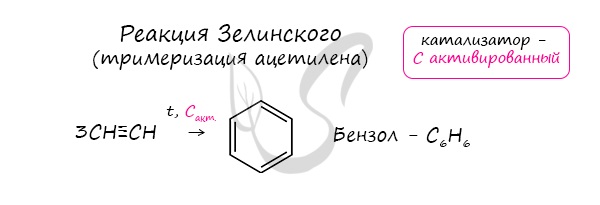
- Реакция Зелинского (тримеризация ацетилена)
Данная реакция протекает при пропускании ацетилена над активированным углем при t = 400°C. В результате образуется ароматический углеводород — бензол.
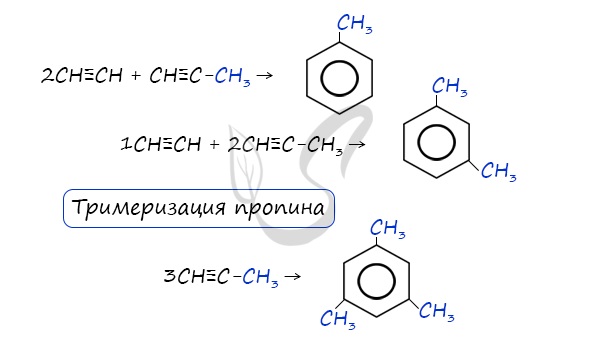
В случае, если к ацетилену добавить пропин, то становится возможным получение толуола. Увеличивая долю пропина, в конечном итоге можно добиться образования 1,3,5-триметилбензола.
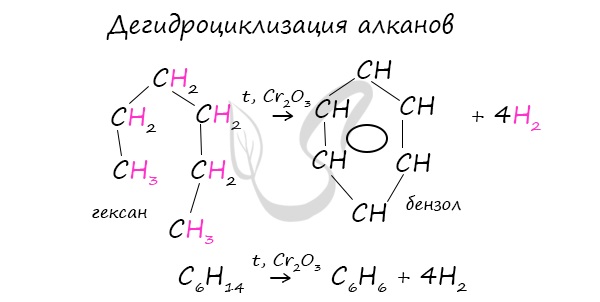
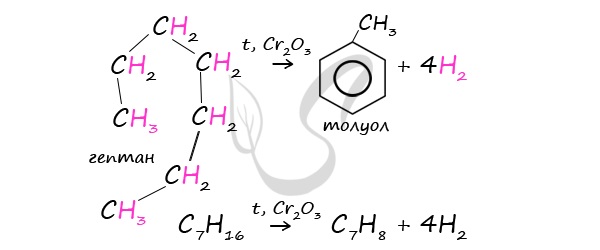
В ходе таких реакций, протекающих при повышенной температуре и в присутствии катализатора — Cr2O3, линейная структура алкана замыкается в цикл, отщепляется водород.
При дегидроциклизации гептана получается толуол.
В результате дегидрирования уже «готовых» циклов — циклоалканов, отщепляются 3 моль водорода, и образуется соответствующий арен, с теми же заместителями, которые были у циклоалкана.
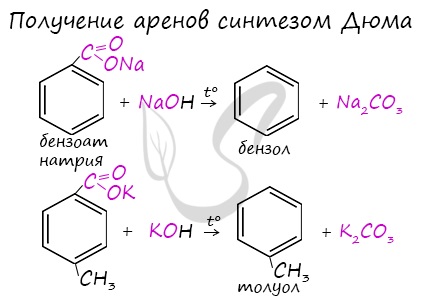
Синтез Дюма заключается в сплавлении солей карбоновых кислот с щелочами. В результате такой реакции возможно образование различных органических веществ, в том числе аренов.
Химические свойства аренов
Арены — ароматические углеводороды, которые содержат бензольное кольцо с сопряженными двойными связями. Эта особенность делает реакции присоединения тяжело протекающими (и тем не менее возможными!)
Запомните, что, в отличие от других непредельных соединений, бензол и его гомологи не обесцвечивают бромную воду и раствор перманганата калия.
При повышенной температуре и наличии катализатора, водород способен разорвать двойные связи в бензольном кольце и превратить арен в циклоалкан.
Реакция бензола с хлором на свету приводит к образованию гексахлорциклогексана, если же использовать только катализатор, то образуется хлорбензол.
Реакции с толуолом протекают иначе: при УФ-свете хлор направляется в радикал метил и замещает атом водорода в нем, при действии катализатора хлор замещает один атом водорода в бензольном кольце (в орто- или пара-положении).
Почему хлор направляется именно в орто- и пара-положения относительно метильной группы? Здесь самое время коснуться темы ориентантов I (орто-, пара-ориентантов) и II порядков (мета-ориентанты).
К ориентантам первого порядка относятся группы: NH2, OH, OR, CR3, CHR2, CH2R, галогены. К ориентантам второго: NO2, CN, SO3H, CCl3, CHO, COOH, COOR.
Например, ориентант I порядка, гидроксогруппа OH, обеспечивает протекание хлорирования в орто- и пара-положениях. А карбоксильная группа COOH, ориентант II порядка, обуславливает хлорирование в мета-положениях.
Арены вступают в реакции нитрования, протекающие при повышенной температуре и в присутствии серной кислоты, обладающей водоотнимающими свойствами.
Алкилирование аренов осуществляется путем введения алкильного радикала в молекулу бензола. Алкильным радикалом чаще всего выступает алкен или галогеналкан. В подобных реакциях используют катализатор AlCl3.
В случае если для алкилирования используется алкен, то с молекулой бензола соединяется наименее гидрированный атом углерода алкена, прилежащий к двойной связи. Один атом водорода переходит из бензольного кольца к радикалу.
Арены, как и все органические вещества, сгорают с образованием углекислого газа и воды.
При неполном окислении гомологи бензола способны окисляться до бензойной кислоты (при подкислении раствора серной кислотой). Сам бензол не вступает в реакцию окисления с KMnO4, не обесцвечивает его раствор.
В реакцию полимеризации способен вступать стирол (винилбензол), в радикале которого содержится двойная связь.
© Беллевич Юрий Сергеевич 2018-2022
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
📽️ Видео
Химические свойства бензола и его гомологов. 2 часть. 11 класс.Скачать

Химические свойства бензола и его гомологов. 1 часть. 11 класс.Скачать

Взаимодействие этилена с бромной водойСкачать

Как решать ОРГАНИЧЕСКИЕ ЦЕПОЧКИ? Основные типы химических реакцийСкачать

ТИПОВЫЕ ЗАДАЧИ ПО ХИМИИ: Химическое Количество Вещества, Моль, Молярная Масса и Молярный ОбъемСкачать

6.1. Ароматические углеводороды (бензол и его гомологи): Строение, номенклатура, изомерияСкачать

Химические свойства бензола и его гомологов. 3 часть. 11 класс.Скачать

Самый легкий способ уравнять ОВР в органике!Скачать

Арены (бензол, толуол): цепочки. Часть 1/3. 10 класс и ЕГЭ по химииСкачать

Окисление гомологов бензола в кислой средеСкачать

ЕГЭ 2022 / Задание 12Скачать

Взаимодействие фенола с бромной водойСкачать