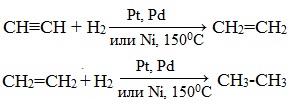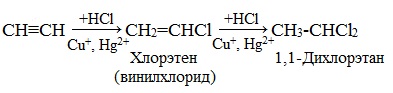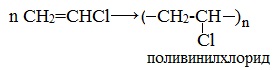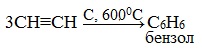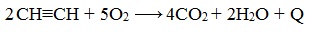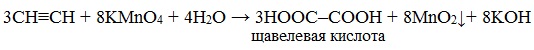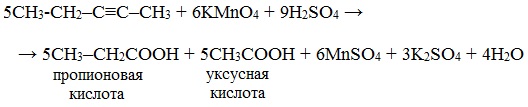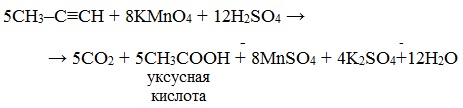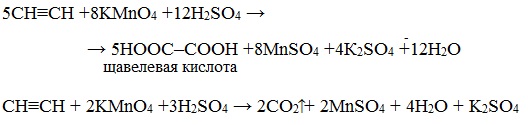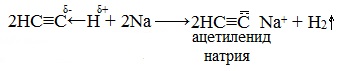Алкины во многих реакциях обладают большей реакционной способностью, чем алкены. Для алкинов, как и для алкенов, характерны реакции присоединения. Так как тройная связь содержит две π-связи, реакции присоединения к алкинам могут происходить в две стадии.
Вначале идет присоединение по месту двойной π-связи с образование производных олефинов, а затем по месту второй π-связи с образованием производных алканов.
Реакции присоединения для алкинов протекают медленнее, чем для алкенов. Это объясняется тем, что π-электронная плотность тройной связи расположена более компактно, чем в алкенах, и поэтому менее доступна для взаимодействия с различными реагентами.
- Реакции присоединения
- Образование солей
- Взаимодействие ацетилена с бромной водой
- Реакция ацетилена с раствором перманганата калия
- Реакция ацетилена с аммиачным раствором оксида серебра
- Химические свойства алкинов
- Химические свойства алкинов
- 1. Реакции присоединения
- 1.1. Гидрирование
- 1.2. Галогенирование алкинов
- 1.3. Гидрогалогенирование алкинов
- 1.4. Гидратация алкинов
- 1.5. Димеризация, тримеризация и полимеризация
- 2. Окисление алкинов
- 2.1. Горение алкинов
- 2.2. Окисление алкинов сильными окислителями
- 3. Кислотные свойства алкинов
- 🔥 Видео
Реакции присоединения
1. Гидрирование
Присоединение водорода происходит при нагревании в присутствии металлических катализаторов. Реакция протекает в две стадии: алкины присоединяют водород с образованием алкенов (разрывается первая π-связь), а затем образованием алканов (разрывается вторая π-связь):
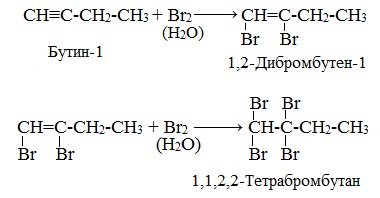
2. Галогенирование
Присоединение галогенов протекает также в две стадии. На первой стадии образуются дигалогеналкены, на второй – тетрагалогеналканы:
Реакция алкинов с бромной водой является качественной реакцией на алкины. Бромная вода обесцвечивается.
Видеоопыт «Взаимодействие ацетилена с бромной водой»
Видеоопыт «Взаимодействие ацетилена с хлором»
3. Гидрогалогенирование
Галогеноводороды присоединяются к алкинам в две стадии. Вторая стадия идет по правилу Марковникова. Присоединение НCl в отсутствии катализатора идет очень медленно. Катализатором этой реакции служат кислоты Льюиса – соли меди (I) и ртути (II):
Получаемый продукт – хлористый винил (винилхлорид) – подобно этилену легко полимеризуется, образуя полимер – поливинилхлорид, который широко применяется в производстве поливинилхлоридных смол:
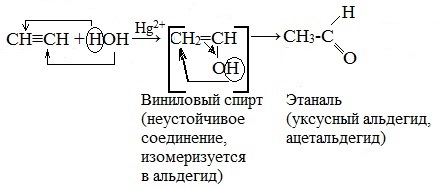
4. Гидратация (реакция Кучерова)
Присоединение воды протекает в присутствии солей ртути (II) при нагревании – HgSO4, Hg (NO3)2 – с образованием уксусного альдегида (при обычных условиях ацетилен с водой не взаимодействует):
На первой стадии реакции образуется непредельный спирт, в котором гидроксильная группа находится непосредственно у атома углерода при двойной связи. Такие спирты принято назвать виниловыми или енолами.
Отличительной чертой енолов является их неустойчивость. В момент образования они изомеризуются в более стабильные карбонильные соединения (альдегиды или кетоны) — водород гидроксильной группы переходит к соседнему атому углероду. При этом π-связь между атомами углерода разрывается и образуется π-связь между атомом углерода и атомом кислорода. Причиной изомеризации является большая прочность двойной связи С=О по сравнению с двойной связью С=С.
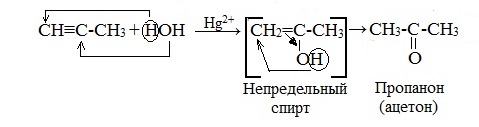
Гидратация гомологов ацетилена протекает по правилу Марковникова, и образующиеся енолы изомеризуются в кетоны:
5. Реакции полимеризации
В присутствии катализаторов алкины могут реагировать друг с другом, причем в зависимости от условий образуются различные продукты.
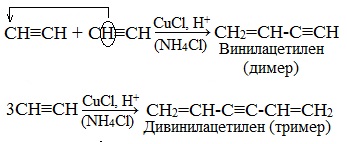
1.Димеризация под действием водно-аммиачного раствора CuCl:
Винилацетилен обладает большой реакционной способностью – присоединяя хлороводород, он образует хлоропрен (2-хлорбутадиен-1,3), используемый для получения искусственного хлорпренового каучука:
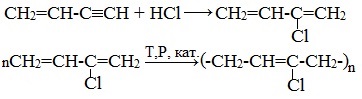
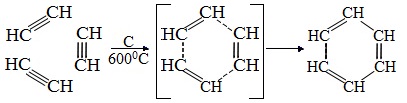
2.Тримеризация ацетилена над активированным углем приводит к образованию бензола (реакция Зелинского):
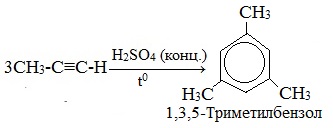
В аналогичные реакции тримеризации могут вступать также и ближайшие гомологи ацетилена, например пропин:
1. Горение
При сгорании алкинов происходит их полное окисление до СО2 и Н2О. Горение ацетилена сопровождается выделением большого количества тепла:
Температура ацетиленово-кислородного пламени достигает 2800- 3000°С. На этом основано применение ацетилена для сварки и резки металла. Ацетилен образует с воздухом и кислородом взрывоопасные смеси.
Видеоопыт «Взрыв смеси ацетилена с кислородом»
В сжатом, и особенно в сжиженном, состоянии он способен взрываться от удара. Поэтому ацетилен хранится в стальных баллонах в виде растворов в ацетоне, которым пропитывают асбест.
2. Неполное окисление
Ацетилен и его гомологи легко окисляются окислителями — КMnO4, K2Cr2O7. Алкины окисляются с разрывом молекулы по тройной связи. Строение продуктов окисления зависит от природы окислителя и условий проведения реакций.
Алкины обесцвечивают разбавленный раствор перманганата калия, что доказывает их ненасыщенность.
а) мягкое окисление
Мягкое окисление алкинов происходит без разрыва σ-связи С─С (разрушаются только π-связи).
Например, при взаимодействии ацетилена с разбавленным раствором КMnO4 при комнатной температуре образуется двухосновная щавелевая кислота:
В нейтральной и слабощелочной средах на холоде образуются соли карбоновых кислот. При взаимодействии ацетилена с водным раствором перманганата калия образуется соль щавелевой кислоты (оксалат калия):
б) Жесткое окисление
При жестком окислении (нагревание, концентрированные растворы, кислая среда) происходит расщепление углеродного скелета молекулы алкина по тройной связи и образуются карбоновые кислоты.
Окисление алкинов перманганатом калия в кислой среде при нагревании сопровождается разрывом углеродной цепи по месту тройной связи и приводит к образования карбоновых кислот:
Окисление алкинов, содержащих тройную связь у крайнего атома углерода, сопровождается в этих же условиях образованием карбоновой кислоты и выделением углекислого газа:
В кислой среде окисление ацетилена идет до щавелевой кислоты или углекислого газа:
Видеоопыт «Взаимодействие ацетилена с раствором перманганата калия»
Реакция КMnO4 является качественной реакцией на алкины. Раствор перманганата калия обесцвечивается.
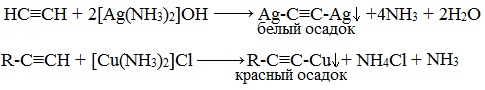
Образование солей
Особенностью алкинов, имеющих концевую тройную связь (алкины-1), является их способность проявлять слабые кислотные свойства.
Атомы водорода, связанные с sp-гибридизированными атомами углерода в молекулах алкинов, обладают значительной подвижностью, что объясняется поляризацией σ-связи ≡С─Н. В связи с этим атомы водорода могут замещаться атомами металлов, в результате чего образуются соли — ацетилениды.
Ацетилениды щелочных и щелочноземельных металлов используются для получения гомологов ацетилена.
Ацетилениды серебра и меди (I) легко образуются и выпадают в осадок при пропускании ацетилена через аммиачный раствор оксида серебра или хлорида меди (I).
Образование серовато- белого осадка ацетиленида серебра (или красно-коричневого – ацетиленида меди) служит качественной реакцией на концевую тройную связь.
Видеоопыт «Получение ацетиленида серебра»
Видеоопыт «Получение ацетиленида меди»
Ацетилениды серебра и меди как соли слабых очень кислот легко разлагаются при действии хлороводородной кислоты с выделением исходного алкина.
Ацетилиниды серебра и меди в сухом виде взрываются от удара. Однако карбид кальция, который также является ацетиленидом, очень устойчив к удару. Он широко используется для получения ацетилена.
Если тройная связь находится не на конце цепи, то кислотные свойства отсутствуют (нет подвижного атома водорода) и ацетилениды не образуются.
Видео:Окисление органических соединений перманганатом калияСкачать

Взаимодействие ацетилена с бромной водой
Молекула ацетилена содержит тройную связь, бром разрушает её и присоединяется к ацетилену. Образуется терабромэтан. Бром расходуется на образование тетрабромэтана. Бромная вода (жёлтая) — обесцвечивается.
Эта реакция протекает с меньшей скоростью, чем в ряду этиленовых углеводородов. Реакция также проходит ступенчато:
ацетилен → 1,2-дибромэтан → 1,1,2,2-тетрабромэтан
Обесцвечивание бромной воды доказывает непредельность ацетилена.
Видео:Окисление ВСЕХ органических веществ за 4 часа | Химия ЕГЭ 2023 | УмскулСкачать

Реакция ацетилена с раствором перманганата калия
В растворе перманганата калия происходит окисление ацетилена, при этом происходит разрыв молекулы по месту тройной связи, раствор быстро обесцвечивается.
Эта реакция является качественной реакцией на двойную и тройную связь.
Видео:Реакция этилена с раствором перманганата калияСкачать

Реакция ацетилена с аммиачным раствором оксида серебра
Если ацетилен пропустить через аммиачный раствор оксида серебра, атомы водорода в молекуле ацетилена легко заместятся металлами, так как обладают большой подвижностью. В данном опыте атомы водорода замещаются атомами серебра. Образуется ацетиленид серебра — осадок жёлтого цвета (взрывоопасен).
Эта реакция является качественной реакцией на тройную связь.
Видео:Алкины.Окисление алкинов с KMnO4 и K2Cr2O7. Все 9 реакций ЕГЭСкачать

Химические свойства алкинов
Алкины – это непредельные (ненасыщенные) нециклические углеводороды, в молекулах которых присутствует одна тройная связь между атомами углерода С≡С.
Остановимся на свойствах, способах получения и особенностях строения алкинов.
Видео:Окисление пропаналя перманганатом калия в щелочной среде ОВР ЕГЭ по химии 2024 10 класс РепетиторСкачать

Химические свойства алкинов
Алкины – непредельные углеводороды, в молекулах которых есть одна тройная связь. Строение и свойства тройной связи определяют характерные химические свойства алкинов. Химические свойства алкинов схожи с химическими свойствами алкенов из-за наличия кратной связи в молекуле.
Для алкинов характерны реакции окисления. Окисление алкенов протекает преимущественно по тройной связи, хотя возможно и жесткое окисление (горение).
Видео:3.3. Алкины: Химические свойстваСкачать

1. Реакции присоединения
Тройная связь состоит из σ-связи и двух π-связей. Сравним характеристики одинарной связи С–С, тройной связи С ≡ С и связи С–Н:
| Энергия связи, кДж/моль | Длина связи, нм | |
| С – С | 348 | 0,154 |
| С ≡ С | 814 | 0,120 |
| С – Н | 435 | 0,107 |
Таким образом, тройная связь С≡С короче, чем одинарная связь С–С , поэтому π-электроны тройной связи прочнее удерживаются ядрами атомов углерода и обладают меньшей поляризуемостью и подвижностью. Реакции присоединения по тройной связи к алкинам протекают сложнее, чем реакции присоединения по двойной связи к алкенам.
Для алкинов характерны реакции присоединения по тройной связи С ≡ С с разрывом π-связей.
1.1. Гидрирование
Гидрирование алкинов протекает в присутствии катализаторов (Ni, Pt) с образованием алкенов, а затем сразу алканов.
| Например, при гидрировании бутина-2 в присутствии никеля образуется сначала бутен-2, а затем бутан. |
При использовании менее активного катализатора (Pd, СaCO3, Pb(CH3COO)2) гидрирование останавливается на этапе образования алкенов.
| Например, при гидрировании бутина-1 в присутствии палладия преимущественно образуется бутен-1. |
1.2. Галогенирование алкинов
Присоединение галогенов к алкинам происходит даже при комнатной температуре в растворе (растворители — вода, CCl4).
| При взаимодействии с алкинами красно-бурый раствор брома в воде (бромная вода) обесцвечивается. Это качественная реакция на тройную связь. |
| Например, при бромировании пропина сначала образуется 1,2-дибромпропен, а затем — 1,1,2,2-тетрабромпропан. |
Аналогично алкины реагируют с хлором, но обесцвечивания хлорной воды при этом не происходит, потому что хлорная вода и так бесцветная)
Реакции протекают в присутствии полярных растворителей по ионному (электрофильному) механизму.
1.3. Гидрогалогенирование алкинов
Алкины присоединяют галогеноводороды. Реакция протекает по механизму электрофильного присоединения с образованием галогенопроизводного алкена или дигалогеналкана.
| Например, при взаимодействии ацетилена с хлороводородом образуется хлорэтен, а затем 1,1-дихлорэтан. |
При присоединении галогеноводородов и других полярных молекул к симметричным алкинам образуется, как правило, один продукт реакции, где оба галогена находятся у одного атома С.
При присоединении полярных молекул к несимметричным алкинам образуется смесь изомеров. При этом выполняется правило Марковникова.
| Правило Марковникова: при присоединении полярных молекул типа НХ к несимметричным алкинам водород преимущественно присоединяется к наиболее гидрогенизированному атому углерода при двойной связи. |
| Например, при присоединении хлороводорода HCl к пропину преимущественно образуется 2-хлорпропен. |
1.4. Гидратация алкинов
Гидратация (присоединение воды) алкинов протекает в присутствии кислоты и катализатора (соли ртути II).
Сначала образуется неустойчивый алкеновый спирт, который затем изомеризуется в альдегид или кетон.
| Например, при взаимодействии ацетилена с водой в присутствии сульфата ртути образуется уксусный альдегид. |
Гидратация алкинов протекает по ионному (электрофильному) механизму.
Для несимметричных алкенов присоединение воды преимущественно по правилу Марковникова.
| Например, при гидратации пропина образуется пропанон (ацентон). |
1.5. Димеризация, тримеризация и полимеризация
Присоединение одной молекулы ацетилена к другой (димеризация) протекает под действием аммиачного раствора хлорида меди (I). При этом образуется винилацетилен:
Тримеризация ацетилена (присоединение трех молекул друг к другу) протекает под действием температуры, давления и в присутствии активированного угля с образованием бензола (реакция Зелинского):
Алкины также вступают в реакции полимеризации — процесс многократного соединения молекул низкомолекулярного вещества (мономера) друг с другом с образованием высокомолекулярного вещества (полимера).
nM → Mn (M – это молекула мономера)
| Например, при полимеризации ацетилена образуется полимер линейного или циклического строения. |
… –CH=CH–CH=CH–CH=CH–…
Видео:ОВР с перманганатом калия.Скачать
2. Окисление алкинов
Реакции окисления в органической химии сопровождаются увеличением числа атомов кислорода (или числа связей с атомами кислорода) в молекуле и/или уменьшением числа атомов водорода (или числа связей с атомами водорода).
2.1. Горение алкинов
Алкины, как и прочие углеводороды, горят с образованием углекислого газа и воды.
Уравнение сгорания алкинов в общем виде:
| Например, уравнение сгорания пропина: |
2.2. Окисление алкинов сильными окислителями
Алкины реагируют с сильными окислителями (перманганаты или соединения хрома (VI)). При этом происходит окисление тройной связи С≡С и связей С-Н у атомов углерода при тройной связи. При этом образуются связи с кислородом.
При окислении трех связей у атома углерода в кислой среде образуется карбоксильная группа СООН, четырех — углекислый газ СО2. В нейтральной среде — соль карбоновой кислоты и карбонат (гидрокарбонат) соответственно.
Таблица соответствия окисляемого фрагмента молекулы и продукта:
| Окисляемый фрагмент | KMnO4, кислая среда | KMnO4, H2O, t |
| R-C ≡ | R-COOH | -COOMe |
| CH ≡ | CO2 | Me2CO3 (MeHCO3) |
При окислении бутина-2 перманганатом калия в среде серной кислоты окислению подвергаются два фрагмента СН3–C ≡ , поэтому образуется уксусная кислота:
При окислении 3-метилпентина-1 перманганатом калия в серной кислоте окислению подвергаются фрагменты R–C и H–C , поэтому образуются карбоновая кислота и углекислый газ:
При окислении алкинов сильными окислителями в нейтральной среде углеродсодержащие продукты реакции жесткого окисления (кислота, углекислый газ) могут реагировать с образующейся в растворе щелочью в соотношении, которое определяется электронным балансом с образованием соответствующих солей.
| Например, при окислении бутина-2 перманганатом калия в воде при нагревании окислению подвергаются два фрагмента R–C ≡ , поэтому образуется соль уксусной кислоты – ацетат калия |
Аналогичные органические продукты образуются при взаимодействии алкинов с хроматами или дихроматами.
Окисление ацетилена протекает немного иначе, σ-связь С–С не разрывается, поэтому в кислой среде образуется щавелевая кислота:
В нейтральной среде образуется соль щавелевой кислоты – оксалат калия:
Обесцвечивание раствора перманганата калия — качественная реакция на тройную связь.
Видео:Окисление органических веществ | Химия ЕГЭ для 10 класса | УмскулСкачать

3. Кислотные свойства алкинов
Связь атома углерода при тройной связи (атома углерода в sp-гибридизованном состоянии) с водородом значительно более полярная. чем связь С–Н атома углерода при двойной или одинарной связи (в sp 2 и sp 3 -гибридном состоянии соответственно). Это обусловлено большим вкладом s-орбитали в гибридизованное состояние.
| Гибридизация: | sp | sp 2 | sp 3 |
| Число s-орбиталей | 1 | 1 | 1 |
| Число p-орбиталей | 1 | 2 | 3 |
| Доля s-орбитали | 50% | 33% | 25% |
Повышенная полярность связи С–Н у атомов углерода при тройной связи в алкинах приводит к возможности отщепления протона Н + , т.е. приводит к появлению у алкинов с тройной связью на конце молекулы (алкинов-1) кислотных свойств.
| Ацетилен и его гомологи с тройной связью на конце молекулы R–C ≡ C–H проявляют слабые кислотные свойства, атомы водорода на конце молекулы могут легко замещаться на атомы металлов. |
Алкины с тройной связью на конце молекулы взаимодействуют с активными металлами, гидридами, амидами металлов и т.д.
| Например, ацетилен взаимодействует с натрием с образованием ацетиленида натрия. |
| Например, пропин взаимодействует с амидом натрия с образованием пропинида натрия. |
Алкины с тройной связью на конце молекулы взаимодействуют с аммиачным раствором оксида серебра (I) или аммиачным раствором хлорида меди (I).
При этом образуются нерастворимые в воде ацетилениды серебра или меди (I):
| Алкины с тройной связью на конце молекулы взаимодействуют с аммиачным раствором оксида серебра или аммиачным раствором хлорида меди (I) с образованием белого или красно-коричневого осадка соответственно. Это качественная реакция на алкины с тройной связью на конце молекулы. |
Соответственно, алкины, в которых тройная связь расположена не на конце молекулы, не реагируют с аммиачными растворами оксида серебра или хлорида меди (I).
🔥 Видео
Окисление алкенов с Тасей | Химия ЕГЭСкачать

Окисление ацетилена Как уравнять ОВР в органической химии ЕГЭ ХИМИЯ 2024 10 класс Репетитор по химииСкачать

Взаимодействие ацетилена с раствором перманганата калияСкачать

Окислительно-восстановительные реакции в кислой среде. Упрощенный подход.Скачать

Алкены.Окисление алкенов с KMnO4 и K2Cr2O7. Все 14 реакций ЕГЭ.Скачать

Вся теория по алкинам | Химия ЕГЭ для 10 класса | УмскулСкачать

Все органические ОВР: жесткое окисления за 2 часа | Химия ЕГЭ 2023 | УмскулСкачать

Самые сложные ОВР с перманганатом калия | Химия ЕГЭ 2023 | УмскулСкачать

Перманганат калия: химические свойства, качественные реакции, ОВР в органике и неорганикеСкачать

10 класс (профиль).Ч.2.Окисление алкенов раствором марганцовки в кислой среде.Скачать

Жесткое окисление алкенов. Взаимодействие алкенов с перманганатом калия в щелочной средеСкачать