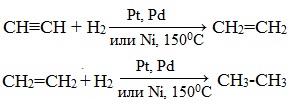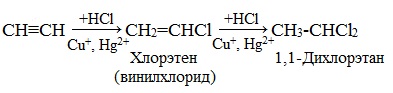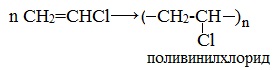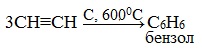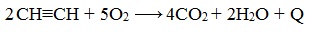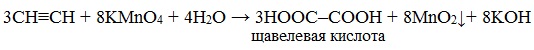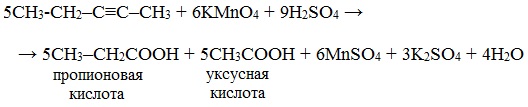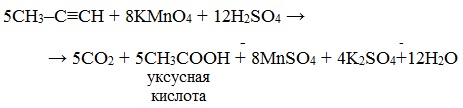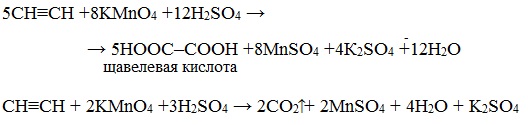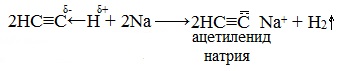В окислительно-восстановительных реакциях органические вещества чаще проявляют свойства восстановителей, а сами окисляются. Легкость окисления органических соединений зависит от доступности электронов при взаимодействии с окислителем. Все известные факторы, вызывающие увеличение электронной плотности в молекулах органических соединений (например, положительные индуктивный и мезомерные эффекты), будут повышать их способность к окислению и наоборот.
Склонность органических соединений к окислению возрастает с ростом их нуклеофильности , что соответствует следующим рядам:
Рост нуклеофильности в ряду
Рассмотрим окислительно-восстановительные реакции представителей важнейших классов органических веществ с некоторыми неорганическими окислителями.
Видео:Самые сложные ОВР с перманганатом калия | Химия ЕГЭ 2023 | УмскулСкачать

Окисление алкенов
При мягком окислении алкены превращаются в гликоли (двухатомные спирты). Атомы-восстановители в этих реакциях – атомы углерода, связанные двойной связью.
Реакция с раствором перманганата калия протекает в нейтральной или слабо щелочной среде следующим образом:
В более жестких условиях окисление приводит к разрыву углеродной цепи по двойной связи и образованию двух кислот (в сильно щелочной среде – двух солей) или кислоты и диоксида углерода (в сильно щелочной среде – соли и карбоната):
Дихромат калия в сернокислотной среде окисляет алкены аналогично реакциям 1 и 2.
При окислении алкенов, в которых атомы углерода при двойной связи содержат по два углеродных радикала, происходит образование двух кетонов:

Видео:ОВР с перманганатом калия.Скачать

Окисление алкинов
Алкины окисляются в несколько более жестких условиях, чем алкены, поэтому они обычно окисляются с разрывом углеродной цепи по тройной связи. Как и в случае алкенов, атомы-восстановители здесь – атомы углерода, связанные кратной связью. В результате реакций образуются кислоты и диоксид углерода. Окисление может быть проведено перманганатом или дихроматом калия в кислотной среде, например:
Ацетилен может быть окислен перманганатом калия в нейтральной среде до оксалата калия:
3CH≡CH +8KMnO 4 → 3KOOC –COOK +8MnO 2 +2КОН +2Н 2 О
В кислотной среде окисление идет до щавелевой кислоты или углекислого газа:
Видео:Окислительно-восстановительные реакции в кислой среде. Упрощенный подход.Скачать

Окисление гомологов бензола
Бензол не окисляется даже в довольно жестких условиях. Гомологи бензола могут быть окислены раствором перманганата калия в нейтральной среде до бензоата калия:
Окисление гомологов бензола дихроматом или перманганатом калия в кислотной среде приводит к образованию бензойной кислоты.
Видео:Окисление пропаналя перманганатом калия в щелочной среде ОВР ЕГЭ по химии 2024 10 класс РепетиторСкачать

Видео:Взаимодействие ацетилена с раствором перманганата калияСкачать

Окисление спиртов
Непосредственным продуктом окисления первичных спиртов являются альдегиды, а вторичных – кетоны.
Образующиеся при окислении спиртов альдегиды легко окисляются до кислот, поэтому альдегиды из первичных спиртов получают окислением дихроматом калия в кислотной среде при температуре кипения альдегида. Испаряясь, альдегиды не успевают окислиться.
С избытком окислителя (KMnO 4 , K 2 Cr 2 O 7 ) в любой среде первичные спирты окисляются до карбоновых кислот или их солей, а вторичные – до кетонов.
Третичные спирты в этих условиях не окисляются, а метиловый спирт окисляется до углекислого газа.
Двухатомный спирт, этиленгликоль HOCH 2 –CH 2 OH, при нагревании в кислой среде с раствором KMnO 4 или K 2 Cr 2 O 7 легко окисляется до щавелевой кислоты, а в нейтральной – до оксалата калия.
3СН 2 (ОН) – СН 2 (ОН) + 8КMnO 4 → 3KOOC –COOK +8MnO 2 +2КОН +8Н 2 О
Видео:Окисление органических соединений перманганатом калияСкачать

Окисление альдегидов и кетонов
Альдегиды – довольно сильные восстановители, и поэтому легко окисляются различными окислителями, например: KMnO 4 , K 2 Cr 2 O 7 , [Ag(NH 3 ) 2 ]OH, Cu(OH) 2 . Все реакции идут при нагревании:
CH 3 CHO + Br 2 + 3NaOH → CH 3 COONa + 2NaBr + 2H 2 O
реакция «серебряного зеркала»
C аммиачным раствором оксида серебра альдегиды окисляются до карбоновых кислот которые в аммиачном растворе дают соли аммония (реакция «серебрянного зеркала»):
Муравьиный альдегид (формальдегид) окисляется, как правило, до углекислого газа:
Кетоны окисляются в жестких условия сильными окислителями с разрывом связей С-С и дают смеси кислот:
Карбоновые кислоты. Среди кислот сильными восстановительными свойствами обладают муравьиная и щавелевая, которые окисляются до углекислого газа.
НСООН + HgCl 2 =CO 2 + Hg + 2HCl
Муравьиная кислота , кроме кислотных свойств, проявляет также некоторые свойства альдегидов, в частности, восстановительные. При этом она окисляется до углекислого газа. Например:
2KMnO4 + 5HCOOH + 3H2SO4 → K2SO4 + 2MnSO4 + 5CO2↑ + 8H2O
При нагревании с сильными водоотнимающими средствами (H2SO4 (конц.) или P4O10) разлагается:
Видео:Необычное окисление ацетилена #органическаяхимия #ацетиленСкачать

Окисление ацетилена перманганатом калия в кислой среде уравнение овр
Алкины во многих реакциях обладают большей реакционной способностью, чем алкены. Для алкинов, как и для алкенов, характерны реакции присоединения. Так как тройная связь содержит две π-связи, реакции присоединения к алкинам могут происходить в две стадии.
Вначале идет присоединение по месту двойной π-связи с образование производных олефинов, а затем по месту второй π-связи с образованием производных алканов.
Реакции присоединения для алкинов протекают медленнее, чем для алкенов. Это объясняется тем, что π-электронная плотность тройной связи расположена более компактно, чем в алкенах, и поэтому менее доступна для взаимодействия с различными реагентами.
Реакции присоединения
1. Гидрирование
Присоединение водорода происходит при нагревании в присутствии металлических катализаторов. Реакция протекает в две стадии: алкины присоединяют водород с образованием алкенов (разрывается первая π-связь), а затем образованием алканов (разрывается вторая π-связь):
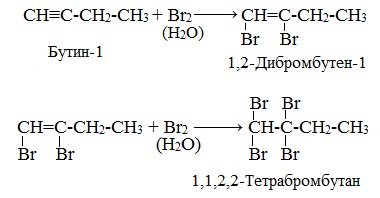
2. Галогенирование
Присоединение галогенов протекает также в две стадии. На первой стадии образуются дигалогеналкены, на второй – тетрагалогеналканы:
Реакция алкинов с бромной водой является качественной реакцией на алкины. Бромная вода обесцвечивается.
Видеоопыт «Взаимодействие ацетилена с бромной водой»
Видеоопыт «Взаимодействие ацетилена с хлором»
3. Гидрогалогенирование
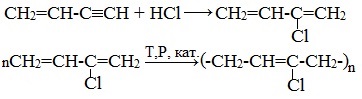
Галогеноводороды присоединяются к алкинам в две стадии. Вторая стадия идет по правилу Марковникова. Присоединение НCl в отсутствии катализатора идет очень медленно. Катализатором этой реакции служат кислоты Льюиса – соли меди (I) и ртути (II):
Получаемый продукт – хлористый винил (винилхлорид) – подобно этилену легко полимеризуется, образуя полимер – поливинилхлорид, который широко применяется в производстве поливинилхлоридных смол:
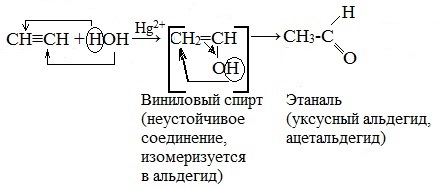
4. Гидратация (реакция Кучерова)
Присоединение воды протекает в присутствии солей ртути (II) при нагревании – HgSO4, Hg (NO3)2 – с образованием уксусного альдегида (при обычных условиях ацетилен с водой не взаимодействует):
На первой стадии реакции образуется непредельный спирт, в котором гидроксильная группа находится непосредственно у атома углерода при двойной связи. Такие спирты принято назвать виниловыми или енолами.
Отличительной чертой енолов является их неустойчивость. В момент образования они изомеризуются в более стабильные карбонильные соединения (альдегиды или кетоны) — водород гидроксильной группы переходит к соседнему атому углероду. При этом π-связь между атомами углерода разрывается и образуется π-связь между атомом углерода и атомом кислорода. Причиной изомеризации является большая прочность двойной связи С=О по сравнению с двойной связью С=С.
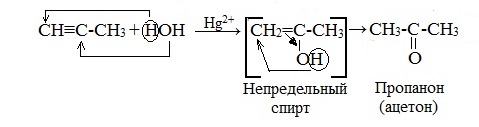
Гидратация гомологов ацетилена протекает по правилу Марковникова, и образующиеся енолы изомеризуются в кетоны:
5. Реакции полимеризации
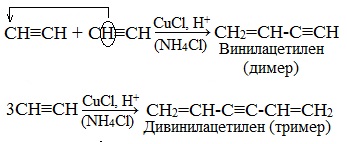
В присутствии катализаторов алкины могут реагировать друг с другом, причем в зависимости от условий образуются различные продукты.
1.Димеризация под действием водно-аммиачного раствора CuCl:
Винилацетилен обладает большой реакционной способностью – присоединяя хлороводород, он образует хлоропрен (2-хлорбутадиен-1,3), используемый для получения искусственного хлорпренового каучука:
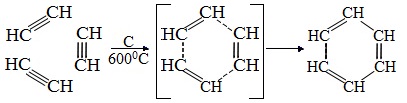
2.Тримеризация ацетилена над активированным углем приводит к образованию бензола (реакция Зелинского):
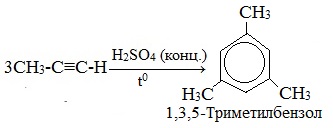
В аналогичные реакции тримеризации могут вступать также и ближайшие гомологи ацетилена, например пропин:
1. Горение
При сгорании алкинов происходит их полное окисление до СО2 и Н2О. Горение ацетилена сопровождается выделением большого количества тепла:
Температура ацетиленово-кислородного пламени достигает 2800- 3000°С. На этом основано применение ацетилена для сварки и резки металла. Ацетилен образует с воздухом и кислородом взрывоопасные смеси.
Видеоопыт «Взрыв смеси ацетилена с кислородом»
В сжатом, и особенно в сжиженном, состоянии он способен взрываться от удара. Поэтому ацетилен хранится в стальных баллонах в виде растворов в ацетоне, которым пропитывают асбест.
2. Неполное окисление
Ацетилен и его гомологи легко окисляются окислителями — КMnO4, K2Cr2O7. Алкины окисляются с разрывом молекулы по тройной связи. Строение продуктов окисления зависит от природы окислителя и условий проведения реакций.
Алкины обесцвечивают разбавленный раствор перманганата калия, что доказывает их ненасыщенность.
а) мягкое окисление
Мягкое окисление алкинов происходит без разрыва σ-связи С─С (разрушаются только π-связи).
Например, при взаимодействии ацетилена с разбавленным раствором КMnO4 при комнатной температуре образуется двухосновная щавелевая кислота:
В нейтральной и слабощелочной средах на холоде образуются соли карбоновых кислот. При взаимодействии ацетилена с водным раствором перманганата калия образуется соль щавелевой кислоты (оксалат калия):
б) Жесткое окисление
При жестком окислении (нагревание, концентрированные растворы, кислая среда) происходит расщепление углеродного скелета молекулы алкина по тройной связи и образуются карбоновые кислоты.
Окисление алкинов перманганатом калия в кислой среде при нагревании сопровождается разрывом углеродной цепи по месту тройной связи и приводит к образования карбоновых кислот:
Окисление алкинов, содержащих тройную связь у крайнего атома углерода, сопровождается в этих же условиях образованием карбоновой кислоты и выделением углекислого газа:
В кислой среде окисление ацетилена идет до щавелевой кислоты или углекислого газа:
Видеоопыт «Взаимодействие ацетилена с раствором перманганата калия»
Реакция КMnO4 является качественной реакцией на алкины. Раствор перманганата калия обесцвечивается.
Образование солей
Особенностью алкинов, имеющих концевую тройную связь (алкины-1), является их способность проявлять слабые кислотные свойства.
Атомы водорода, связанные с sp-гибридизированными атомами углерода в молекулах алкинов, обладают значительной подвижностью, что объясняется поляризацией σ-связи ≡С─Н. В связи с этим атомы водорода могут замещаться атомами металлов, в результате чего образуются соли — ацетилениды.
Ацетилениды щелочных и щелочноземельных металлов используются для получения гомологов ацетилена.
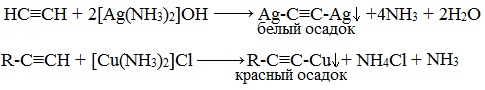
Ацетилениды серебра и меди (I) легко образуются и выпадают в осадок при пропускании ацетилена через аммиачный раствор оксида серебра или хлорида меди (I).
Образование серовато- белого осадка ацетиленида серебра (или красно-коричневого – ацетиленида меди) служит качественной реакцией на концевую тройную связь.
Видеоопыт «Получение ацетиленида серебра»
Видеоопыт «Получение ацетиленида меди»
Ацетилениды серебра и меди как соли слабых очень кислот легко разлагаются при действии хлороводородной кислоты с выделением исходного алкина.
Ацетилиниды серебра и меди в сухом виде взрываются от удара. Однако карбид кальция, который также является ацетиленидом, очень устойчив к удару. Он широко используется для получения ацетилена.
Если тройная связь находится не на конце цепи, то кислотные свойства отсутствуют (нет подвижного атома водорода) и ацетилениды не образуются.
Видео:Окисление ВСЕХ органических веществ за 4 часа | Химия ЕГЭ 2023 | УмскулСкачать

Acetyl
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. 💡 ВидеоРеакция этилена с раствором перманганата калияСкачать  Окислительно-восстановительные реакции в кислой среде. Продвинутый подход.Скачать  ОВР и Метод Электронного Баланса — Быстрая Подготовка к ЕГЭ по ХимииСкачать  Окисление ацетилена Как уравнять ОВР в органической химии ЕГЭ ХИМИЯ 2024 10 класс Репетитор по химииСкачать  10 класс (профиль).Ч.2.Окисление алкенов раствором марганцовки в кислой среде.Скачать  окисление алкенов в кислой средеСкачать  Окислительно-восстановительные реакции на примере алкенов (ОВР). ЕГЭ по химииСкачать  Окисление Толуола Перманганатом Калия В Сернокислой СредеСкачать  3.3. Алкины: Химические свойстваСкачать  ОВР в органических реакциях на примере окисления алкенов растворами перманганата калияСкачать  Перманганат калия: химические свойства, качественные реакции, ОВР в органике и неорганикеСкачать  |