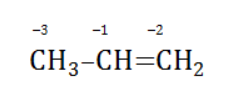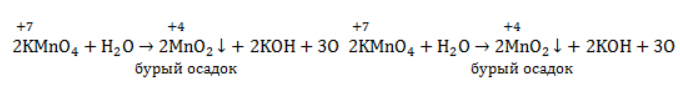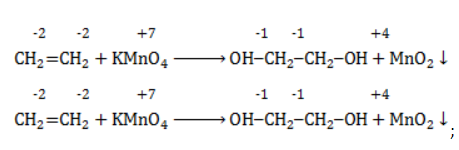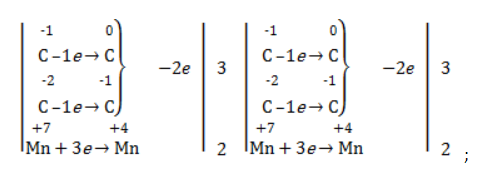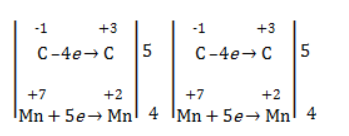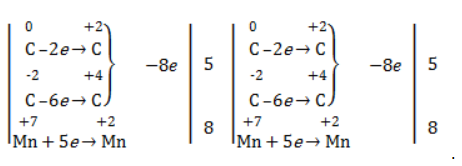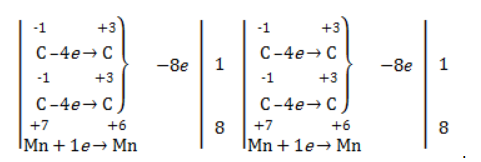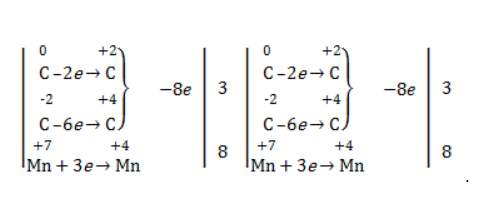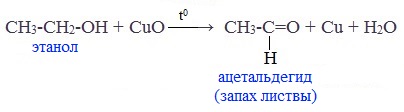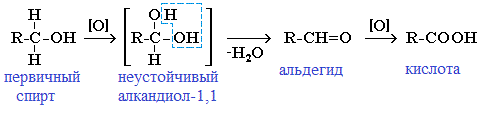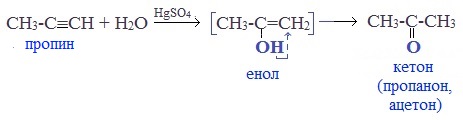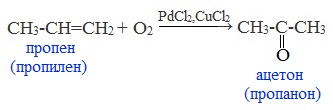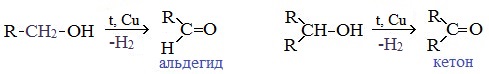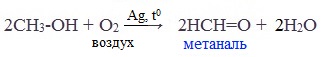В отличие от предельных углеводородов, алкены характеризуются высокой химической активностью, обусловленной особенностями строения молекулы. При обычных условиях алкены охотно вступают в реакции неполного окисления с превращением в органические соединения других классов. Универсальный реагент в процессах окисления алкенов – перманганат калия.
- Понятие о неполном окислении
- Определение степеней окисления
- Влияние среды на окислитель
- Мягкое окисление
- Жесткое окисление
- Окисление перманганатом калия в кислой среде
- Окисление алкенов в щелочной среде
- Окисление в нейтральном растворе
- Заключение
- Окисление алкенов альдегид уравнение реакции
- Получение формальдегида
- Получение и свойства алкенов
- Физические свойства алкенов
- Получение алкенов
- Химические свойства алкенов
- Реакции присоединения
- Изомеризация алкенов
- Полимеризация алкенов
- Реакции окисления
- Применение алканов
- 📹 Видео
Видео:Химия с нуля — Химические свойства АлкеновСкачать

Понятие о неполном окислении
В химии органических соединений под окислением понимается взаимодействие, при котором происходит обеднение реагента водородом или обогащение кислородом, сопровождающееся отдачей электронов молекулой. Обратный процесс называется восстановлением.
Полное окисление происходит при горении углеводородов с разрушением молекулы. Продуктами в этом случае являются углекислый газ и вода. При неполном окислении продуктами становятся различные вещества.
Высокая реакционная способность алкенов обусловливается присутствием в молекуле двойной связи. Один из ее компонентов – слабая 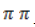
Определение степеней окисления
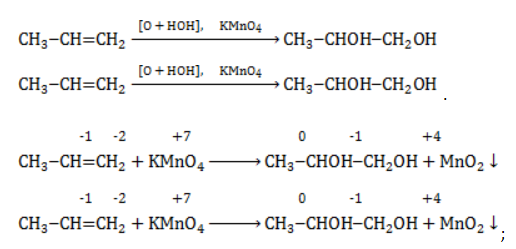
Для того чтобы правильно записать уравнение реакции неполного окисления алкена, нужно определить степени окисления атомов до вступления во взаимодействие и после него. Они рассчитываются исходя из электроотрицательности элементов.
Например, при окислении пропена перманганатом калия 


- В составе группы
углерод, обладающий большей электроотрицательностью, смещает к себе электронные пары двух связей
, отнимая у водородных атомов по одному отрицательному заряду. На связи
сдвига электронов нет. Следовательно, атом углерода приобретает степень окисления -2 -2;
- В группе
аналогичный подсчет показывает для углерода степень окисления -1 -1 (для каждого водорода соответственно +1 +1);
- В радикале
углерод оттягивает на себя отрицательные заряды с трех водородных атомов и имеет степень окисления -3 -3.
В общем виде результат можно записать следующим образом:
Расчет степеней окисления в кислородсодержащих соединениях производится аналогично с учетом большей электроотрицательности кислорода.
Видео:Окисление алкенов с Тасей | Химия ЕГЭСкачать

Влияние среды на окислитель
Состав раствора (наряду с температурой) определяет, до какого соединения окислится восстановитель – алкен. Окислитель в растворах с различным уровнем кислотности (щелочности) также ведет себя неодинаково.
Неорганическая соль 


В нейтральной и слабощелочной среде марганец приобретает степень окисления +4 +4:
Кислород из перманганат-аниона присоединяется к алкену по месту двойной связи.
Под воздействием серной кислоты марганец восстанавливается до степени окисления +2 +2:
При окислении со щелочью (гидроксид лития достаточно высокой концентрации) марганец восстановится до +6 +6:
Видео:ОКИСЛЕНИЕ АЛКЕНОВ ЕГЭ / жёсткое, мягкое окисление в органике с KMnO4Скачать

Мягкое окисление
Процесс в нейтральной или слабощелочной среде при обычной температуре представляет собой так называемое мягкое окисление перманганатом калия, или гидроксилирование. В алкене разрывается 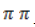
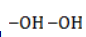
- кислород из перманганат-иона;
- вода.
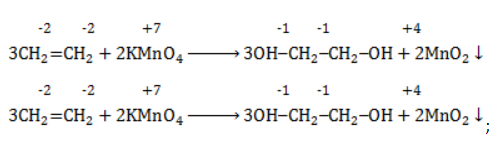
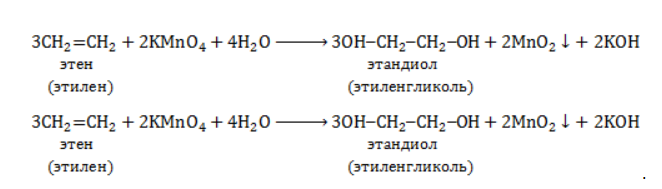
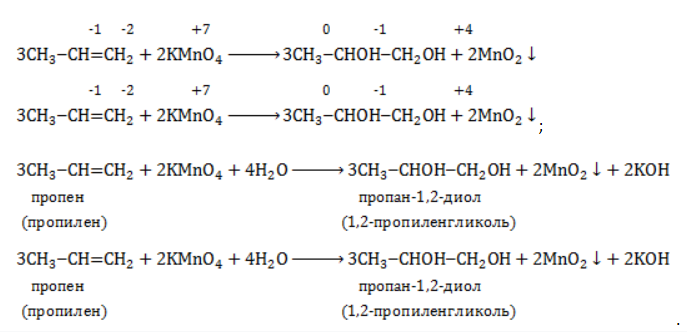
Продукт реакции – диол (двухатомный спирт). Например, окисление этилена перманганатом калия приводит к образованию этиленгликоля:
Для составления полного уравнения нужно:
- определить степени окисления реагентов:
- рассчитать электронный баланс:
- расставить коэффициенты:
- ввести в уравнение недостающие реагенты и продукты, исходя из равенства состава в левой и правой частях уравнения, и определить окончательные коэффициенты:
Реакция окисления пропена в нейтральной среде перманганатом калия составляется аналогично:
Дальше мягкое окисление не идет, так как 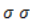
Видео:2.3. Алкены: Химические свойстваСкачать

Жесткое окисление
Жесткими называют процессы окисления, протекающие в нейтральном растворе в условиях повышенной температуры, а также при добавлении кислоты или щелочи. В этих случаях двойная связь в алкене разрушается полностью, а продуктами реакции становятся кетоны, кислоты (с промежуточным окислением до альдегида) либо соли.
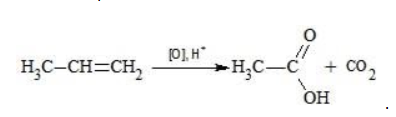
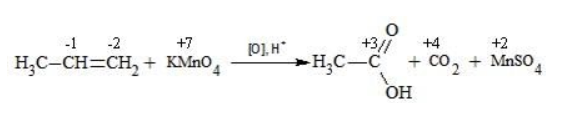
Окисление перманганатом калия в кислой среде
Пропен в содержащем кислоту растворе 

Степени окисления участвующих в реакции углеродных атомов и марганца составят:
Электронный баланс определяется только с учетом углерода, вошедшего в состав кислоты:
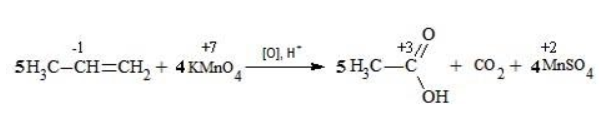
Сначала расставляются коэффициенты в окислителе, восстановителе и в продуктах окисления:
Затем вписываются недостающие вещества и полностью рассчитываются коэффициенты:
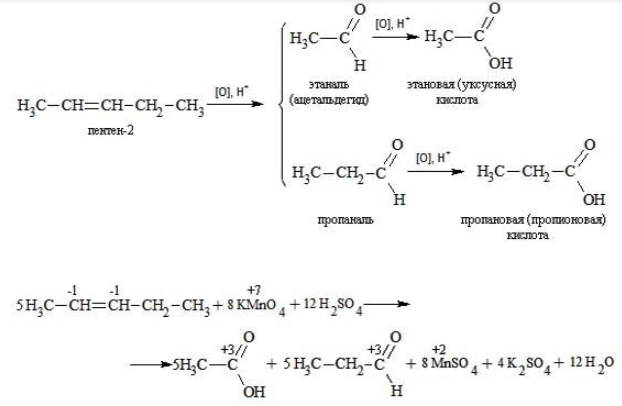
Еще один пример жесткого окисления алкенов перманганатом калия с серной кислотой – реакция с участием пентена-2. Молекула расщепляется по месту двойной связи, и ее фрагменты окисляются через промежуточное образование альдегидов до двух кислот:
Электронный баланс составляется для двух углеродных атомов алкена, поскольку оба они являются восстановителями.
Правило, по которому осуществляется окисление углерода, отражено в таблице:
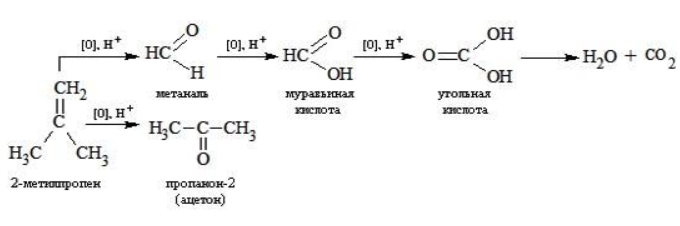
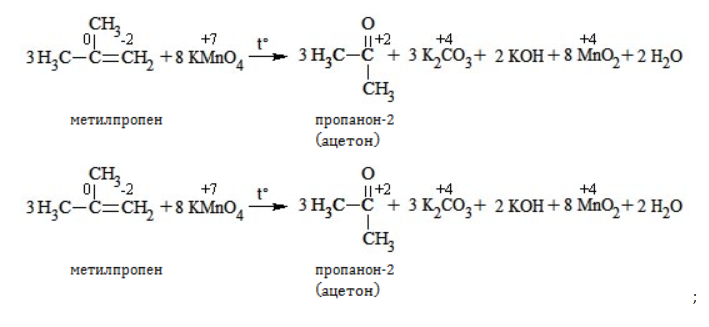
Так, в 2-метилпропене первичный атом окисляется через промежуточные формальдегид (метаналь) и муравьиную кислоту полностью – до углекислого газа, а третичный – только до ацетона:
Окисление алкенов в щелочной среде
При нагревании с концентрированной щелочью алкены окисляются до солей:
Если один из углеродных атомов – первичный, он окисляется до углекислого газа:
Окисление в нейтральном растворе
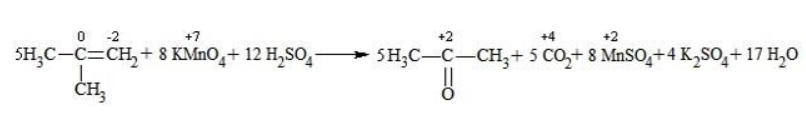
В условиях высокой температуры образующаяся щелочь вступает в реакцию, в результате которой окисление алкенов продолжается до образования кетонов или солей. Так, при жестком окислении пропена в нейтральной среде получаются те же продукты, что и в присутствии концентрированного гидроксида калия: ацетат 




Кетон – результат окисления третичного углеродного атома, и дальнейшую реакцию они не поддерживают. Например, при окислении метилпропена как конечный продукт образуется ацетон:
Видео:Жёсткое окисление алкенов, алкинов, алкадиеновСкачать

Заключение
Взаимодействие с раствором перманганата калия в мягких или жестких условиях является показателем высокой реакционной способности алкенов, которая обусловлена присутствием в молекуле легко разрываемой -связи. Реакции мягкого и жесткого окисления относятся к числу характерных химических свойств алкенов как ненасыщенных углеводородов.
Видео:Химические свойства алкенов. Реакции окисления | ХимияСкачать

Окисление алкенов альдегид уравнение реакции
1. Окисление спиртов
В лаборатории карбонильные соединения получают окислением спиртов в жестких условиях в присутствии сильных окислителей (дихромата калия К2Cr2O7 или перманганата калия КМnО4) в серной кислоте Н2SO4. В качестве окислителя можно использовать оксид меди (II) при нагревании.
При окислении первичных спиртов образуются альдегиды:
Видеоопыт «Окисление этилового спирта оксидом меди (II)»
Первичные спирты при окислении образуют альдегиды, которые затем легко окисляются до карбоновых кислот:
Чтобы предотвратить превращение альдегида в кислоту, его отгоняют в ходе реакции (tкип альдегида, не образующего межмолекулярные водородные связи, ниже tкип спирта и кислоты).
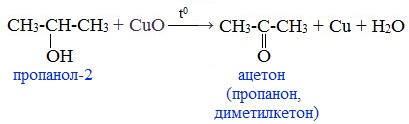
При окислении вторичных спиртов образуются кетоны:
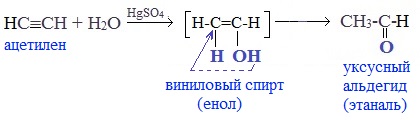
Присоединение воды к ацетилену происходит в присутствии катализатора соли ртути (II) и идет через образование неустойчивого непредельного спирта (енола), который изомеризуется в уксусный альдегид (в случае ацетилена):
Кетоны получают при гидратации других гомологов ряда алкинов:
Раньше это был промышленный способ получения карбонильных соединений. В настоящее время этот способ находит ограниченное применение из-за загрязнения получаемых продуктов токсичными солями ртути и относительной дороговизны.
3. Каталитическое окисление алкенов кислородом воздуха
Этим способом в промышленности получают уксусный альдегид — окислением этилена кислородом воздуха (Вакер-процесс).
Эта реакция протекает в присутствии катализатора – смеси PdCl2 и CuCl2 и температуре 100 0 С:
Этим экономичным способом получают низшие альдегиды и кетоны.
Этот промышленный способ более перспективен, чем гидратация алкинов, при которой используются токсичные ртутные катализаторы.
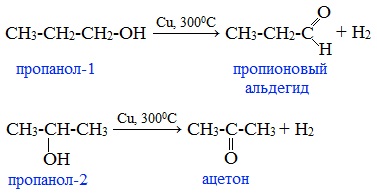
4. Каталитическое дегидрирование спиртов
В промышленности альдегиды и кетоны получают дегидрированием спиртов, пропуская пары спирта над нагретым катализатором (Cu, соединения Ag, Cr или Zn).
Первичные спирты окисляются до альдегидов, а вторичные – до кетонов.
Этот способ получения объясняет суть названия «альдегид» (от лат. alconol dehydrogenatum – спирт, от которого «отняли» водород).
Этот способ позволяет получать карбонильные соединения, в особенности альдегиды, без побочных продуктов окисления.
В 1835 г. немецкий химик Ю. Либих выделил индивидуальное вещество, молекула которого содержала на два атома водорода меньше, чем этанол. Ученый установил состав этого соединения – С2Н4О и назвал его альдегидом (от лат. al conol dehyd rogenatum — т.е. дегидрированный спирт, «спирт, лишенный водорода»).
В 1867 г. немецкий химик-органик А. Гофман, пропуская пары метилового спирта над раскаленной платиновой спиралью, получил газообразное вещество состава СН2О, молекула которого отличается от открытого Либихом альдегида на группу -СН2— . Именно это соединение (муравьиный альдегид) открывает гомологический ряд альдегидов.
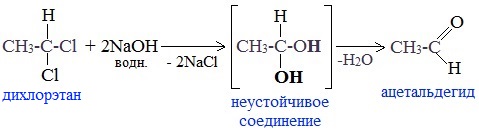
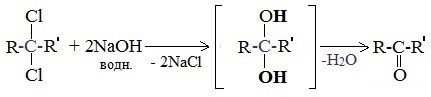
5. Щелочной гидролиз дигалогеналканов
Реакция протекает при действии водных растворов щелочей на дигалогензамещенные углеводороды, содержащие два атома галогена у одного и того же атома углерода.
При щелочном гидролизе дигалогеналканов образуются двухатомные спирты, в которых две группы ОН соединены с одним атомом углерода. Эти вещества неустойчивы и при отщеплении воды, превращаются в карбонильные соединения.
Если два атома галогена связаны с первичным атомом углерода, то образуются альдегиды:
При гидролизе дигалогеналканов, содержащих атомы галогена у вторичного атома углерода, образуются кетоны:
Это лабораторный способ получения карбонильных соединений.
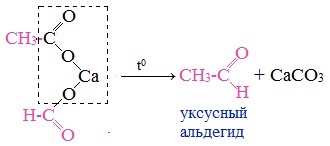
6. Пиролиз солей карбоновых кислот
При пиролизе (термическое разложение) кальциевых, бариевых солей карбоновых кислот образуются соответствующие карбонильные соединения. Из смешанной соли муравьиной и другой карбоновой кислоты получают альдегиды, а в остальных случаях образуются кетоны.
Это лабораторный способ получения карбонильных соединений.
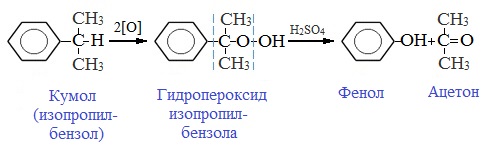
7. Кумольный способ получения ацетона (наряду с фенолом)
Простейший кетон – ацетон – получают кумольным методом вместе с фенолом:
Это промышленный способ получения ацетона.
Преимущества метода: безотходная технология (выход полезных продуктов > 99%) и экономичность. В настоящее время кумольный способ используется как основной в мировом производстве фенола.
Получение формальдегида
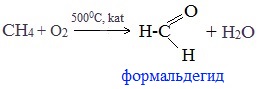
1. Окисление метана
Формальдегид в промышленности можно получить окислением метана кислородом воздуха при высоких температурах с использованием катализатора:
2. Окисление метанола
Основной промышленный способ получения формальдегида – окисление метанола с использованием серебряного катализатора при температуре 650 0 С и атмосферном давлении:
Реакция происходит на раскаленной серебряной сетке, через которую проходят пары ментола, смешанные с воздухом. Реакция настолько экзотермична, что выделяющейся в ходе ее теплоты достаточно для того, чтобы поддерживать сетку в раскаленном состоянии.
В настоящее время разработан перспективный способ высокотемпературного окисления метанола с использованием железомолибденовых катализаторов:
Видео:окисление алкенов в кислой средеСкачать

Получение и свойства алкенов
Способы получения и свойства алкенов имеют существенные отличия по сравнению с алканами. Двойная связь в составе углеродной цепи алкенов очень реакционноспособна, поэтому они охотно вступают в реакции присоединения, в отличие от алканов, для которых характерны реакции замещения. Далее подробно рассмотрим способы получения, физические и химические свойства алкенов.
Видео:Окисление ВСЕХ органических веществ за 4 часа | Химия ЕГЭ 2023 | УмскулСкачать

Физические свойства алкенов
Физические свойства алкенов, такие как температура плавления и кипения немного ниже температуры кипения соответствующих алканов.
Первые представители данного класса с C1по C4 — газообразные вещества, практически не имеющие запаха, C5-C17 – жидкости с резким запахом, более 17 атомов углерода – твердые вещества.
Растворимость. Они плохо растворимы в воде, и хорошо растворимы в органических соединениях. Их плотность меньше плотности воды.
Алкены-неполярные соединения, практически нерастворимые в воде и растворимые в органических растворителях. Они менее плотные, чем вода.
Температура плавления и кипения. Температура кипения/плавления увеличивается прямо пропорционально относительной молекулярной массы соединения. В таблице представлены некоторые физические характеристики алкенов, а на рисунке зависимость температур их кипения/плавления от числа углеродных атомов.
Устойчивость алкенов. В целом цис-алкен менее устойчив, чем его стерео транс-изомер. Это обусловлено нестабильностью цис-изомера вследствие влияния стерического фактора.
Видео:10.3. Альдегиды и кетоны: Химические свойства. ЕГЭ по химииСкачать

Получение алкенов
Алкены получают следующими способами:
1.Термический крекинг алканов. При Т=450-700°С разложение алканов приводит к образованию более низкомолекулярных алканов и алкенов:
2.Дегидрирование алканов. Реакция протекает в присутствии катализаторов Pt, Pd, Ni, Fe, Cr2O3, Fe2O3, ZnO при Т
3.Неполное гидрирование алкинов в присутствии катализатора (Ni, Pt, Pd) при T
4.Реакция отщепления (элиминирование) – дегидратация, дегалогенирование, дегидрогалогенирование.
- Дегидратация спиртов при Т≥ 150°С, в присутствии водоотнимающего агента — серной кислоты:
- Дегидрогалогенирование моногалогеналкановпод действием спиртового раствора щелочи:
- Дегалогенирование дигалогеналканов при действии активных металлов:
При протекании реакций элиминирования с участием спиртов и моногалогеналканов отщепление атома водорода происходит от менее гидрогенизированного атома углерода (т.е. того атома углерода, который соединен с наименьшим числом атомов водорода). Это правило известно, как правило Зайцева.
Видео:ЭТО ПОМОЖЕТ разобраться в Органической Химии — Алкены, Урок ХимииСкачать

Химические свойства алкенов
Химические свойства алкенов обусловлены наличием двойной связи, которая состоит из сильной сигма (σ) связи и слабой пи (π) связи. Типичные реакции алкенов протекают с разрывом этой более слабой π-связи и формированием двух σ-связей. При взаимодействии электофильного агента (E + ) с алкеном образуется очень реакционноспособный карбкатион, который очень быстро присоединяет нуклеофильный агент (Nu — ):
1 стадия – образование карбкатиона протекает медленно:
2 стадия – присоединение нуклеофила протекает очень быстро:
Реакции присоединения
1.Гидрирование алкенов в присутствии платинового или никелевого катализатора. Реакция является экзотермической.
2.Галогенирование алкенов в инертном растворителе, например, четыреххлористый углерод. Алкены реагируют с галогенами с образованием дигалоалканов. Реакционная способность галогенов уменьшается в ряду: хлор > бром > йод.
Для обнаружения двойной углерод-углеродной связи используют бром. При добавлении к алкену 5% раствора брома в тетрахлорметане, последний обесцвечивается, что указывает на наличие двойной связи в молекуле.
3.Гидрогалогенирование алкенов концентрированными водными растворами галогенводородов. Реакционная способность растет в ряду HI > HBr > HCl.
Симметричные алкены дают только один продукт из-за эквивалентности двух атомов углерода.
В несимметричных алкенах добавление галогенводорода происходит таким образом, что атом галогена (отрицательная часть молекулы) присоединяется к атому углерода, который соединен с меньшим количеством атомов водорода (т.е. наименее гидрогенезированный). Это правило известно как правило Марковникова (1869 г.):
Однако в некоторых случаях присоединение галогенводорода происходит против правила Марковникова. Например, в присутствии кислорода и пероксидов проявляется пероксидный эффект:
Присоединение против правила Марковникова может также идти в случае наличия в молекуле алкена электронноакцепторных групп, например, -СООН, –СN, –CHal3 (Hal–галоген), –C(O)–R, –COOR, –NO2, –N=O, –SO3H и т.п.:
4.Гидратация алкенов в присутствии разбавленных кислот и катализатора. Например, при пропускании смеси этена и пара над фосфорной кислотой и кремнеземом под давлением 65 атм, а при 300С получают этанол.
5.Сульфирование алкенов концентрированной серной кислотой протекает в соответствии с правилом Марковникова:
6.Гипогалогенирование алкенов происходит по правилу Марковникова:
7.Алкилирование алкенов в кислой среде:
8.Присоединение альдегидов алкенами (реакция Принса):
Изомеризация алкенов
Полимеризация алкенов
Полиприсоединение — это процесс, с помощью которого большое количество молекул одного вида объединяются (без выделения простых молекул, таких как НHal, Н2О и т.д.) для образования гигантской молекулы, называемой полимером. Алкены подвергаются полимеризации при нагревании под давлением в присутствии подходящих катализаторов. Например, при нагревании этена до 1000 о С под давлением 1000 атм. в присутствии кислорода получают полиэтилен.
Реакции окисления
Окисление алкенов происходит легко, но продукт окисления зависит от окисляющего агента. Существует множество вариантов окисления алкенов. Рассмотрим основные из них:
- Горение алкенов. Алкены, как и алканы, очень горючие. Алкены горят светящим пламенем. Реакции их горения являются экзотермическими.
- Окисление кислородом воздуха при Т=200-500 о С, в присутствии серебряного катализатора или надкислотами (реакция Прилежаева) ведет к образованию эпоксидов:
- Окисление алкенов под действием холодного щелочного раствора перманганата калия приводит к образованию дигидроксильных соединений (диолы или гликоли). Перманганат калия при этом обесцвечивается, поэтому реакция является качественной на присутствие кратных связей. Такая реакция носит имя Вагнера:
- Окисление алкенов под действием подкисленного раствора перманганата или бихромата калия или окиси хрома (III) приводит к образованию кислоты и кетона:
- Озонирование алкенов приводит к образованию озонидов, которые далее под действием воды в присутствии восстановителя образуют альдегиды (Реакция Гарриеса). Окисление алкенов озоном с последующим разложением образовавшегося озонида водой называют озонолизом. Характер продуктов (альдегидов и кетонов), образующихся вследствие озонолиза, зависит от расположения двойной связи в материнском алкене. Поэтому такая реакция обеспечивает очень удобный способ определения положения двойной связи в любой молекуле:
Более высокомолекулярные алкены, содержащие длинную С-С цепь, обладают алкан-подобной структурой. Вследствие этого они могут вступать в реакции замещения подобно алканам.
Применение алканов
Где применяются представители ненасыщенных соединений -алкены? Этилен — ценное сырье для химического производства. Из него получают стирол, винилхлорид, этанол, уксусный альдегид, уксусную кислоту, и также дихлорэтан.
Полимеризацией алкенов получают различные полимеры, смазочные материалы и резиновые изделия.
В среднем мировое производство полиэтилена составляет 100 миллионов тонн в год. В промышленных объемах из пропилена получают полипропилен. Кроме того, пропилен — стартовый материал для производства окиси, изопропилового спирта, кумола, бутиральдегида, глицерина.
Бутены, главным образом, необходимы производстве полиизобутилена, метилэтилкетона, бутилкаучука, изопрена. Изобутилен — превосходное химическое сырье для производства третичного бутанола, бутилкаучука, а также изопрена. Применяется при алкилировании фенолов для изготовления сурфактантов (особые вещества, покрывающие альвеолы легких).
Сополимеры с бутенами используются в качестве изолятора и добавок для масел.
Высшие алкены используются не только в производстве полимерных материалов, но также и в производстве высших органических спиртов.
📹 Видео
Окисление алкенов в мягких условиях (нейтральная среда)Скачать

Окислительно-восстановительные реакции на примере алкенов (ОВР). ЕГЭ по химииСкачать

10 класс (профиль).Ч.2.Окисление алкенов раствором марганцовки в кислой среде.Скачать

Окисление алкенов в кислой средеСкачать

Мягкое окисление алкенов или реакция ВагнераСкачать

Мягкое окисление алкенов. Реакция Вагнера.Скачать

Опыты по химии. Окисление спирта в альдегидСкачать

Алкены.Окисление алкенов с KMnO4 и K2Cr2O7. Все 14 реакций ЕГЭ.Скачать

Реакция окисления альдегидов | ХимияСкачать

Как уравнять органическую ОВР? Реакция мягкого окисления алкенов Вагнера//Подготовка к ЕГЭ по ХимииСкачать



 углерод, обладающий большей электроотрицательностью, смещает к себе электронные пары двух связей
углерод, обладающий большей электроотрицательностью, смещает к себе электронные пары двух связей