Метан CH4 – это предельный углеводород, содержащий один атом углерода в углеродной цепи. Бесцветный газ без вкуса и запаха, легче воды, нерастворим в воде и не смешивается с ней.
- Гомологический ряд метана
- Строение метана
- Изомерия метана
- Химические свойства метана
- 1. Реакции замещения
- 1.1. Галогенирование
- 1.2. Нитрование метана
- 2. Реакции разложения метана (д егидрирование, пиролиз)
- 3. Окисление метана
- 3.1. Полное окисление – горение
- 3.2. Каталитическое окисление
- Получение метана
- 1. Взаимодействие галогеналканов с металлическим натрием (реакция Вюрца)
- 2. Водный или кислотный гидролиз карбида алюминия
- 3. Декарбоксилирование солей карбоновых кислот (реакция Дюма)
- 4. Синтез Фишера-Тропша
- 5. Получение метана в промышленности
- Электронное и пространственное строение молекулы метана (10 класс)
- Описание презентации по отдельным слайдам:
- Дистанционное обучение как современный формат преподавания
- Инструменты онлайн-обучения на примере программ Zoom, Skype, Microsoft Teams, Bandicam
- Педагогическая деятельность в контексте профессионального стандарта педагога и ФГОС
- Дистанционные курсы для педагогов
- Найдите материал к любому уроку, указав свой предмет (категорию), класс, учебник и тему:
- Другие материалы
- Вам будут интересны эти курсы:
- Оставьте свой комментарий
- Автор материала
- Дистанционные курсы для педагогов
- Подарочные сертификаты
- Метан – формула, свойства, применение
- Общее понятие о строении метана
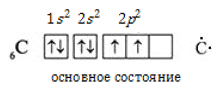
- Электроны в атоме углерода
- Молекула метана
- Физические свойства
- Химические свойства
- Метан в природе
- Получение метана
- Области применения
- Топливо
- Металлообработка
- Бытовое применение метана
- Метан как химическое сырье
- Вред и польза метана
Видео:Гибридизация атомных орбиталей и геометрия молекул. 10 класс.Скачать

Гомологический ряд метана
Все алканы — вещества, схожие по физическим и химическим свойствам, и отличающиеся на одну или несколько групп –СН2– друг от друга. Такие вещества называются гомологами, а ряд веществ, являющихся гомологами, называют гомологическим рядом.
Самый первый представитель гомологического ряда алканов – метан CH4, или Н–СH2–H.
Продолжить гомологический ряд можно, последовательно добавляя группу –СН2– в углеводородную цепь алкана.
| Название алкана | Формула алкана |
| Метан | CH4 |
| Этан | C2H6 |
| Пропан | C3H8 |
| Бутан | C4H10 |
| Пентан | C5H12 |
| Гексан | C6H14 |
| Гептан | C7H16 |
| Октан | C8H18 |
| Нонан | C9H20 |
| Декан | C10H22 |
Общая формула гомологического ряда алканов CnH2n+2.
Первые четыре члена гомологического ряда алканов – газы, C5–C17 – жидкости, начиная с C18 – твердые вещества.
Видео:Метан. Состав. Строение. Свойства. Получение и применение метанаСкачать

Строение метана
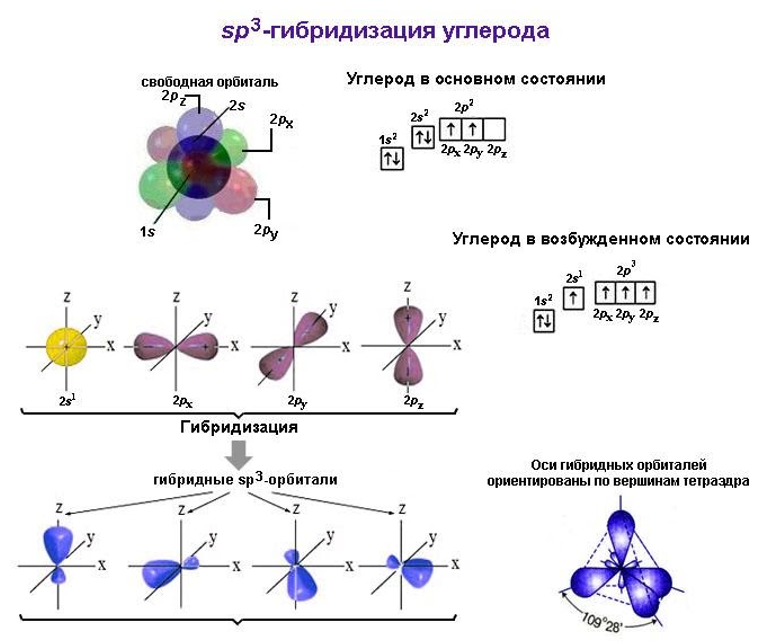
В молекуле метана встречаются связи C–H. Связь C–H ковалентная слабополярная. Это одинарная σ-связь. Атом углерода в метане образует четыре σ-связи. Следовательно, гибридизация атома углерода в молекуле метана– sp 3 :
При образовании связи С–H происходит перекрывание sp 3 -гибридной орбитали атома углерода и s-орбитали атома водорода:
Четыре sp 3 -гибридные орбитали атома углерода взаимно отталкиваются, и располагаются в пространстве так, чтобы угол между орбиталями был максимально возможным.
Поэтому четыре гибридные орбитали углерода в алканах направлены в пространстве под углом 109 о 28′ друг к другу:
Это соответствует тетраэдрическому строению молекулы.
| Например, в молекуле метана CH4 атомы водорода располагаются в пространстве в вершинах тетраэдра, центром которого является атом углерода |
Видео:Видео №1. Строение молекулы метанаСкачать

Изомерия метана
Для метана не характерно наличие изомеров – ни структурных (изомерия углеродного скелета, положения заместителей), ни пространственных.
Видео:11 класс.Элементы 4 периода.Электронные формулы.Скачать

Химические свойства метана
Метан – предельный углеводород, поэтому он не может вступать в реакции присоединения.
Для метана характерны реакции:
Разрыв слабо-полярных связей С – Н протекает только по гомолитическому механизму с образованием свободных радикалов.
Поэтому для метана характерны только радикальные реакции.
Метан устойчив к действию сильных окислителей (KMnO4, K2Cr2O7 и др.), не реагирует с концентрированными кислотами, щелочами, бромной водой.
Видео:Пространственное строение молекулы метанаСкачать

1. Реакции замещения
Для метана характерны реакции радикального замещение.
1.1. Галогенирование
Метан реагирует с хлором и бромом на свету или при нагревании.
При хлорировании метана сначала образуется хлорметан:
Хлорметан может взаимодействовать с хлором и дальше с образованием дихлорметана, трихлорметана и тетрахлорметана:
| Химическая активность хлора выше, чем активность брома, поэтому хлорирование протекает быстро и неизбирательно. |
Бромирование протекает более медленно.
Реакции замещения в алканах протекают по свободнорадикальному механизму.
Свободные радикалы R∙ – это атомы или группы связанных между собой атомов, которые содержат неспаренный электрон.
Первая стадия. Инициирование цепи.
Под действием кванта света или при нагревании молекула галогена разрывается на два радикала:
Свободные радикалы – очень активные частицы, которые стремятся образовать связь с каким-либо другим атомом.
Вторая стадия. Развитие цепи.
Радикал галогена взаимодействует с молекулой алкана и отрывает от него водород.
При этом образуется промежуточная частица – алкильный радикал, который в свою очередь взаимодействует с новой нераспавшейся молекулой хлора:
Третья стадия. Обрыв цепи.
При протекании цепного процесса рано или поздно радикалы сталкиваются с радикалами, образуя молекулы, радикальный процесс обрывается.
Могут столкнуться как одинаковые, так и разные радикалы, в том числе два метильных радикала:
1.2. Нитрование метана
Метан взаимодействует с разбавленной азотной кислотой по радикальному механизму, при нагревании до 140 о С и под давлением. Атом водорода в метане замещается на нитрогруппу NO2.
| Например. При нитровании метана образуется преимущественно нитрометан: Видео:Органическая Химия — ЭТО НУЖНО ВИДЕТЬ! Гибридизация орбиталейСкачать  2. Реакции разложения метана (д егидрирование, пиролиз)При медленном и длительном нагревании до 1500 о С метан разлагается до простых веществ: Если процесс нагревания метана проводить очень быстро (примерно 0,01 с), то происходит межмолекулярное дегидрирование и образуется ацетилен: Пиролиз метана – промышленный способ получения ацетилена. Видео:СТРОЕНИЕ АТОМА ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать  3. Окисление метанаАлканы – малополярные соединения, поэтому при обычных условиях они не окисляются даже сильными окислителями (перманганат калия, хромат или дихромат калия и др.). 3.1. Полное окисление – горениеАлканы горят с образованием углекислого газа и воды. Реакция горения алканов сопровождается выделением большого количества теплоты. Уравнение сгорания алканов в общем виде: При горении алканов в недостатке кислорода может образоваться угарный газ СО или сажа С. Промышленное значение имеет реакция окисления метана кислородом до простого вещества – углерода: Эта реакция используется для получения сажи. 3.2. Каталитическое окисление
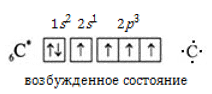
Продукт реакции – так называемый «синтез-газ». Видео:Характеристика элемента по положению в Периодической системе и строению атома. 1 часть. 8 класс.Скачать  Получение метанаВидео:БЕЗ ЭТОГО НЕ СДАТЬ ЕГЭ по Химии — Электронная конфигурация атомаСкачать  1. Взаимодействие галогеналканов с металлическим натрием (реакция Вюрца)Это один из лабораторных способов получения алканов. При этом происходит удвоение углеродного скелета. Реакция больше подходит для получения симметричных алканов. Получить таким образом метан нельзя. Видео:ОКСИДЫ, КИСЛОТЫ, СОЛИ И ОСНОВАНИЯ ХИМИЯ 8 класс / Подготовка к ЕГЭ по Химии - INTENSIVСкачать  2. Водный или кислотный гидролиз карбида алюминияЭтот способ получения используется в лаборатории для получения метана. Видео:Типы гибридизации атома углерода | Химия ЕГЭ 10 класс | УмскулСкачать  3. Декарбоксилирование солей карбоновых кислот (реакция Дюма)Реакция Дюма — это взаимодействие солей карбоновых кислот с щелочами при сплавлении. R–COONa + NaOH → R–H + Na2CO3 Декарбоксилирование — это отщепление (элиминирование) молекулы углекислого газа из карбоксильной группы (-COOH) или органической кислоты или карбоксилатной группы (-COOMe) соли органической кислоты. При взаимодействии ацетата натрия с гидроксидом натрия при сплавлении образуется метан и карбонат натрия: Видео:Орбитальная модель молекулы метанаСкачать  4. Синтез Фишера-ТропшаИз синтез-газа (смесь угарного газа и водорода) при определенных условиях (катализатор, температура и давление) можно получить различные углеводороды: Это промышленный процесс получения алканов. Синтезом Фишера-Тропша можно получить метан: Видео:Видео №1. Строение молекулы этена.Скачать  5. Получение метана в промышленностиВ промышленности метан получают из нефти, каменного угля, природного и попутного газа . При переработке нефти используют ректификацию, крекинг и другие способы. Видео:Химия 10 класс (Урок№2 - Предельные углеводороды — алканы.)Скачать  Электронное и пространственное строение молекулы метана (10 класс)Обращаем Ваше внимание, что в соответствии с Федеральным законом N 273-ФЗ «Об образовании в Российской Федерации» в организациях, осуществляющих образовательную деятельность, организовывается обучение и воспитание обучающихся с ОВЗ как совместно с другими обучающимися, так и в отдельных классах или группах. Описание презентации по отдельным слайдам:Лекция по органической химии для 10 класса: «ЭЛЕКТРОННОЕ И ПРОСТРАНСТВЕННОЕ СТРОЕНИЕ МОЛЕКУЛЫ МЕТАНА» Метан относится к предельным углеводородам – алканам (парафинам) В обычных условиях алканы мало реакционноспособны, откуда возникло их название «парафины» – от лат. parrum affinis – малоактивный. общая формула — CnH2n+2 Молекулярная формула CH4 (качественный, количественный состав) электронная формула (ковалентная полярная связь) структурная формула (порядок соединения атомов в молекуле) Молекула метана в действительности имеет форму тетраэдра. Почему молекула метана имеет такую пространственную форму? Чем объясняется направление валентных связей атома углерода от центра к вершинам тетраэдра? невозбужденное состояние 1s22s22p2 возбужденное состояние 1s22s12p3 Формы s- и p- орбиталей Sp3 — гибридизация и молекула метана Модель sp3- гибридного состояния электронной оболочки атома углерода. Схема электронного строения молекулы метана Полусферическая модель Стюарта – Бриглеба, Масштабная модель Шаростержневая модель Вывод: Итак, молекула метана имеет тетраэдрическое строение, что обусловлено SP3-гибридизацией атома углерода, тетраэдрическим направлением четырёх гибридных электронных облаков атома углерода. Название веществаМолекулярная формула (качественный, количественный состав)Структурная формула (порядок соединения атомов в молекуле) Электронная формула (ковалентная полярная связь)Пространственная формула (расположение гибридных облаков в пространстве) МетанСН4 Проверка усвоения темы : 1. Укажите ошибочное определение метана: а) предельный углеводород; б) карбоциклическое соединение; в) насыщенные углеводороды; г) парафиновые углеводороды. 2. Общая формула метана: а) СnH2n; б) СnH2n+1; в) СnH2n+2; г) СnН2n-2. 3. Признаки, характеризующие строение метана: а) SP3-гибридизация, плоская форма молекул, угол — 120о σ и π-связи; б) SP-гибридизация, линейная форма молекул, угол 180о, σ и π-связи; в) SP3-гибридизация, пространственная форма молекул, угол 109о28′ , σ -связи. 4. Невозбуждённый атом углерода имеет электронную конфигурацию: а) 1S22S12P3; б) 1S22S22P2; в) 1S22S22P3; г) 1S22S22P4. 5. Возбужденный атом углерода имеет электронную конфигурацию: а) 1S22S22P3; б) 1S22S22P2; в) 1S22S22P4; г) 1S22S12P3. 6. Какой фигурой отражено пространственное строение метана: а)Куб; б)Октаэдр в)Тетраэдр г)Призма 7. Тип химической связи в молекуле метана: а)Ионная; б)Ковалентная полярная; в)Водородная; г)Ковалентная неполярная. Курс повышения квалификации Дистанционное обучение как современный формат преподавания
Курс повышения квалификации Инструменты онлайн-обучения на примере программ Zoom, Skype, Microsoft Teams, Bandicam
Курс повышения квалификации Педагогическая деятельность в контексте профессионального стандарта педагога и ФГОС
Ищем педагогов в команду «Инфоурок» Видео:Составление формул органических соединений по названиюСкачать  Дистанционные курсы для педагогов«Взбодрись! Нейрогимнастика для успешной учёбы и комфортной жизни» Свидетельство и скидка на обучение каждому участнику Найдите материал к любому уроку, указав свой предмет (категорию), класс, учебник и тему:5 593 336 материалов в базе Самые массовые международные дистанционные Школьные Инфоконкурсы 2022 33 конкурса для учеников 1–11 классов и дошкольников от проекта «Инфоурок» «Психологические методы развития навыков эффективного общения и чтения на английском языке у младших школьников» Свидетельство и скидка на обучение каждому участнику Другие материалы
Вам будут интересны эти курсы:Оставьте свой комментарийАвторизуйтесь, чтобы задавать вопросы. Добавить в избранное
Настоящий материал опубликован пользователем Соколова Анна Николаевна. Инфоурок является информационным посредником и предоставляет пользователям возможность размещать на сайте методические материалы. Всю ответственность за опубликованные материалы, содержащиеся в них сведения, а также за соблюдение авторских прав несут пользователи, загрузившие материал на сайт Если Вы считаете, что материал нарушает авторские права либо по каким-то другим причинам должен быть удален с сайта, Вы можете оставить жалобу на материал. Автор материала
Московский институт профессиональной Видео:Химические свойства метана.Скачать  Дистанционные курсы |
| Наименование параметра: | Значение: |
| Цвет | без цвета |
| Запах | без запаха |
| Вкус | без вкуса |
| Агрегатное состояние (при 20 °C и атмосферном давлении 1 атм.) | газ |
| Плотность (при 20 °C и атмосферном давлении 1 атм.), кг/м3 | 0,6682 |
| Плотность (при 0 °C и атмосферном давлении 1 атм.), кг/м3 | 0,7168 |
| Плотность (при -164,6 °C и атмосферном давлении 1 атм.), кг/м3 | 415 |
| Температура плавления, °C | -182,49 |
| Температура кипения, °C | -161,58 |
| Температура самовоспламенения, °C | 537,8 |
| Критическая температура*, °C | -82,4 |
| Критическое давление, МПа | 4,58 |
| Критический удельный объём, м3/кг | 0,0062 |
| Взрывоопасные концентрации смеси газа с воздухом, % объёмных | от 4,4 до 17,0 |
| Удельная теплота сгорания, МДж/кг | 50,1 |
| Коэффициент теплопроводности (при 0 °C и атмосферном давлении 1 атм.), Вт/(м·К) | 0,0302 |
| Коэффициент теплопроводности (при 50 °C и атмосферном давлении 1 атм.), Вт/(м·К) | 0,0361 |
| Молярная масса, г/моль | 16,04 |
| Растворимость в воде, г/кг | 0,02 |
* при температуре выше критической температуры газ невозможно сконденсировать ни при каком давлении.
Видео:Как строить структурные формулы быстро, как ФЛЭШ — Мое полное РуководствоСкачать

Химические свойства
Так как углерод в метане задействует все свободные валентности и молекула максимально насыщена атомами водорода, метан характеризуется слабой химической активностью. В стандартных условиях он не вступает во взаимодействие с щелочами, сильными кислотами, галогенами (за исключением фтора) и щелочными металлами.
Метан участвует в нескольких типах реакций, которые всегда протекают с разрушением углерод-водородных связей 
- Свободно-радикальное замещение:
- Окисление:
- Разложение метана. Наиболее распространенным методом разложения является крекинг, широко используемый в нефтепереработке:
В процессе крекинга происходит разрушение тройной связи в молекуле ацетилена, и среди конечных продуктов реакции присутствуют различные углеводороды.
Метан в природе
В естественных условиях метан имеет несколько источников:
- природный газ и попутные нефтяные газы, в составе которых метан является главным компонентом;
- рудничный газ, поступающий из угольных пластов и образующий с воздухом взрывоопасную смесь;
- вулканические газы;
- продукты обмена веществ некоторых анаэробных микроорганизмов, перерабатывающих клетчатку и обитающих в болотах, стоячих водоемах, в пищеварительном тракте жвачных животных.
Метан способен в больших количествах накапливаться в газогидратной форме в многолетней мерзлоте и на океанском дне. В составе метангидрата молекула 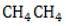
За пределами Земли метан в большом количестве обнаружен на спутнике Сатурна Титане, в атмосферах планет-гигантов и Марса.
Получение метана
В промышленности метан, как правило, не синтезируют искусственно, а выделяют при переработке нефти, нефтепродуктов, очистке природного газа, коксовании каменного угля. В этих процессах метан является продуктом следующих реакций:
Лабораторный синтез метана проводится двумя основными способами:
Области применения
Сфера использования метана включает различные отрасли. Он применяется и как конечный продукт, и в качестве сырья для производства других веществ.
Топливо
Наиболее широко газ используется как дешевый горючий материал в таких областях, как:
- автомобильный транспорт;
- некоторые системы ракетных двигателей (жидкий очищенный метан);
- электроэнергетика (топливо для газовых турбин).
Металлообработка
При горении метана в кислороде развивается температура от 2400 до 2700 °C, поэтому он пригоден для сварки и пайки легкоплавких металлов и сплавов – чугуна, меди, латуни, алюминия. Также он используется как заменитель ацетилена и пропан-бутановой смеси при кислородной резке металлов.
Бытовое применение метана
Во многих регионах метан широко применяется в отопительных системах. Городские сети снабжают значительную часть населения природным газом для кухонных плит.
Метан как химическое сырье
Большую роль метан играет в качестве реагента в процессах синтеза соединений, используемых в разных областях:
- топливная промышленность (получение синтетического бензина);
- производство органических красителей и растворителей;
- производство ацетилена;
- медицина и биология (получение формальдегида – консерванта для биоматериалов).
Вред и польза метана
Вследствие малой растворимости и слабой химической активности метан нетоксичен, однако длительное пребывание в среде с повышенной концентрацией газа негативно отражается на нервной системе. Если содержание его в воздухе превышает 25%, человек может пострадать от кислородного голодания.
Как сильный парниковый газ, метан оказывает влияние на климат. Несмотря на малую концентрацию в атмосфере, по вкладу в парниковый эффект он занимает третье место после водяного пара и углекислого газа. Парниковое действие метана приблизительно в 25 раз превышает эффект, оказываемый тем же молярным объемом углекислого газа.
Метан обладает полезными свойствами. При полном сгорании он не образует твердых продуктов, загрязняющих внутренние части оборудования и окружающую среду. В сочетании с дешевизной это качество расширяет перспективы использования метана как экономичного и чистого топлива.






















 , то есть молекула его образована одним атомом углерода с валентностью IV и четырьмя водородными атомами. На понимании того, как строится эта молекула, основано дальнейшее изучение всех органических соединений.
, то есть молекула его образована одним атомом углерода с валентностью IV и четырьмя водородными атомами. На понимании того, как строится эта молекула, основано дальнейшее изучение всех органических соединений.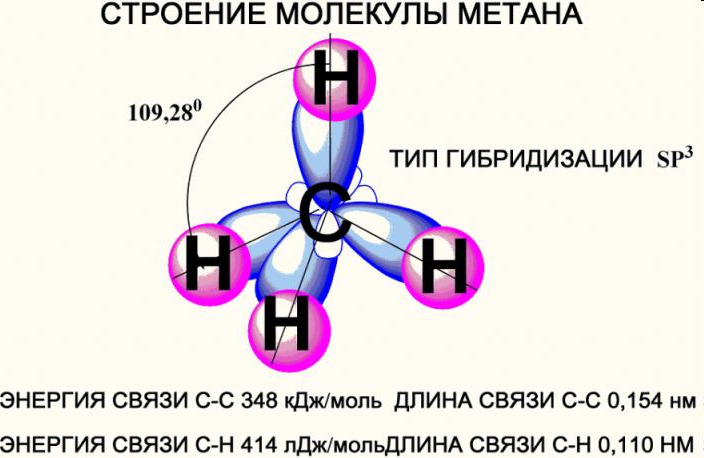
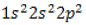
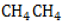 имеет тетраэдрическую форму.
имеет тетраэдрическую форму.


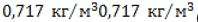 (легче воздуха). Основные свойства приведены в таблице.
(легче воздуха). Основные свойства приведены в таблице.





