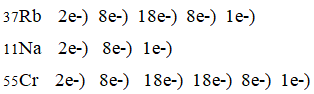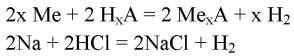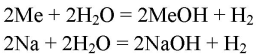- Химические свойства металлов
- Удельный вес и температура плавления некоторых металлов
- Почему типичные металлы восстановители
- Вытеснение металлов из соединений металлами
- Определения положения водорода в вытеснительном ряду
- Электрохимический ряд напряжений
- Похожие страницы:
- Leave a Comment
- Вопросы к параграфу 43 — ГДЗ по Химии 9 класс Учебник Рудзитис, Фельдман
- § 43. Щелочные металлы
- Вопросы и задания
- 1. Начертите схему строения атома рубидия Rb. Сравните её со схемами строения атомов натрия и цезия.
- 2. Почему все щелочные металлы — сильные восстановители?
- 3. Сравните реакции щелочных металлов с водой и с кислотами. Составьте уравнения соответствующих реакций и покажите переход электронов.
- Почему все металлы являются восстановителями?
- Как понять, какой из металлов является более сильным восстановителем?
- Напишите электронные формулы хрома и алюминия?
- Допишите уравнения реакций взаимодействия кислот с металлами, составьте окислительно — восстановительный баланс, укажите какое вещество является окислителем, какое восстановителем?
- Какой металл магний или маргонец более сильный восстановитель?
- Неметаллы в реакции с металлами могут проявлять свойства 1?
- Почему атомы металлов в химических реакциях являются востановителями?
- Какой из металлов является более сильным восстановителем натрий, магний или алюминий?
- Язот является восстановителем в реакции с водородом или окислителем?
- Металлы это окисление или восстановитель, ответ объяснить?
- Как объяснить то что водород являющийся преимущественно восстановителем при взаимодействии со щелочными и щелочноземельными металлами выступает в качестве окислителя?
- 🎦 Видео
Видео:ОВР и Метод Электронного Баланса — Быстрая Подготовка к ЕГЭ по ХимииСкачать

Химические свойства металлов
Основным химическим свойством металлов является способность их атомов легко отдавать свои валентные электроны и переходить в положительно заряженные ионы.
Типичные металлы никогда не присоединяют электронов; их ионы всегда заряжены только положительно. Поэтому металлы называются «электроположительными» элементами, в отличие от «электроотрицательных» элементов — металлоидов, для которых более характерна способность при соединять электроны.
Удельный вес и температура плавления некоторых металлов
| Название | Атомный |
вес
вес
в °С
Почему типичные металлы восстановители
Легко отдавая при химических реакциях свои валентные электроны, типичные металлы являются энергичными восстановителями.
Способность к отдаче электронов проявляется у отдельных металлов далеко не в одинаковой степени. Чем легче металл отдает свои электроны, тем он активнее, тем энергичнее вступает во взаимодействие с другими веществами.
Для сравнительного изучения активности металлов можно воспользоваться различными реакциями. Особенно удобны для этой цели реакции вытеснения металлов из их солей другими металлами. Опустим, например, кусочек цинка в раствор какой-нибудь свинцовой соли. Цинк начинает растворяться, а из раствора выделяется свинец. Реакция выражается уравнением
или в ионной форме
Zn + Pb •• = Pb + Zn ••
Из уравнения видно, что эта реакция является типичной реакцией окисления-восстановления. Сущность ее сводится к тому, что атомы цинка отдают свои валентные электроны ионам Рb •• , тем самым превращаясь в ионы Zn •• , а ионы Рb •• разряжаются и выделяются в виде металлического свинца. Если поступить наоборот, т. е погрузить кусочек свинца в раствор цинковой соли, то никакой реакции не произойдет. Это показывает, что цинк более активен, чем свинец, что его атомы легче отдают, а ионы труднее присоединяют электроны, чем атомы и ионы свинца.
Сравнивая таким же способом активность свинца и меди, легко убедиться, что свинец более активен, чем медь, так как он вытесняет медь из ее солей, а медь не может вытеснять свинец:
Рb + Cu •• = Сu + Рb ••
Следовательно, из трех сравниваемых металлов — цинка, свинца и меди — наиболее активным, легче других отдающим электроны, является цинк, менее активен свинец и еще менее активна медь.
Вытеснение металлов из соединений металлами
Вытеснение одних металлов из их соединений другими металлами впервые было подробно изучено Н. Н. Бекетовым (1865 г.), расположившим металлы по их убывающей химической активности в так называемый «вытеснительный ряд». В настоящее время вытеснительный ряд Бекетова носит название ряда напряжений, так как положение каждого металла в ряду точно определяется величиной электрического напряжения, или разности потенциалов, возникающей при погружении данного металла в раствор его соли. Об измерении этих величин и их значении будет сказано несколько позже.
Для наиболее важных металлов ряд напряжений, как уже было указано , имеет следующий вид:
Уменьшение химической активности нейтральных атомов
К, Na, Са, Mg, Al, Mn, Zn, Fe, Ni, Sn, Pb, H2, Cu, Hg, Ag, Au
Уменьшение способности ионов к присоединению электронов
В этом ряду помещен и водород, так как он тоже может вытеснять некоторые металлы из растворов их солей и в свою очередь вытесняется многими металлами из растворов кислот.
Определения положения водорода в вытеснительном ряду
Для определения положения водорода в «вытеснительном ряду» Бекетовым производились следующие опыты. В колена изогнутой стеклянной трубки (рис.) помещали отдельно друг от друга раствор соли металла, кислоту и цинк. Трубку запаивали» затем наклоняли ее так, что цинк падал в кислоту и выделяющийся водород действовал под давлением на раствор соли.
Наблюдая явления, происходящие в колене трубки, наполненном раствором соли, можно было судить о том, вытесняется ли металл водородом. На основании проведенных опытов Бекетов пришел к заключению, что в «вытеснительном ряду» водород занимает место после свинца и может вытеснять(восстанавливать) следующие за ним металлы: медь, ртуть, серебро, золото из растворов их солей.
Бекетов был убежден, что реакции вытеснения водорода металлами являются обратимыми и что для каждого металла должно существовать такое давление, при котором направление реакции меняется на обратное, т. е. водород начинает вытеснять металл из раствора его соли.
Взгляды Бекетова получили позднее полное подтверждение.
Рассмотрим, например, реакцию вытеснения водорода цинком:
Константа равновесия этой реакции выражается следующей формулой:
где вместо концентрации водорода взято его давление рн2 в атмосферах. Вычисление показывает, что при обычной температуре К = 36 • 10 24 . Значит, потребовалось бы недостижимое при современной технике давление водорода, чтобы сделать ощутимой обратную реакцию, т. е. вытеснение цинка водородом. При обычном же давлении равновесие реакции практически нацело смещено вправо.
Однако для реакции
Sn + 2H • ⇄ Sn •• + H2
Это значит, что равновесие будет достигнуто, например, при концентрациях: [Sn •• ]= l г-ион/л,[Н • ] = 0,01 г-ион/л и давлении водорода рн2 = 4 ат. Следовательно, при сравнительно небольшом давлении водород может вытеснить олово из раствора его соли.
Электрохимический ряд напряжений
Ряд напряжений дает много общих указаний относительно химического поведения отдельных металлов при реакциях в растворах:
- Каждый металл этого ряда, а также и водород, находящийся под давлением, вытесняет (восстанавливает) все следующие за ним металлы из растворов их солей. В свою очередь сам он может быть вытеснен (восстановлен) любым из металлов, стоящих впереди него.
- Только те металлы, которые стоят в ряду напряжений впереди водорода, могут вытеснять его из разбавленных кислот («солей водорода»). Металлы, стоящие вправо от водорода, не способны вытеснять водород из кислот.
- Чем левее в ряду напряжений стоит металл, тем он активнее, тем больше его восстановительная способность в отношении ионов других металлов, тем легче он сам превращается в ионы, тем труднее восстанавливаются его ионы.
Вы читаете, статья на тему Химические свойства металлов
Похожие страницы:
Понравилась статья поделись ей
Leave a Comment
Для отправки комментария вам необходимо авторизоваться.
Видео:Химические свойства металлов. 9 класс.Скачать

Вопросы к параграфу 43 — ГДЗ по Химии 9 класс Учебник Рудзитис, Фельдман
Авторы: Рудзитис Г.Е., Фельдман Ф.Г.
Видео:8 класс. ОВР. Окислительно-восстановительные реакции.Скачать

§ 43. Щелочные металлы
Вопросы и задания
1. Начертите схему строения атома рубидия Rb. Сравните её со схемами строения атомов натрия и цезия.
Щелочные металлы имеют схожее строение. На внешнем энергетическом уровне у них один электрон.
2. Почему все щелочные металлы — сильные восстановители?
Все щелочные металлы — сильные восстановители, потому что на внешнем энергетическом уровне у них по одному электрону, который находится на удалении от ядер. Щелочные металлы легко отдают этот электрон, следовательно являются сильными восстановителями.
3. Сравните реакции щелочных металлов с водой и с кислотами. Составьте уравнения соответствующих реакций и покажите переход электронов.
Формула реакций щелочных металлов с кислотами:
где Me — щелочной металл
HxA — кислота (х — основность кислоты, A — кислотный остаток)
Формула реакций щелочных металлов с водой с образованием щёлочи:
В обеих реакциях металл — восстановитель: Me-1е=Me
Видео:Типы Химических Реакций — Химия // Урок Химии 8 КлассСкачать

Почему все металлы являются восстановителями?
Химия | 5 — 9 классы
Почему все металлы являются восстановителями?
Все щелочные металлы имеют один s — электрон на внешнем электронном слое.
Отдают электроны и окисляются.
Видео:Типичные реакции оснований | Химия 8 класс #46 | ИнфоурокСкачать

Как понять, какой из металлов является более сильным восстановителем?
Как понять, какой из металлов является более сильным восстановителем?
Например почему стронций является более сильным восстановителем, чем кальций?
Видео:Общая характеристика металлов. 9 класс.Скачать

Напишите электронные формулы хрома и алюминия?
Напишите электронные формулы хрома и алюминия.
Какой из этих металлов является более сильным восстановителем?
Видео:Окислительно-восстановительные реакции с нуля!| Екатерина Строганова | 100балльный репетиторСкачать

Допишите уравнения реакций взаимодействия кислот с металлами, составьте окислительно — восстановительный баланс, укажите какое вещество является окислителем, какое восстановителем?
Допишите уравнения реакций взаимодействия кислот с металлами, составьте окислительно — восстановительный баланс, укажите какое вещество является окислителем, какое восстановителем.
Кислота азотная конц.
Видео:Тема 1.6 Металлы и неметаллыСкачать

Какой металл магний или маргонец более сильный восстановитель?
Какой металл магний или маргонец более сильный восстановитель.
Видео:Общая характеристика металлов. Видеоурок 8. Химия 9 классСкачать

Неметаллы в реакции с металлами могут проявлять свойства 1?
Неметаллы в реакции с металлами могут проявлять свойства 1.
Как окислителей, так и восстановителей 2.
Только окислителей 3.
Только восстановителей 4.
Реакции не являются окислительно — восстановительными.
Видео:Положение металлов в Периодической системе и строение их атомов | Химия 9 класс #8 | ИнфоурокСкачать

Почему атомы металлов в химических реакциях являются востановителями?
Почему атомы металлов в химических реакциях являются востановителями.
Видео:3. КАК МЕТАЛЛЫ РЕАГИРУЮТ С ОСНОВАНИЯМИ/ Нужно знать/ ЕГЭ химия 2020Скачать

Какой из металлов является более сильным восстановителем натрий, магний или алюминий?
Какой из металлов является более сильным восстановителем натрий, магний или алюминий?
Видео:Все реакции с металлами за 1 урок | ЕГЭ по химии 2024 | Екатерина СтрогановаСкачать

Язот является восстановителем в реакции с водородом или окислителем?
Язот является восстановителем в реакции с водородом или окислителем?
Видео:66. Окислительно-восстановительные реакции.Скачать

Металлы это окисление или восстановитель, ответ объяснить?
Металлы это окисление или восстановитель, ответ объяснить.
Видео:Химия | Окислительно-восстановительные реакцииСкачать

Как объяснить то что водород являющийся преимущественно восстановителем при взаимодействии со щелочными и щелочноземельными металлами выступает в качестве окислителя?
Как объяснить то что водород являющийся преимущественно восстановителем при взаимодействии со щелочными и щелочноземельными металлами выступает в качестве окислителя?
На странице вопроса Почему все металлы являются восстановителями? из категории Химия вы найдете ответ для уровня учащихся 5 — 9 классов. Если полученный ответ не устраивает и нужно расшить круг поиска, используйте удобную поисковую систему сайта. Можно также ознакомиться с похожими вопросами и ответами других пользователей в этой же категории или создать новый вопрос. Возможно, вам будет полезной информация, оставленная пользователями в комментариях, где можно обсудить тему с помощью обратной связи.
Opa dz seve 1 nomer : D zzzzzzzzzzzzzzzzzzzzzzzzzzzzzzzzzzzzzzzzzzzzzzzzzzzzzz.
FeCl2 + K2Co3 = Fe(Co3) + 2KCl AlCl3 + 3NaOH = Al(OH)3 + 3NaCl AgNo3 + HCl = AgCl + HNo3 CuCl2 + K2S = CuS + 2KCl.
Нуклоны — общее название для протонов и нейронов.
Структурные формулы есть на фотографии.
Дано : D (СnH2n) по Н₂ = 21 общая формула алкенов — СnH2n M(СnH2n) = 14 n D (СnH2n) по Н₂ = M(СnH2n) / M(Н₂) M(СnH2n) = 21 * 2 = 42 г / моль 14n = 42 n = 3 C₃H₆ CH₃ — CH = CH₂ — пропен.
А) 4 — метилпентин — 2 б) 3 — метилпентен — 1 в) 3 — метилбутин — 1.
—так как кислород тяжелее воздуха, то для того, чтобы перелить из одного сосуда в другой кислород, необходимо сосуд с кислородом расположить сверху, а пустой — снизу.
Cr хром 1s ^ 2, 2s ^ 2, 2p ^ 6, 3s ^ 2, 3p ^ 6, 3d ^ 4, 4s ^ 2.
Пишем реакцию 2Al + 3Cl2 = 2AlCl3 По уравнению реакции n(Cl2) = 3 / 2n(Al) = 3 / 2 * 0. 24 = 0. 36 моль Считаем объем хлора V = n * Vm = 0. 36 * 22. 4 = 8. 064 л.
🎦 Видео
ВСЁ О БЕСКОРПУСНЫХ КМ КОНДЕСАТОРАХ СОДЕРЖАЩИХ ПЛАТИНУ И ПАЛЛАДИЙСкачать

Химия 11 класс (Урок№10 - Общая характеристика и способы получения металлов.)Скачать

Все ОВР с соединениями металлов для ЕГЭ по химии 2022Скачать

Решаем задания на ОВР | ЕГЭ по химииСкачать

ВСЯ ХИМИЯ С НУЛЯ! | Денис Марков | УмскулСкачать

89. Металлы I и II группы. СвойстваСкачать