Тренировочный вариант №1 ЕГЭ по химии Статград-2022 от 21 сентября 2021 года, вариант ХИ2110101 с ответами и решениями.
| Для выполнения заданий 1–3 используйте следующий ряд химических элементов. Ответом в заданиях 1–3 является последовательность цифр, под которыми указаны химические элементы в данном ряду. 1) Mg 2) S 3) Si 4) Fe 5) F |
1. Определите, какие из указанных элементов имеют на внешнем уровне больше s-электронов, чем p-электронов (в основном состоянии)? Запишите номера выбранных элементов.
2. Из указанных в ряду химических элементов выберите три p-элемента. Расположите выбранные элементы их в порядке увеличения их электроотрицательности. Запишите номера выбранных элементов в нужной последовательности.
3. Из указанного ряда выберите два элемента, которые в соединениях могут проявлять степень окисления +6. Запишите номера выбранных элементов.
4.Из предложенного перечня выберите два вещества ионного строения, в которых нет ковалентных связей.
1) NH4Cl
2) Li2O
3) NaNO3
4) H2O2
5) BaBr2
Запишите номера выбранных ответов.
5. Среди предложенных формул веществ, расположенных в пронумерованных ячейках, выберите формулы:
А) кислотного оксида; Б) средней соли; В) одноосновной кислоты.
Запишите в поле ответа выбранные цифры в нужной последовательности.
6. В двух пробирках находился порошок серы. В первую пробирку добавили концентрированный раствор вещества Х, и пробирку нагревали до завершения реакции, во вторую пробирку прилили концентрированный раствор вещества Y. В обеих пробирках порошок растворился, но в первой пробирке газ выделился, а во второй – нет.
Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанные реакции.
Запишите в поле ответа выбранные цифры в нужной последовательности.
7. Установите соответствие между веществом и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ВЕЩЕСТВО | РЕАГЕНТЫ |
| А) Si | 1) H2, S, NaCl |
| Б) Be | 2) Cl2, Mg, NaOH |
| В) Ag2O | 3) O2, HCl, KOH |
| Г) (NH4)2CO3 | 4) CaCl2, KOH, HCl |
| 5) H2, CO, HNO3 |
Запишите в поле ответа выбранные цифры в нужной последовательности.
8. Установите соответствие между исходными веществами, вступающими в реакцию, и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ИСХОДНЫЕ ВЕЩЕСТВА | ПРОДУКТЫ РЕАКЦИИ |
| А) Al + KOH + H2O | 1) KAlO2 + H2 |
| Б) Al(NO3)3 + K2CO3 + H2O | 2) KAlO2 + CO2 |
| В) Al2O3(тв) + K2CO3(тв) | 3) K[Al(OH)4] + H2 |
| Г) KNO3 + Al + KOH + H2O | 4) K[Al(OH)4] + NH3 |
| 5) K[Al(OH)4] + CO2 | |
| 6) Al(OH)3 + KNO3 + CO2 |
Запишите в поле ответа выбранные цифры в нужной последовательности.
9. Задана следующая схема превращений веществ:
Определите, какие из указанных веществ являются веществами X и Y.
1) C
2) CO
3) CO2
4) NaCl
5) NaOH
Запишите в поле ответа номера выбранных веществ в нужной последовательности.
10. Установите соответствие между структурной формулой вещества и классом/группой органических соединений, к которому(-ой) вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| СТРУКТУРНАЯ ФОРМУЛА ВЕЩЕСТВА | КЛАСС/ГРУППА ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ |
 4) сложные эфиры |
Запишите в поле ответа выбранные цифры в нужной последовательности.
11. Из предложенного перечня выберите два вещества, в составе которых только один атом углерода находится в sp 2 -гибридном состоянии.
Запишите номера выбранных ответов.
12. Из предложенного перечня выберите все вещества, которые реагируют как с пропеном, так и с этаналем.
Запишите номера выбранных ответов.
13. Из предложенного перечня выберите два углевода, которые реагируют с аммиачным раствором оксида серебра.
Запишите номера выбранных ответов.
14. Установите соответствие между схемой реакции и веществом Х, принимающим в ней участие: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| СХЕМА РЕАКЦИИ | ВЕЩЕСТВО Х |
 | 1) CH3CH2CH=CH2 |
Запишите в поле ответа выбранные цифры в нужной последовательности.
15. Установите соответствие между реагирующими веществами и продуктом, который образуется при взаимодействии этих веществ: к каждой позиции,
обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| РЕАГИРУЮЩИЕ ВЕЩЕСТВА | ПРОДУКТ ВЗАИМОДЕЙСТВИЯ |
| А) бензойная кислота и этанол (в присутствии серной кислоты) Б) бензол и ацетилхлорид (в присутствии хлорида алюминия) В) пропанол-2 и серная кислота (при нагревании) Г) фенол и ацетилхлорид | 1) пропанол-1 2) диизопропиловый эфир 6) метилфенилкетон |
Запишите в поле ответа выбранные цифры в нужной последовательности.
16. Задана следующая схема превращений веществ:
Определите, какие из указанных веществ являются веществами X и Y.
Запишите в поле ответа выбранные цифры в нужной последовательности.
17. Из предложенного перечня выберите все реакции, которые являются окислительно-восстановительными.
1) взаимодействие бромида натрия с фосфорной кислотой при нагревании
2) взаимодействие бромида натрия с концентрированной серной кислотой
3) взаимодействие дихромата аммония с раствором гидроксида калия
4) растворение кремния в растворе гидроксида калия
5) прокаливание нитрата натрия со свинцом
Запишите номера выбранных ответов.
18. Из предложенного перечня выберите все факторы, от которых зависит скорость реакции между растворами карбоната калия и азотной кислоты.
2) давление над раствором
3) кислотность среды
4) концентрация карбонат-ионов
5) концентрация углекислого газа в растворе
Запишите номера выбранных ответов.
19. Установите соответствие между уравнением реакции и свойством, которое проявляет элемент медь в этой реакции: к каждой позиции, обозначенной
буквой, подберите соответствующую позицию, обозначенную цифрой.
| УРАВНЕНИЕ РЕАКЦИИ | СВОЙСТВО МЕДИ |
| А) 2CuCl2 + SO2 + 2H2O → 2CuCl + H2SO4 + 2HCl В) CuO + 4HCl → H2[CuCl4] + H2O | 1) является окислителем 2) является восстановителем 3) является и окислителем, и восстановителем 4) не изменяет степень окисления |
Запишите выбранные цифры в нужной последовательности.
20. Установите соответствие между формулой вещества и продуктом(-ами) электролиза водного раствора этого вещества, образовавшим(и)ся на
инертном аноде: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ФОРМУЛА ВЕЩЕСТВА | ПРОДУКТ(Ы) НА АНОДЕ |
| А) AgNO3 В) CH3COONa | 1) кислород 3) диоксид азота 4) углекислый газ и углеводород |
Запишите выбранные цифры в нужной последовательности.
| Для выполнения задания 21 используйте следующие справочные данные. Концентрация (молярная, моль/л) показывает отношение количества растворённого вещества (n) к объёму раствора (V). pH («пэ аш») – водородный показатель; величина, которая отражает концентрацию ионов водорода в растворе и используется для характеристики 21. Расположите перечисленные ниже вещества в порядке увеличения pH их одномолярных растворов (от самого кислого к самому щелочному). Запишите номера веществ в правильном порядке. 22. Установите соответствие между способом воздействия на равновесную систему и смещением химического равновесия в результате этого воздействия: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Запишите в поле ответа выбранные цифры в нужной последовательности. 23. В реакторе постоянного объёма смешали метан и пары воды. Через некоторое время установилось равновесие: (Другие процессы в системе не протекают.) Используя данные, приведённые в таблице, определите равновесную концентрацию CO (X) и исходную концентрацию паров воды (Y). Запишите в поле ответа выбранные цифры в нужной последовательности.
Выберите из списка номера правильных ответов. Запишите выбранные цифры в нужной последовательности. 24. Установите соответствие между формулой газа и качественной реакцией на этот газ: к каждой позиции, обозначенной буквой, подберите
Запишите в поле ответа выбранные цифры в нужной последовательности. 25. Установите соответствие между названием лабораторного оборудования и его применением: к каждой позиции, обозначенной буквой, подберите
Запишите в поле ответа выбранные цифры в нужной последовательности.
26. Сколько граммов 10%-го раствора серной кислоты надо добавить к 120 г 30%-го раствора этого же вещества, чтобы получить 16%-й раствор? 27. Обжиг известняка протекает в соответствии с термохимическим уравнением Определите количество теплоты (в кДж), которое потребовалось для реакции, если в результате выделилось 640 мл газа (н. у.)? (Запишите число с точностью до десятых.) 28. Из 112 кг обогащённой фосфатной руды в результате ряда превращений, происходивших со 100%-м выходом, получили 58,8 кг ортофосфорной кислоты. Считая, что руда содержит единственный фосфат – фторапатит Ca5(PO4)3F, рассчитайте его массовую долю (в %) в руде. (Запишите число с точностью до целых.)
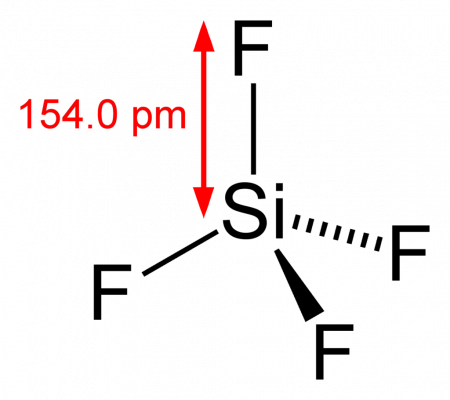
29. Из предложенного перечня выберите вещества, между которыми окислительно-восстановительная реакция протекает с образованием осадка. 1) уравнение реакции: 2) электронный баланс: 3 | S –2 – 2e → S 0 3) окислитель – KBrO3 (Br +5 ), восстановитель – (NH4)2S (S –2 ) 30. Из предложенного перечня веществ выберите вещества, которые вступают в реакцию ионного обмена с образованием осадка и газа одновременно. 31. Карбонат свинца прокалили на воздухе при высокой температуре и получили ярко-красный порошок. К нему добавили разбавленную азотную кислоту, образовавшийся тёмно-коричневый осадок отфильтровали, промыли и высушили. К фильтрату прилили раствор иодида калия, и выпал ярко-жёлтый осадок. К тёмно-коричневому веществу добавили концентрированную соляную кислоту и наблюдали выделение жёлто-зелёного газа. Напишите молекулярные уравнения четырёх описанных реакций. 32. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения: При написании уравнений реакций указывайте преимущественно образующиеся продукты, используйте структурные формулы органических 33. Смесь двух алканов, являющихся ближайшими гомологами, имеет относительную плотность по водороду 16,4. Порцию смеси массой 8,2 г полностью сожгли, а образовавшийся газ пропустили через известковое молоко, полученное тщательным перемешиванием 11,1 г гашёной извести и 300 г воды. Рассчитайте массовую долю соли в образовавшемся растворе. В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения и обозначения искомых физических величин). 1) Определён состав смеси алканов: 34. Неизвестное органическое вещество X содержит 66,4 % углерода, 5,53 % водорода и хлор. Это вещество легко реагирует со щелочами, превращаясь в одноатомный спирт, а при взаимодействии с щелочным раствором перманганата калия превращается в соль ароматической кислоты. На основании данных условия задачи: 1) Проведены необходимые вычисления, и найдена молекулярная формула вещества X: Содержание Видео:ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать  Тетрафторид кремния
Тетрафторид кремния (тетрафторсилан) — бинарное неорганическое соединение кремния и фтора с формулой SiF4, бесцветный ядовитый газ, легко гидролизуется водой, растворяется в органических растворителях. Видео:Экзо- и эндотермические реакции. Тепловой эффект химических реакций. 8 класс.Скачать  Содержание
Видео:Соединения кремния. 9 класс.Скачать  Получение
Si + 2 F2 → SiF4
SiO2 + 2 F2 → 250−400oC SiF4 + O2
Si + 4 HF → 40−100oC SiF4 + 2 H2
SiO2 + 4 HF → 250−400oC SiF4 + 2 H2O
H2[SiF6] → H2SO4 SiF4 ↑ + 2 HF
Na2[SiF6] → 600oC SiF4 ↑ + 2 NaF Видео:Получение технически чистого диоксида кремнияСкачать  Физические свойстваТетрафторид кремния — бесцветный газ, в твёрдом состоянии легко сублимируется, термически устойчив. В твёрдом состоянии образует кристаллы кубической сингонии, пространственная группа I 43m или I 23, параметры ячейки a = 0,542 нм, Z = 2. Легко гидролизуется водой, растворяется в органических растворителях. Видео:ВАЛЕНТНОСТЬ. Графические формулы веществ | Химия | TutorOnlineСкачать  Задания 28. Расчеты объемных отношений газов при химической реакции. Тепловой эффект.В результате реакции, термохимическое уравнение которой выделилось 1452 кДж теплоты. Вычислите массу образовавшейся при этом воды (в граммах). (Запишите число с точностью до целых.) Ответ: 108 Пояснение: Из уравнения реакции следует, что при образовании 2 моль воды выделяется 484 кДж теплоты. У нас же выделилось 1452 кДж теплоты. Составим пропорцию 2 моль H2O — 484 кДж x моль H2O — 1452 кДж 2 : x = 484 : 1452 x = 2 ∙ 1452 /484 = 6 т.е. n(H2O) = 6 моль, следовательно: При взаимодействии оксида серы (IV) с 5,6 л (н.у.) кислорода в соответствии с уравнением выделилось 19 кДж теплоты. Определите тепловой эффект реакции. (Запишите число с точностью до целых.) Ответ: 76 Пояснение: Рассчитаем количество вещества кислорода: Т.е. при взаимодействии 0,25 моль кислорода с оксидом серы (IV) выделяется 19 кДж теплоты. Из представленного в условии термохимического уравнения следует, что при взаимодействии 1 моль кислорода с оксидом серы выделяется количество теплоты равное Q (тепловой эффект реакции). Тогда справедлива пропорция: 0,25 моль кислорода — 19 кДж 1 моль кислорода — Q Исходя из этой пропорции: Таким образом, тепловой эффект реакции составляет 76 кДж. В соответствии с термохимическим уравнением реакции выделилось 786 кДж теплоты. Какой объем (н.у.) углекислого газа при этом образовался? (Запишите число с точностью до десятых.) Ответ: 44,8 Пояснение: В соответствии с термохимическим уравнением реакции при образовании 1 моль углекислого газа выделяется 393 кДж теплоты. В нашем же случае вместо этого выделилось 786 кДж теплоты. Обозначив искомое количество вещества углекислого газа равным х моль, можно записать пропорцию: 1 моль CO2 — 393 кДж теплоты x моль CO2 — 786 кДж теплоты Следовательно, справедливо уравнение: Решая которое получаем: Т.е. количество вещества углекислого газа при образовании которого выделяется 786 кДж теплоты составляет 2 моль. Рассчитаем объем такого количества углекислого газа при н.у.: V(CO2) = 2 моль ∙ 22,4 л/моль = 44,8 л В соответствии с термохимическим уравнением реакции выделилось 2406 кДж теплоты. Определите объем (н.у.) израсходованного кислорода в литрах. (Запишите число с точностью до десятых.) Ответ: 134,4 Пояснение: Согласно термохимическому уравнению при участии в реакции горения метана 2 моль кислорода выделяется 802 кДж теплоты. В нашем же случае выделяется количество теплоты равное 2406 кДж. Обозначив количество вещества кислорода необходимое для выделения 2406 кДж теплоты через х моль мы можем записать следующую пропорцию: 2 моль O2 — 802 кДж теплоты x моль O2 — 2406 кДж теплоты Тогда, справедливо следующее уравнение: 2 ∙ 2406 = 802 ∙ x Решая которое находим ,что: Таким образом, количество вещества кислорода равно 6 моль. Рассчитаем его объем: V(O2) = 6 ∙ 22,4 = 134,4 л. Вычислите количество теплоты, которое потребуется для получения 25 г железа согласно уравнению реакции (Запишите число с точностью до целых.) Ответ: 6 Пояснение: Рассчитаем количество вещества железа: n(Fe) = m(Fe)/M(Fe) = 25/56 = 0,4464 моль, Согласно термохимическому уравнению при образовании 2 моль металлического железа поглощается 27 кДж теплоты. Пусть количество поглощаемой в результате образования 0,4464 моль железа равно х кДж. Тогда можно записать пропорцию: 2 моль Fe — 27 кДж 0,4464 моль Fe — x кДж Следовательно, справедливо уравнение: 2 ∙ x = 0,4464 ∙ 27 Таким образом, количество теплоты, которое необходимо для получения 25 г железа равно 6 кДж. Вычислите объем сгоревшего согласно уравнению реакции ацетилена, если при этом выделилось 67,5 кДж теплоты. (Запишите число с точностью до сотых.) Ответ: 1,12 Пояснение: Согласно термохимическому уравнению при сгорании 2 моль ацетилена выделяется 2700 кДж теплоты. В нашем же случае выделилось 67,5 кДж. Пусть, количество вещества ацетилена, которое сгорело при этом равно х моль. Таким образом можно записать пропорцию: x моль — 67,5 кДж 2 ∙ 67,5 = 2700 ∙ x Таким образом, количество вещества ацетилена равно 0,05 моль. Рассчитаем его объем: V(C2H2) = 0,05 моль ∙ 22,4 л/моль = 1,12 л В результате реакции, термохимическое уравнение которой выделилось 280 кДж теплоты. Вычислите массу глюкозы, которая окислилась в результате этой реакции. (Запишите число с точностью до целых.) Ответ: 18 Согласно термохимическому уравнению при окислении 1 моль глюкозы выделяется 2800 кДж теплоты. В нашем же случае выделилось 280 кДж теплоты. Пусть количество глюкозы, которое окислилось при этом равно x моль. Тогда можно записать следующую пропорцию: 1 моль глюкозы – 2800 кДж теплоты x моль глюкозы – 280 кДж теплоты Следовательно, справедливо уравнение: 1 ∙ 280 = 2800 ∙ x Решая которое находим, что: x = 0,1 моль, т.е. количество глюкозы составляет 0,1 моль. Рассчитаем ее массу: Какое количество вещества аммиака вступает в реакцию в соответствии с термохимическим уравнением если в результате реакции выделилось 634 кДж теплоты? (Запишите число с точностью до целых.) Ответ: 2 Пояснение: Согласно термохимическому уравнению при окислении 4 моль аммиака выделяется 1268 кДж теплоты. В нашем же случае выделилось 634 кДж теплоты. Обозначим количество вещества аммиака, которое при этом окислилось как x моль. Тогда можно записать пропорцию: 4 моль аммиака – 1268 кДж x моль аммиака – 634 кДж Следовательно, справедливо уравнение: 4 ∙ 634 = 1268 ∙ x Решая которое находим, что: x = 2, т.е. количество вещества аммиака составляет 2 моль. В соответствии с термохимическим уравнением реакции получено 1400 кДж теплоты. Какая масса (в граммах) глюкозы при этом окислилась? (Запишите число с точностью до целых.) Ответ: 90 Пояснение: Согласно термохимическому уравнению при окислении 1 моль глюкозы выделяется 2800 кДж теплоты. В нашем же случае выделилось 1400 кДж теплоты. Пусть количество глюкозы, которое окислилось при этом равно x моль. Тогда можно записать следующую пропорцию: 1 моль глюкозы – 2800 кДж теплоты x моль глюкозы – 1400 кДж теплоты Следовательно, справедливо уравнение: 1 ∙ 1400 = 2800 ∙ x x = 0,5, т.е. количество вещества глюкозы для получения 1400 кДж тепла составляет 0,5 моль. Рассчитаем ее массу: В соответствии с термохимическим уравнением реакции выделилось 240 кДж теплоты. Определите массу полученного оксида магния. (Запишите число в точностью до целых.) Ответ: 16 Пояснение: Согласно термохимическому уравнению при образовании 2 моль оксида магния выделяется 1200 кДж теплоты. В нашем же случае выделилось 240 кДж теплоты. Пусть количество оксида магния, образовавшегося при этом равно x моль. Тогда можно записать пропорцию: 2 моль MgO – 1200 кДж x моль MgO – 240 кДж Следовательно, справедливо уравнение: 2 ∙ 240 = 1200 ∙ x Решая которое находим, что: x = 0,4, т.е. при выделении 240 кДж теплоты количество вещества образовавшегося оксида магния составляет 0,4 моль. Тогда его масса равна: m(MgO) = n(MgO) ∙ M(MgO) = 0,4 ∙ 40 = 16 г В ходе реакции, термохимическое уравнение которой было затрачено 450 кДж теплоты. Определите объем (н.у.) получившегося при этом газа. (Запишите число с точностью до целых.) Ответ: 56 Пояснение: Выделившийся газ – CO2. В соответствии с термохимическим уравнением при образовании одного моля CO2 поглощается 180 кДж теплоты. В нашем же случае поглощено 450 кДж теплоты. Обозначив количество вещества углекислого газа, образовавшегося при этом как x моль, можно записать следующую пропорцию: 1 моль CO2 – 180 кДж x моль CO2 – 450 кДж Следовательно, справедливо уравнение: x = 2,5, т.е. количество вещества углекислого газа составляет 2,5 моль. Рассчитаем его объем: В соответствии с термохимическим уравнением реакции образовалось 168 г железа. Какое количество теплоты при этом выделилось? (Запишите число с точностью до целых.) Ответ: 1110 Пояснение: Рассчитаем количество вещества железа с массой 168 г: n(Fe) = m(Fe)/M(Fe) = 168/56 = 3 моль, В соответствии с термохимическим уравнением реакции при образовании 9 моль металлического железа выделяется 3330 кДж. В нашем же случае образуется 3 моль железа. Обозначив количество теплоты выделившейся при этом как x кДж можно составить пропорцию: 9 моль Fe — 3330 кДж 3 моль Fe — x кДж тогда справедливо уравнение: Таким образом, количество теплоты выделяющееся при образовании 168 г металлического железа составляет 1110 кДж. Определите количество теплоты, которое выделится при взаимодействии 280 г негашеной извести с водой в соответствии с термохимическим уравнением реакции (Запишите число с точностью до целых.) Ответ: 324 Пояснение: Негашеная известь — тривиальное название оксида кальция CaO. Рассчитаем его количество вещества, зная массу: n(CaO) = 280 г/ 56 г/моль = 5 моль, В соответствии с термохимическим уравнением реакции при взаимодействии с водой 1 моль CaO выделяется количество теплоты равное 64,8 кДж. В нашем же случае в реакции принимает участие 5 моль оксида кальция, в связи с чем мы можем записать следующую пропорцию: 1 моль CaO — 64,8 кДж 5 моль CaO — x кДж Следовательно, справедливо уравнение: Решая которое находим, что: Таким образом, количество теплоты, которое выделится при взаимодействии 280 г негашеной извести водой составляет 324 кДж. В результате реакции, термохимическое уравнение которой выделилось 6620 кДж теплоты. Определите массу образовавшегося оксида железа (III). (Запишите число с точностью до целых.) Ответ: 640 Пояснение: В соответствии с термохимическим уравнением реакции при образовании 2 моль Fe2O3 выделяется 3310 кДж теплоты. В нашем же случае, выделилось 6620 кДж теплоты. Пусть количество вещества Fe2O3, образовавшегося при этом составляет x моль. Тогда можно записать следующую пропорцию: Следовательно, справедливо уравнение: 2 ∙ 6620 = x ∙ 3310 Решая которое находим, что: Таким образом, количество вещества Fe2O3 образовавшееся при этом составляет 4 моль. Следовательно масса образовавшегося Fe2O3 составляет: При образовании 560 мл (н.у.) газообразного аммиака в соответствии с уравнением выделилось 1,15 кДж теплоты. Чему равен тепловой эффект этой реакции? (Запишите число с точностью до целых.) Ответ: 92 Пояснение: Посчитаем какое количество вещества содержится в 560 мл газообразного аммиака. Прежде всего переведем его объем из мл в л: Теперь, зная, что 1 моль любого газа при н.у. занимает объем равный 22,4 л, можно рассчитать количество вещества аммиака: Из условия задания следует, что при образовании 0,025 моль (0,56 л) аммиака выделилось 1,15 кДж теплоты. В термохимическом же уравнении реакции фигурирует количество вещества аммиака равное 2 моль (коэффициент 2 перед NH3) и при этом выделяется количество тепла, равное Q (тепловой эффект реакции). Таким образом, мы можем записать следующую пропорцию: 0,025 моль — 1,15 кДж Следовательно справедливо уравнение: 0,025 ∙ Q = 2 ∙ 1,15 кДж Решая которое находим, что: Т.е. тепловой эффект реакции равен 92 кДж. В соответствии с термохимическим уравнением реакции восстановили 464 г железной окалины. Какое количество теплоты при этом выделилось? (Запишите число с точностью до целых.) Ответ: 2220 Пояснение: Рассчитаем количество вещества железной окалины массой 464 г: В соответствии с термохимическим уравнением реакции при восстановлении 3 моль Fe3O4 выделяется 3330 кДж теплоты. Пусть при восстановлении 2 моль Fe3O4 выделяется x кДж теплоты. Тогда можно составить следующую пропорцию: Следовательно, справедливо уравнение: Решая которое, получаем, что: Таким образом, количество теплоты, выделившейся при восстановлении 464 г железной окалины составляет 2220 кДж. В соответствии с термохимическим уравнением реакции выделилось 2406 кДж теплоты. Определите объем (н.у.) израсходованного кислорода. (Запишите число с точностью до десятых.) Ответ: 134,4 Пояснение: В соответствии с термохимическим уравнением реакции при реакции с метаном 2 моль кислорода выделяется 802 кДж. В нашем же случае выделилось 2406 кДж теплоты. Пусть количество вещества израсходованного при этом кислорода составляет x моль. Тогда можно записать пропорцию: 2 моль O2 – 802 кДж x моль O2 – 2406 кДж Следовательно, справедливо уравнение: 2 ∙ 2406 = 802 ∙ x Т.е. количество вещества кислорода составляет 6 моль. Найдем его объем: В соответствии с термохимическим уравнением реакции получено 422,2 кДж теплоты. Какой объем (н.у.) кислорода при этом израсходован? (Запишите число с точностью до целых.) Ответ: 24 Пояснение: В соответствии с термохимическим уравнением при израсходовании на горение угля 1 моля кислорода выделяется 393 кДж теплоты. В нашем же случае выделяется 422,2 кДж. Пусть при выделении такого количества теплоты расходуется x моль кислорода. Тогда, мы можем записать пропорцию: 1 моль O2 – 393 кДж x моль O2 – 422,2 кДж Следовательно, справедливо уравнение: 1 ∙ 422,2 = 393 ∙ x Решая которое находим, что: т.е. количество вещества израсходованного кислорода составляет 1,0743 моль. Рассчитаем его объем: Какой объем (н.у.) кислорода потребуется для получения 5600 кДж теплоты в соответствии с термохимическим уравнением реакции (Запишите число с точностью до десятых.) Ответ: 268,8 Пояснение: Исходя из термохимического уравнения: 6 моль O2 — 2800 кДж теплоты В нашем же случае должно выделиться 5600 кДж. Пусть количество вещества кислорода необходимое для выделения такого количества тепла составляет x моль. Тогда справедлива пропорция: 6 моль O2 — 2800 кДж теплоты x моль O2 — 5600 кДж теплоты Следовательно, верным является уравнение: 6 ∙ 5600 = 2800 ∙ x Таким образом, количество вещества кислорода, которое должно принять участие в окислении глюкозы для выделения 5600 кДж теплоты, составляет 12 моль. Рассчитаем объем такого количества кислорода при н.у.: При сжигании ацетилена в соответствии с термохимическим уравнением реакции выделилось 186 кДж теплоты. Какой объем (н.у.) кислорода затрачен на сжигание ацетилена? (Запишите число с точностью до десятых.) Ответ: 22,4 Пояснение: Из термохимического уравнения реакции следует, что когда в реакции принимает участие 5 моль O2 выделяется 930 кДж теплоты. В нашем же случае выделяется 186 кДж теплоты. Пусть количество вещества кислорода, израсходованного при этом, составляет x моль. Тогда мы можем записать следующую пропорцию: 5 моль O2 – 930 кДж x моль O2 – 186 кДж Следовательно, справедливо уравнение: Решая которое находим, что: Таким образом, количество вещества кислорода составляет 1 моль. Найдем его объем: В соответствии с термохимическим уравнением реакции выделилось 2580 кДж теплоты. Определите количество вещества оксида азота(IV), вступившего в реакцию. (Запишите число с точностью до целых.) Ответ: 40 Пояснение: Из термохимического уравнения реакции следует, что когда в реакции принимает участие 4 моль NO2 выделяется 258 кДж теплоты. В нашем же случае выделяется 2580 кДж теплоты. Пусть количество вещества оксида азота (IV), прореагировавшего при этом, составляет x моль. Тогда мы можем записать следующую пропорцию: 4 моль NO2 – 258 кДж x моль NO2 – 2580 кДж Следовательно, справедливо уравнение: 4 ∙ 2580 = x ∙ 258 Решая которое находим, что: Таким образом, количество вещества оксида азота (IV) составляет 40 моль. Определите объём газообразного продукта (в литрах), который получается при взаимодействии 1 л водорода с избытком хлора. Объёмы газов измерены при одинаковых условиях. (Запишите число с точностью до целых.) Ответ: 2 Пояснение: Запишем уравнение реакции взаимодействия водорода с хлором: Одним из следствий закона Авогадро является то, что объемы прореагировавших и образовавшихся газов относятся друг к другу точно так же, как и коэффициенты перед этими газообразными веществами в уравнении реакции. Для газообразных водорода и хлороводорода, применительно к нашей реакции, мы можем записать что: V(HCl) = V(H2) ∙ k(HCl)/k(H2) = 1 л ∙ 2/1 = 2 л Определите количество теплоты, которое выделяется при окислении серы кислородом взятым в объёме 100,8 л (н.у.) в соответствии с термохимическим уравнением реакции (Запишите число с точностью до целых.) Ответ: 1341 Определите количество теплоты, которое выделится при обжиге 720 г FeS2 согласно термохимическому уравнению реакции (Запишите число с точностью до целых.) Ответ: 4965 Вычислите количество выделившейся теплоты, если в реакцию вступает 3,5 моль кислорода в соответствии с термохимическим уравнением реакции (Запишите число с точностью до целых.) Ответ: 903 Какое количество теплоты выделится при взаимодействии 3,6 моль кремния с фтором в соответствии с термохимическим уравнением реакции (Запишите число с точностью до целых.) Ответ: 5814 В реакцию, термохимическое уравнение которой вступило 88 г углекислого газа. Какое количество теплоты выделится при этом? (Запишите число с точностью до целых.) 🎬 ВидеоЭлектролитическая диссоциация кислот, оснований и солей. 9 класс.Скачать  Углерод и кремний IVА группа | Химия ЕГЭ, ЦТСкачать  Составление формул соединений. 8 класс.Скачать  9 класс. Электролитическая диссоциация. Образование ионов.Скачать  Самый простой способ понять ХИМИЮ — Типы Кристаллических Решеток и Свойства ВеществаСкачать  Введение в титрование (видео 1)| Титриметрический анализ | ХимияСкачать  ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ кислот оснований и солей | Как писать УРАВНЕНИЯ ДИССОЦИАЦИЙСкачать  Установление эмпирической и молек. формул по массовым долям элем., входящих в состав в-ва. 10 класс.Скачать  ФОТОСИНТЕЗ: процесс, световая и темновая фаза | ЕГЭ биологияСкачать  Межмолекулярное взаимодействие. Самоподготовка к ЕГЭ и ЦТ по химииСкачать  Электролитическая диссоциация | Химия 8 класс #40 | ИнфоурокСкачать  Электролитическая диссоциация. Видеоурок по химии 9 классСкачать  Механизм электролитической диссоциации. 9 класс.Скачать  Это Самый Простой Урок Химии. Химия с нуля — АмфотерностьСкачать  Задание 13. Диссоциация, как писать уравнения диссоциации? | Химия ОГЭ | УмскулСкачать  | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||