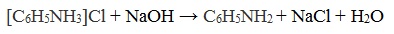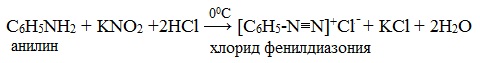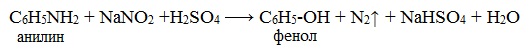- Опыт 1. Образование солей анилина
- Опыт 2. Бромирование анилина
- Опыт 4. Денатурация белка
- Опыт 6. Цветные реакции белков
- Образование солей анилина уравнение реакции
- I. Основные свойства
- II. Особые свойства анилина
- III. Окисление анилина
- IV. Диазотирование анилина
- Амины: способы получения, строение и свойства
- Строение аминов
- Классификация аминов
- Номенклатура аминов
- Изомерия аминов
- Изомерия углеродного скелета
- Изомерия положения аминогруппы
- Изомерия между типами аминов
- Физические свойства аминов
- Химические свойства аминов
- 1.1. Взаимодействие с водой
- 1.2. Взаимодействие с кислотами
- 1.3. Взаимодействие с солями
- 2. Окисление аминов
- 3. Взаимодействие с азотистой кислотой
- 4. Алкилирование аминов
- Особенности анилина
- Получение аминов
- Восстановление нитросоединений
- Алкилирование аммиака и аминов
- Гидрирование нитрилов
- Соли аминов
- 15 комментариев
- Добавить ваш
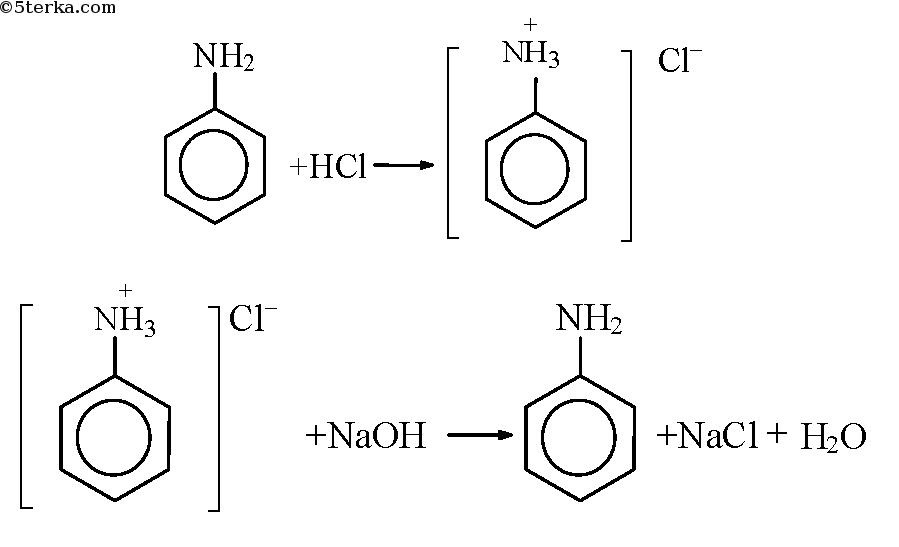
Опыт 1. Образование солей анилина
В пробирку налили чуть-чуть анилина и добавили немного воды, смесь размешали. Наблюдаем образование эмульсии. Добавили по каплям соляную кислоту до полного растворения анилина в воде. К раствору добавили немного раствора щелочи. Наблюдаем разделение раствора на две фазы.
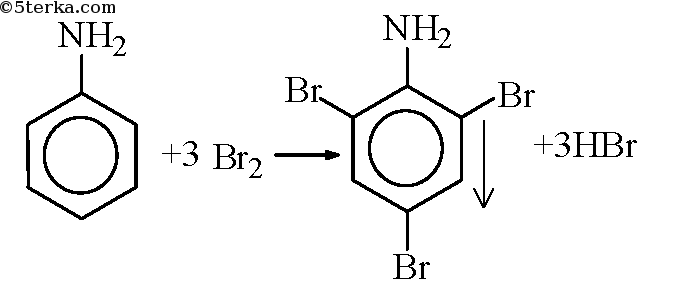
Опыт 2. Бромирование анилина
В пробирку налили чуть-чуть анилина и добавили воду. По каплям прибавляем бромную воду до выпадения белого осадка.
Опыт 3. Получение медной соли глицина
В пробирку налили 2 мл глицина и добавили немного порошка оксида меди (II). Пробирку нагрели. Наблюдаем голубое окрашивание раствора.
Опыт 4. Денатурация белка
Растворили белок куриного яйца в воде. В пробирку налили немного этого раствора и нагрели. Наблюдаем помутнение раствора — произошла денатурация. После охлаждения и разбавления раствор все равно остался мутным, т. к. денатурация — процесс необратимый.
Опыт 5. Осаждение белка солями тяжелых металлов
Опыт 6. Цветные реакции белков
а) Ксантопротеиновая реакция.
В пробирку налили немного раствора белка и прибавили несколько капель концентрированной азотной кислоты. Пробирку нагрели. Наблюдаем образование желтого осадка. Содержимое пробирки охладили и прилили раствор аммиака до щелочной реакции. Наблюдаем изменение цвета осадка на оранжевый.
б) Биуретовая реакция.
В пробирку налили немного раствора белка и добавили немного раствора гидроксида натрия и медного купороса. Наблюдаем окрашивание раствора в сине-фиолетовый цвет.

задача №7
к главе «Химический практикум».
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Образование солей анилина уравнение реакции
Для анилина характерны реакции как по аминогруппе, так и по бензольному кольцу. Особенности этих реакций обусловлены взаимным влиянием атомов.
С одной стороны, бензольное кольцо ослабляет основные свойства аминогруппы по сравнению алифатическими аминами и даже с аммиаком.
С другой стороны, под влиянием аминогруппы бензольное кольцо становится более активным в реакциях замещения, чем бензол.
I. Основные свойства
Уменьшение электронной плотности на атоме азота приводит к снижению способности отщеплять протоны от слабых кислот.
Анилин более слабое основание, чем предельные амины и аммиак.
Поэтому анилин взаимодействует лишь с сильными кислотами (HCl, H2SO4) и, в отличие от алифатических аминов и аммиака, не образует с водой гидроксида, а его водный раствор не окрашивает лакмус в синий цвет.
Анилин с водой не реагирует и не изменяет окраску индикатора.
Видеоопыт «Изучение среды раствора анилина»
Соли анилина, в отличие от анилина, хорошо растворимы в воде.
II. Особые свойства анилина
Реакции с участием аминогруппы
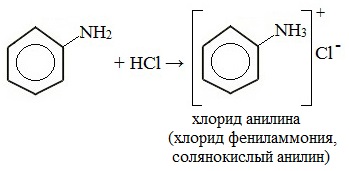
1. Взаимодействие с кислотами (образование солей)
Анилин реагирует с сильными кислотами, образуя соли фениламмония, которые растворимы в воде, но не растворимы в неполярных органических растворителях:
Видеоопыт «Взаимодействие анилина с соляной кислотой»
Анилин, который практически не растворяется в воде, можно растворить в соляной кислоте и отделить нерастворимые примеси.
Солянокислый анилин хорошо растворим в воде. Если к такому раствору добавить достаточное количество щелочи, то анилин снова выделится в свободном виде:
Реакции с участием бензольного ядра
Аминогруппа как заместитель I рода облегчает реакции замещения в бензольном ядре, при этом заместители становятся в орто- и пара-положения к аминогруппе.
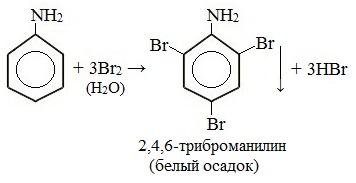
При бромировании анилин легко образует 2, 4, 6 — тризамещенные продукты реакции. По той же причине анилин легко окисляется.
1. Галогенирование
Анилин энергично реагирует с бромной водой с образованием белого осадка 2,4,6-триброманилина. Эта реакция может использоваться для качественного и количественного определения анилина:
Качественная реакция на анилин!
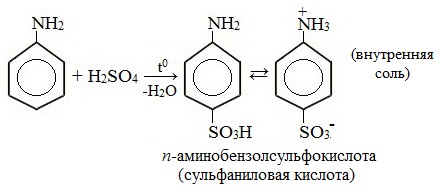
2. Сульфирование
Сульфаниловая кислота является важным промежуточным продуктом в синтезе лекарственных веществ (сульфаниламидных препаратов).
III. Окисление анилина
Анилин легко окисляется различными окислителями с образованием ряда соединений, поэтому он темнеет при хранении.
При действии хлорной извести Ca (Cl) OCl на водный раствор анилина появляется интенсивное фиолетовое окрашивание.
Качественная реакция на анилин!
Видеоопыт «Окисление анилина раствором хлорной извести – качественная реакция»
При взаимодействии анилина с хромовой известью (смесь концентрированной серной кислоты и дихромата калия К2Cr2O7) образуется черный осадок, называемый черным анилином (краситель «анилиновый черный»).
Черный анилин применяется как прочный краситель (для окраски тканей и меха в черный цвет). Обычно ткань сначала пропитывают раствором окислителя. Образующийся черный анилин откладывается в порах волокна. Он не растворим в воде и устойчив к мылу и свету.
Видеоопыт «Окисление анилина раствором дихроматом калия – получение красителей»
IV. Диазотирование анилина
Практическое значение имеет реакция взаимодействия анилина с азотистой кислотой при пониженной температуре (около 0°С). В результате этой реакции (реакции диазотирования) образуются соли диазония, которые используются в синтезе азокрасителей и ряда других соединений.
При более высокой температуре реакция идет с выделением азота и анилин превращается в фенол:
Подобно анилину реагируют с азотистой кислотой и другие первичные ароматические амины.
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Амины: способы получения, строение и свойства
Амины – это органические производные аммиака NH3, в молекуле которого один, два или три атома водорода замещены на углеводородные радикалы.
Видео:Реакция анилина с соляной кислотойСкачать

Строение аминов
Атом азота находится в состоянии sp 3 -гибридизации, поэтому молекула имеет форму тетраэдра.
Также атом азота в аминах имеет неподелённую электронную пару, поэтому амины проявляют свойства органических оснований.
Видео:Соли. Получение. 8 класс.Скачать

Классификация аминов
По количеству углеводородных радикалов, связанных с атомом азота, различают первичные, вторичные и третичные амины.
По типу радикалов амины делят на алифатические, ароматические и смешанные.
| Амины | Первичные | Вторичные | Третичные |
| Алифатические | Метиламин CH3-NH2 | Диметиламин CH3-NH-CH3 | Триметиламин (CH3)3N |
| Ароматические | Фениламин C6H5-NH2 | Дифениламин (C6H5)2NH | Трифениламин (C6H5)3N |
| Смешанные | Метилфениламин CH3-NH-C6H5 | Диметилфениламин (CH3)2N-C6H5 |
Видео:Анилин. Получение. Все 5 реакций ЕГЭ.Скачать

Номенклатура аминов
- Названия аминов образуют из названий углеводородных радикалов и суффикса амин. Различные радикалы перечисляются в алфавитном порядке.
При наличии одинаковых радикалов используют приставки ди и три.
- Первичные амины могут быть названы как производные углеводородов, в молекулах которых один или несколько атомов водорода замещены на аминогруппы -NH2.
В этом случае аминогруппа указывается в названии приставкой амино-:
| 1-Аминопропан | 1,3-Диаминобутан |
| CH3-CH2-CH2-NH2 | NH2-CH2-CH2-CH(NH2) -CH3 |
- Для смешанных аминов, содержащих алкильные и ароматические радикалы, за основу названия обычно берется название первого представителя ароматических аминов – анилин.
Например, N-метиланилин:
Символ N- ставится перед названием алкильного радикала, чтобы показать, что этот радикал связан с атомом азота, а не является заместителем в бензольном кольце.
Видео:СОЛИ ХИМИЯ 8 КЛАСС // Урок Химии 8 класс: Классификация солей, Формулы Солей, Кислотный ОстатокСкачать

Изомерия аминов
Для аминов характерна изомерия углеродного скелета, изомерия положения аминогруппы и изомерия различных типов аминов.
Видео:12.4. Анилин: Строение, химические свойства, способы получения. ЕГЭ по химииСкачать

Изомерия углеродного скелета
Для аминов характерна изомерия углеродного скелета (начиная с С4H9NH2).
| Например. Ф ормуле С4Н9NH2 соответствуют два амина-изомера углеродного скелета. |
| н-Бутиламин (1-аминобутан) | Изобутиламин (1-амин-2-метилпропан) |
 |  |
Видео:ВСЕ ПРО АЛКАНЫ за 8 минут: Химические Свойства и ПолучениеСкачать

Изомерия положения аминогруппы
Для аминов характерна изомерия положения аминогруппы (начиная с С3H9N).
| Например. Ф ормуле С4Н11N соответствуют амины положения аминогруппы. |
| 1-Аминобутан (н-бутиламин) | |
 |  |
Видео:ОКСИДЫ, КИСЛОТЫ, СОЛИ И ОСНОВАНИЯ ХИМИЯ 8 класс / Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Изомерия между типами аминов
| Например. Формуле С3Н9N соответствуют первичный, вторичный и третичный амины. |
| Пропиламин (первичный амин) | Метилэтиламин (вторичный амин) | Триметиламин (третичный амин) |
 |  |  |
Видео:Соли. 8 класс.Скачать

Физические свойства аминов
При обычной температуре низшие алифатические амины CH3NH2, (CH3)2NH и (CH3)3N – газы (с запахом аммиака), средние гомологи – жидкости (с резким рыбным запахом), высшие – твердые вещества без запаха.
Ароматические амины – бесцветные жидкости с высокой температурой кипения или твердые вещества.
Первичные и вторичные амины образуют слабые межмолекулярные водородные связи:
Это объясняет относительно более высокую температуру кипения аминов по сравнению с алканами с близкой молекулярной массой.
Амины также способны к образованию водородных связей с водой:
Поэтому низшие амины хорошо растворимы в воде.
С увеличением числа и размеров углеводородных радикалов растворимость аминов в воде уменьшается. Ароматические амины в воде не растворяются.
Видео:Амины. Анилин. Урок 27. Химия 10 классСкачать

Химические свойства аминов
| Амины имеют сходное с аммиаком строение и проявляют подобные ему свойства. |
Как в аммиаке, так и в аминах атом азота имеет неподеленную пару электронов:


| Поэтому амины и аммиак обладают свойствами оснований. |
1. Основные свойства аминов
| Алифатические амины являются более сильными основаниями, чем аммиак, а ароматические — более слабыми. |
Это объясняется тем, что радикалы СН3–, С2Н5– увеличивают электронную плотность на атоме азота:
Это приводит к усилению основных свойств.
| Основные свойства аминов возрастают в ряду: |
1.1. Взаимодействие с водой
В водном растворе амины обратимо реагируют с водой. Среда водного раствора аминов — слабощелочная:
1.2. Взаимодействие с кислотами
Амины реагируют с кислотами, как минеральными, так и карбоновыми, и аминокислотами, образуя соли (или амиды в случае карбоновых кислот):
При взаимодействии аминов с многоосновными кислотами возможно образование кислых солей:
1.3. Взаимодействие с солями
Амины способны осаждать гидроксиды тяжелых металлов из водных растворов.
| Например, при взаимодействии с хлоридом железа (II) образуется осадок гидроксида железа (II): |
Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

2. Окисление аминов
Амины сгорают в кислороде, образуя азот, углекислый газ и воду. Например, уравнение сгорания этиламина:
Видео:Реакции ионного обмена. 9 класс.Скачать

3. Взаимодействие с азотистой кислотой
Первичные алифатические амины при действии азотистой кислоты превращаются в спирты:
| Это качественная реакция на первичные амины – выделение азота. |
Вторичные амины (алифатические и ароматические) образуют нитрозосоединения — вещества желтого цвета:
Видео:12. В-О Получение анилинаСкачать

4. Алкилирование аминов
Первичные амины способны взаимодействовать с галогеналканами с образованием соли вторичного амина:
Из полученной соли щелочью выделяют вторичный амин, который можно далее алкилировать до третичного амина.
Видео:Анилин. Его свойства и применение | Химия 10 класс #43 | ИнфоурокСкачать

Особенности анилина
Анилин С6H5-NH2 – это ароматический амин.
| Анилин – бесцветная маслянистая жидкость с характерным запахом. На воздухе окисляется и приобретает красно-бурую окраску. Ядовит. В воде практически не растворяется. |
При 18 о С в 100 мл воды растворяется 3,6г анилина. Раствор анилина не изменяет окраску индикаторов.
| Для анилина характерны реакции как по аминогруппе, так и по бензольному кольцу. |
- Бензольное кольцо уменьшает основные свойства аминогруппы по сравнению алифатическими аминами и даже с аммиаком:
Анилин не реагирует с водой, но реагирует с сильными кислотами, образуя соли:
- Бензольное кольцо в анилине становится более активным в реакциях замещения, чем у бензола.
Реакция с галогенами идёт без катализатора во все три орто- и пара- положения.
| Качественная реакция на анилин: реагирует с бромной водой с образованием 2,4,6-триброманилина (белый осадок ↓). |
Видео:Бромирование анилинаСкачать

Получение аминов
Видео:Азотная кислота и анилинСкачать

Восстановление нитросоединений
Первичные амины можно получить восстановлением нитросоединений.
- Гидрирование водородом:
- Восстановление сульфидом аммония:
- Алюминий в щелочнойсреде.
Алюминий реагирует с щелочами с образованием гидроксокомплексов.
В щелочной и нейтральной среде получаются амины.
Восстановлением нитробензола получают анилин.
- Металлами в кислой среде – железом, оловом или цинком в соляной кислоте.
При этом образуются не сами амины, а соли аминов:
Амины из раствора соли выделяют с помощью щелочи:
Видео:Взаимодействие анилина с соляной кислотойСкачать

Алкилирование аммиака и аминов
При взаимодействии аммиака с галогеналканами происходит образование соли первичного амина, из которой действием щелочи можно выделить сам первичный амин.
Если проводить реакцию с избытком аммиака, то сразу получится амин, а галогеноводород образует соль с аммиаком:
Видео:Химия | Тепловой эффект химической реакции (энтальпия)Скачать

Гидрирование нитрилов
Таким образом получают первичные амины. Возможно восстановление нитрилов водородом на катализаторе:
.
Видео:10 класс АнилинСкачать

Соли аминов
- Соли аминов — это твердые вещества без запаха, хорошо растворимые в воде, но не растворимые в органических растворителях (в отличие от аминов).
- При действии щелочей на соли аминов выделяются свободные амины:
- Соли аминов вступают в обменные реакции в растворе:
- Взаимодействие с аминами.
Соль амина с более слабыми основными свойствами может реагировать с другим амином, образуя новую соль (более сильные амины вытесняют менее сильные из солей):
15 комментариев
Добавить ваш
Где получение аминов , там 2) Реакция Зинина слева написано R как радикал, а справа (после равно) уже метиламин, почему метиламин справа, а слева просто R? Разве Зинин не анилин получил этим способом?
Да, спасибо, поправил. В узком смысле реакцией Зинина называют получение именно ароматических аминов, в широком смысле так называют восстановление любых нитросоединений сульфидом аммония.
Здравствуйте! Скажите, пожалуйста, реагируют ли третичные амины с галогеналканами? Если да, то как идет реакция и что получается? Например,при взаимодействии триметиламина с хлорметаном?
Здравствуйте! Реагируют, но дальнейшее замещение по связям N-H не идет.
Здравствуйте! Не показано взаимодействие аминов со спиртами.
Третичные амины с алкилгалогенидами реагируют. Получаются четвертичные аммониевые соли. Говорить, что они вообще не реагируют, неправильно. Они не вступают в реакцию алкилирования.
R3N + RCl = R4N(+)Cl(-)
По такой схеме за счет пары электронов на азоте реагируют алифатические амины, ароматические амины, пиридин с получением N-алкилпиридинийхлорида (иодида) и пр.
Да, спасибо за комментарий. Я имел в виду, что не идет дальнейшее замещение.
спасибо, отличная идея!
для полноты информации я бы добавил оптическую изомерию и примеры этой изомерии ко всем классам органических веществ, потому что на егэ это есть
На ЕГЭ пока оптической изомерии нет.
Admin>Здравствуйте! Реагируют, но дальнейшее замещение по связям N-H не идет.
что значит «дальнейшее»? у триметиламина — и так уже нет N-H связей, может вы имели в виду протонированный триметил-амин (скажем) солянокислый, что в форме соли он останется третичным амином например до момента щелочного депротонирования(высвобождения основания амина)
—
а что кстати, есть способ галоидным алкилом моноалкилирование первичного ароматического амина до вторичного осуществить, избежав образования третичного амина — диалкилированного уже
на этилировании уже проще, а вот метиллирование нейромедиаторов не удавалось остановить на стадии N,N-ДиМет.(например в ацетоне с карбонатом калия, или с DIPEA), выход третичного целевого амина всегда оказывался либо самым низким из продуктов реакции, либо просто очень низким(10% в сложной смеси аминов с преобладанием четвертичной соли триметиламмония метилиодида, а сейчас подумал — если при N-метилировании первичного ароматического амина метилиодидом, образуется гидроиодид N-метил…исх.пер.амина, он же даже во второе метиллирование уже не должен входить, усиленным основанием став (скажем адреналином, основнее норадреналина исходного как я понимаю за счет появившегося электроннодонороного метила) и так будет выведен из реакционной среды(например выпав осадком соли, не солватированной в неполярной РС)
получается в отсутствие основного катализа алкилирование первичных аминов ограничивается моно-алкилированием — не далее чем до вторичного амина? или на практике соли не так надёжны как в оптимистичных прогнозах теоретизирующего учащегося?