Аминокислоты способны соединяться между собой связями, которые называются пептидными , при этом образуется полимерная молекула. Если количество аминокислот не превышает 10, то новое соединение называется пептид; если от 10 до 40 аминокислот – полипептид, если более 40 аминокислот – белок.
Пептидная связь – это связь между α-карбоксильной группой одной аминокислоты и α-аминогруппой другой аминокислоты.
- К свойствам пептидной связи относятся:
- Строение аминокислот. Изоэлектрическая точка. Характеристика пептидной связи
- Строение аминокислот
- Неполярные радикалы аминокислот
- Полярные радикалы аминокислот
- Изоэлектрическая точка
- Образование пептидов
- Пептидная связь
- Диэдральные или торсионные углы
- Пептидная связь — это основа первичной структуры белка. Характеристика и образование пептидной связи
- Характеристика пептидной связи
- Типы конфигурации
- Явление резонанса
- Формирование пептидной связи
- 📺 Видео
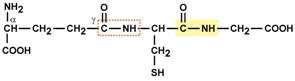
Образование пептидной связи
При необходимости назвать пептид ко всем названиям аминокислот добавляют суффикс «-ил», только последняя аминокислота сохраняет свое название неизменным. Например,
- аланил-серил-триптофан,
- γ-глутаминил-цистеинил-глицин (по-другому называемый глутатион).
Строение трипептида глутатиона
Особенностью глутатиона является связывание глутамата и цистеина не истинной пептидной связью, а через γ-карбоксильную группу радикала глутаминовой кислоты.
К свойствам пептидной связи относятся:
1. Копланарность
Все атомы, входящие в пептидную группу находятся в одной плоскости, при этом атомы «Н» и «О» расположены по разные стороны от пептидной связи.
2.Транс-положение заместителей
Радикалы аминокислот по отношению к оси пептидной C—N-связи находятся по «разные» стороны, в транс-положении.
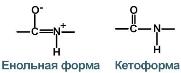
3. Две равнозначные формы
Пептидная связь находится в кетоформе и енольной форме.
4. Способность к образованию водородных связей.
Атомы кислорода и водорода, входящие в пептидную группу, обладают способностью образовывать водородные связи с атомами кислорода и водорода других пептидных групп.
5. Пептидная связь имеет частично характер двойной связи.
Длина пептидной связи меньше, чем одинарной связи, она является жесткой структурой, и вращение вокруг нее затруднено. Но так как, кроме пептидной, в белке есть и другие связи, цепочка аминокислот способна вращаться вокруг основной оси, что придает белкам различную конформацию (пространственное расположение атомов).
Видео:Пептидная связь. Образование пептидной связи. Запись структурной формулы пептида.Скачать

Строение аминокислот. Изоэлектрическая точка. Характеристика пептидной связи
Даже и не знаю с чего начать, давайте попробуем вот так. Белки — это полимерные молекулы, которые состоят из молекул поменьше — мономеров. Этими мономерами будут аминокислоты. Поэтому, если нам хочется построить дом, то сначала нужно разобраться с кирпичами, правильно? Вот в этой статье и будем разбираться с аминокислотами: какие они бывают, сколько их и какие у них свойства. Дальше синтезируем пептид и определим — почему некоторые молекулы называются пептидами, а другие белками. Поймем почему про пептидную связь пишут, что она частично-двойная. А в конце небольшой подарок — торсионные углы. Вроде неплохо получилось? Тогда поехали.
Видео:Пептидная связь. 11 класс.Скачать

Строение аминокислот
По названию все понятно, аминокислота — это молекула, которая содержит аминогруппу и карбоксильную группу. Но посмотрите на центральный углерод, что за бабник? У него целых четыре разных заместителя — водород, аминогруппа, карбоксильная группа и радикал. Он называется…. Альфа-углерод, такой альфа-самец прямо.
Такое общее строение у всех аминокислот, которые входят в состав белков, но они кое-чем отличаются. Да-да, радикалом. Основных аминокислот — 20 штук, хотя если честно, то 19. А если еще честнее, то их больше, но не будем путаться. У одной аминокислоты особенное строение, она даже не аминокислота вовсе, а иминокислота. Вот наша легенда — пролин.
Вернемся к различиям между аминокислотами. Есть несколько классификаций радикалов, но мы возьмем самую полезную для нас — по полярности. А если говорить простыми словами, то по растворимости радикала в воде. И тут все очень логично — радикалы делятся на неполярные и полярные. Первые нерастворимы в воде, а вторые растворимы. Когда будем говорить о строении белка, то поймем почему нас интересует только эта классификация.
Неполярные радикалы аминокислот
У этих ребят нет групп, которые могут образовать водородные связи с водой, поэтому они нерастворимы. Вместо этого у них есть алифатические и ароматические группы. Радикалы выделены фиолетовым цветом.
Опа, а глицин то получается не альфа-самец, у него два одинаковых заместителя — водороды.
Полярные радикалы аминокислот
Перед этим остановимся на одной вещичке. Я писал формулы аминокислот так, как будто они не находятся в растворе. Но если мы заглянем в клетку, pH в цитоплазме которой 7 и 0, то увидим такую картину.
Еще разок, в цитоплазме клетки pH 7,0, то есть в в ней равное количество H + и OH — . Так как у азота есть неподеленная электронная пара, то он может присоединить протон водорода по донорно-акцепторному механизму. А остаток кислоты диссоциирует с образованием протона водорода. Понятное дело, что радикалы подчиняются таким же правилам.
Полярные радикалы можно разделить на две группы: полярные незаряженные и полярные заряженные.
В этих аминокислотах есть сильно электроотрицательные атомы — азот, кислород и сера. С их помощью молекулы образуют водородные связи и растворяются в воде. Но заряда у них нет.
Заряд у радикала может быть положительным или отрицательным, поэтому здесь небольшое деление.
Кстати, лучше растворимы в воде заряженные радикалы. Но разница между полярными заряженными и незаряженными не слишком большая. И еще одно — аспартат и глутамат это название аспарагиновой и глутаминовой кислот в растворе.
Аминокислоты делятся на полярные и неполярные. Полярные аминокислоты могут быть заряженными или незаряженными.
Аминокислоты называли по месту их выделения или физическим свойствам, поэтому у них такие странные названия. Гликос с греческого — сладкий, вот и глицин сладковат. Так что придется зазубрить это.
Видео:Пептидная связьСкачать

Изоэлектрическая точка
Вы уже заметили, что у аминокислот есть положительная и отрицательная части. Не так много молекул имеют такую особенность. Так что аминокислоты — это такой гибрид, поэтому их так и назвали — гибридные ионы. Правда на немецком…. А звучит это так: «Цвиттер-ион». Но как всегда есть один нюанс — у гибридного иона общий заряд молекулы равен нулю.
И вы уже смекнули, что не у всех аминокислот будет общий заряд равен нулю. Для неполярных и полярных незаряженных аминокислот это верно, но че делать с заряженными? До этого мы разбирали заряд аминокислот в клетке, то есть при нейтральном pH. Но что будет с ними, если поместить их в другие значения среды, например, в сильнощелочную или кислотную? Аминокислоты будут менять свой заряд и сейчас посмотрим как.
Для начала возьмем что-нибудь простенькое — пусть это будет глицин. Начинаем добавлять по капельке кислоту, и сначала ничего не меняется. Но при значении pH=2,34 карбоксильная группа глицина присоединит протон водорода. Что же получается? Заряд молекулы изменился — теперь он равен +1. Начнем добавлять к этому же раствору щелочь по капле. Дойдем до pH равного 9,6 и от аминогруппы глицина отлетит водород. Заряд молекулы будет -1.
Думаю, что нужно кое-что уточнить. Вы понимаете, что эти реакции обратимы. Когда я добавляю кислоту или щелочь, неважно, то я смещаю реакцию в какую-то сторону. Пусть я добавляю кислоту. С каждой каплей реакция смещается в сторону образования глицина +1, но только при pH равном 2,34 в растворе будет большая часть глицина +1. Хотя на pH +3 большая часть будет глицина с зарядом 0. Надеюсь, что понятно объяснил.
Как же назвать pH при котором происходит переход из одной формы в другую? Очень просто, показатель константы диссоциации или pKa. Химики не корите, не слишком точно конечно, но запомнить легче. Получается, что в молекуле глицина pKa карбоксильной группы=2,34, а pKa аминогруппы=9,6. Я написал про молекулу глицина, потому что в остальных аминокислотах значения немного отличаются.
А теперь о том, ради чего все это затевалось — изоэлектрическая точка.
Изоэлектрическая точка — это pH среды, при которой заряд молекулы равен нулю. Да, вот так вот просто. Ее, кстати, можно посчитать — для этого нужно сложить pKa двух ближних функциональных групп и поделить на их количество. А их количество — две.
Сделаем тоже самое с молекулами посложнее, начнем с гистидина.
У гистидина есть заряженная группа, поэтому у него побольше вариантов заряда, чем у глицина. Мы видим, что у гистидина карбоксильная группа присоединяет водород при pH =1,82, а аминогруппа отдает протон водорода при pH=9,17. Вот про эти отличия я и говорил до этого, но так-то они не слишком большие. Радикал же отдает протон водорода при pH=6.
Сделаем тоже самое с глутаматом.
Думаю, что смысл понятен. У каждой аминокислоты своя собственная изоэлектрическая точка. Точки уже давно подсчитаны — достаточно найти их в интернете.
Сделаем красивый вывод:
Любая аминокислота цвиттер-ион, но только в изоэлектрической точке
Зачем это нужно? Ну давайте посмотрим. Мы знаем, что каждая аминокислота несет определенный заряд, но этот заряд меняется от pH среды. Если мы поместим аминокислоты в нейтральную среду и закинем туда катод и анод, то положительно заряженные аминокислоты направятся к аноду, а отрицательные к катоду. Остальные аминокислоты можно будет разделить с помощью изменения pH среды, ведь в изоэлектрической точке у аминокислоты не будет заряда. Нет заряда — нет движения к катоду или аноду, аминокислота стоит на месте. Вот мы и разделили аминокислоты в растворе, можно их изучить.
Видео:Образование пептидов. Запись структурной формулы пептидаСкачать

Образование пептидов
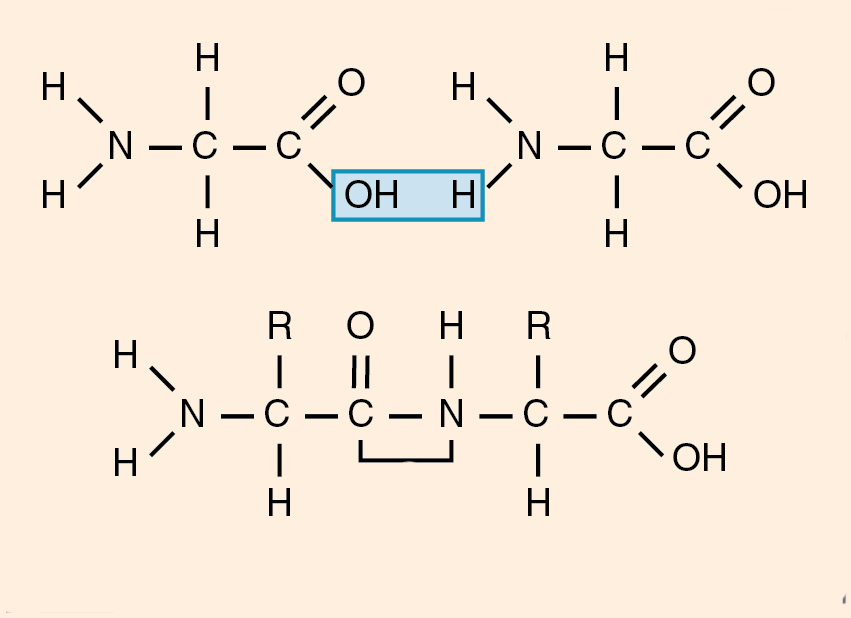
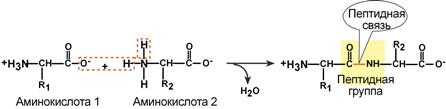
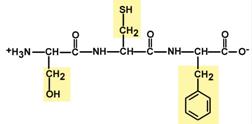
Теперь давайте соединим между собой парочку аминокислот, пусть это будет глицин и аланин. Соединяем их с помощью реакции дегидратации — отщепляем молекулу воды и получаем пептид.
Какие группы вступали в реакцию? Да, аминогруппа и карбоксильная группа. Получается, что пептидная связь — это связь между аминогруппой одной аминокислоты с карбоксильной группой другой аминокислоты. Так как соединены две аминокислоты, то название молекулы — дипептид. Ничего не мешает мне присоединить еще одну.
И это уже трипептид. Если соединены до 10 пептидов, то это олигопептид. От 10 до 50 — полипептид, ну а если больше 50, то это белок. Как видите реакция обратима, можно провести гидратацию по пептидной связи и пептид разрушится. На самом деле реакция гидратации идет намного лучше, а вот для дегидратации нужен источник энергии — АТФ, и рибосомальная РНК. Так что для синтеза пептидов/белков организм неплохо так тратится.
Ну и вы заметили, что я располагаю радикалы с разных сторон — то сверху, а то снизу. Это транс положение, оно более устойчиво, но можете писать как хотите.
Белок — это пептид, который содержит более 50 остатков аминокислот
Видео:Пептидная связьСкачать

Пептидная связь
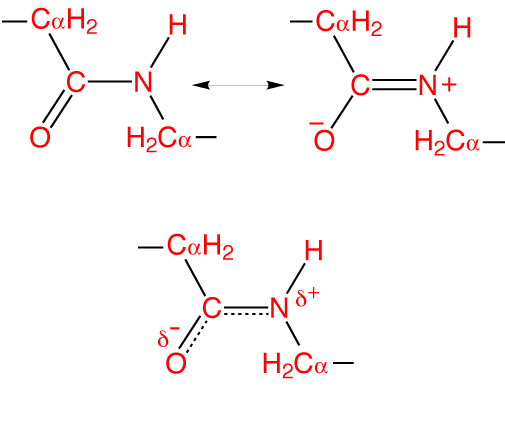
У пептидной связи есть свои секретики, но мы не дадим ей хранить их просто так. Главный секрет в том, что двойная связь находится не у кислорода, а у азота… Хотя это не совсем двойная связь, но близка к ней. Как же это происходит? У азота есть неподеленная электронная пара, электроны могут перейти от азота к кислороду, а двойная связь перейдет от кислорода к азоту — неплохой такой обменчик. Это явление называется резонанс пептидной связи, именно из-за него во всех учебниках пишут про «частично-двойной характер пептидной связи».
Пойдем еще немного дальше, о чем нам говорит двойная связь? Правильно, о гибридизации углерода — она здесь sp 2 . А значит угол между связями углерода 120 градусов, здесь они не прямо 120 градусов, но близки к этому. Идем дальше. Азот здесь тоже в sp 2 гибридизации, понятно какие углы и у него. Но к чему я это все? Ах да, как будет выглядеть молекула?
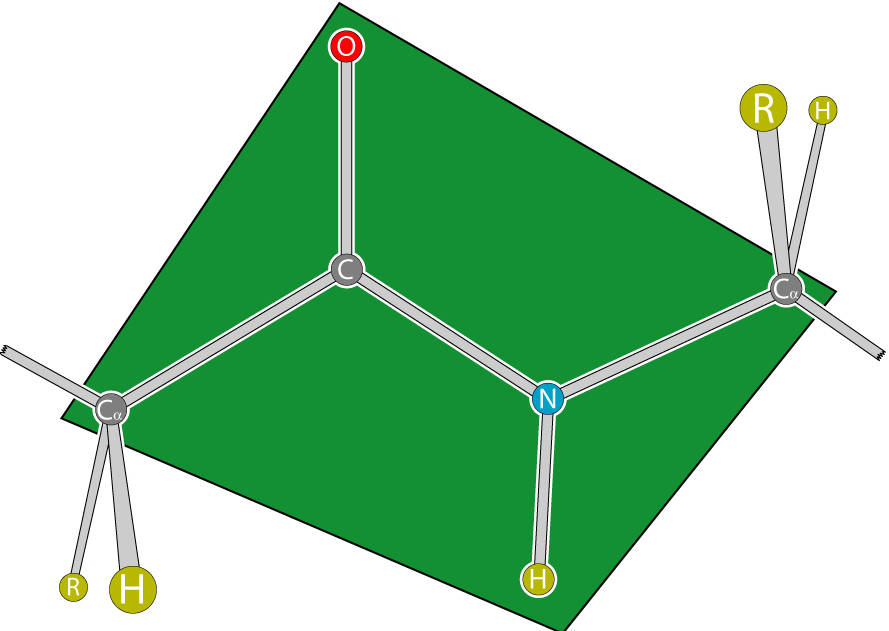
Так как все углы по 120 градусов, то все 6 атомов — 3 углерода, азот, водород и кислород, лежат в одной плоскости, как будто на ладошке. За счет того, что углерод и азот образуют две связи — одну пи и одну сигму, вращение вокруг этих связей практически невозможно. Но об этом чуть позже, сейчас давайте упростим эту схему.
Это мы сделали только с одной пептидной связью, но что если добавить вторую? Получится кое что интересненькое…
Следующая пептидная связь такая же, как и предыдущая. Получается, что опять 6 атомов лежат в одной плоскости, вы видите, что один атом углерода принадлежит сразу к двум плоскостям и это удивительно! Можно даже подумать, что все эти пептидные связи будут лежать в одной и той же плоскости, но это не так, а виной этому — вращение вокруг связей.
Видео:Биохимия аминокислотСкачать

Диэдральные или торсионные углы
Название пугающее, но сейчас как устроим этим углам! Так, мы уже говорили о том, что вокруг пептидной связи не повращаться из-за того, что она частично двойная. Но ведь есть и другие связи, вокруг которых можно устроить веселуху.
Понимаю, что представить это не так уж и легко, но можно попробовать сделать! Получится конечно не совсем так, но принцип поймем. Возьмем ручку и два колпачка, засунем бумажку под каждый колпачок и начнем крутить. Условимся, что мои пальцы — альфа-углеродный атом, то есть место пересечения двух плоскостей.
И вращаем!
Вращаем
Теперь мы поняли, как происходит вращение, но это еще не все. Существуют определенные углы между плоскостями и всего их два. Представьте, что нам захочется найти угол между углеродами, у которых карбоксильная группа, двух плоскостей. Или угол между двумя атомами азота, опять же, двух разных плоскостей. Задачка кажется сложной… Но перед этим, а зачем я вообще мучаю вас этим? Дело в том, что когда мы дойдем до конформации белковых молекул, то благодаря этим углам мы поймем: как и почему образуется альфа-спираль, тоже самое с бета-складчатостью. Так что потерпите немного!
Если посмотреть на эту схему, то можно кое-что прикинуть: если мы будем вращать связь между N и C, то углерод с карбоксильной группой изменит положение относительно углерода другой плоскости, а вот азот останется на том же месте — угол между двумя азотами не изменится. А вот если начнем вращать связь между C и C, то все будет наоборот: угол между азотами изменится, но вот углероды с карбоксильной группой останутся на месте. Сложновато, но чуть дальше я дам пространственную картинку. Пока что мы пришли к выводу, что связь между N и C влияет на угол между углеродами — этот угол называется фи. А вот связь между C и C влияет на угол между атомами азота — угол пси.
Теперь можно и добавить атомы водорода в схему, они скоро нам понадобятся.
Добавим реалистичности, центральным радикалом у нас будет -CH3, а остальные радикалы уберем.
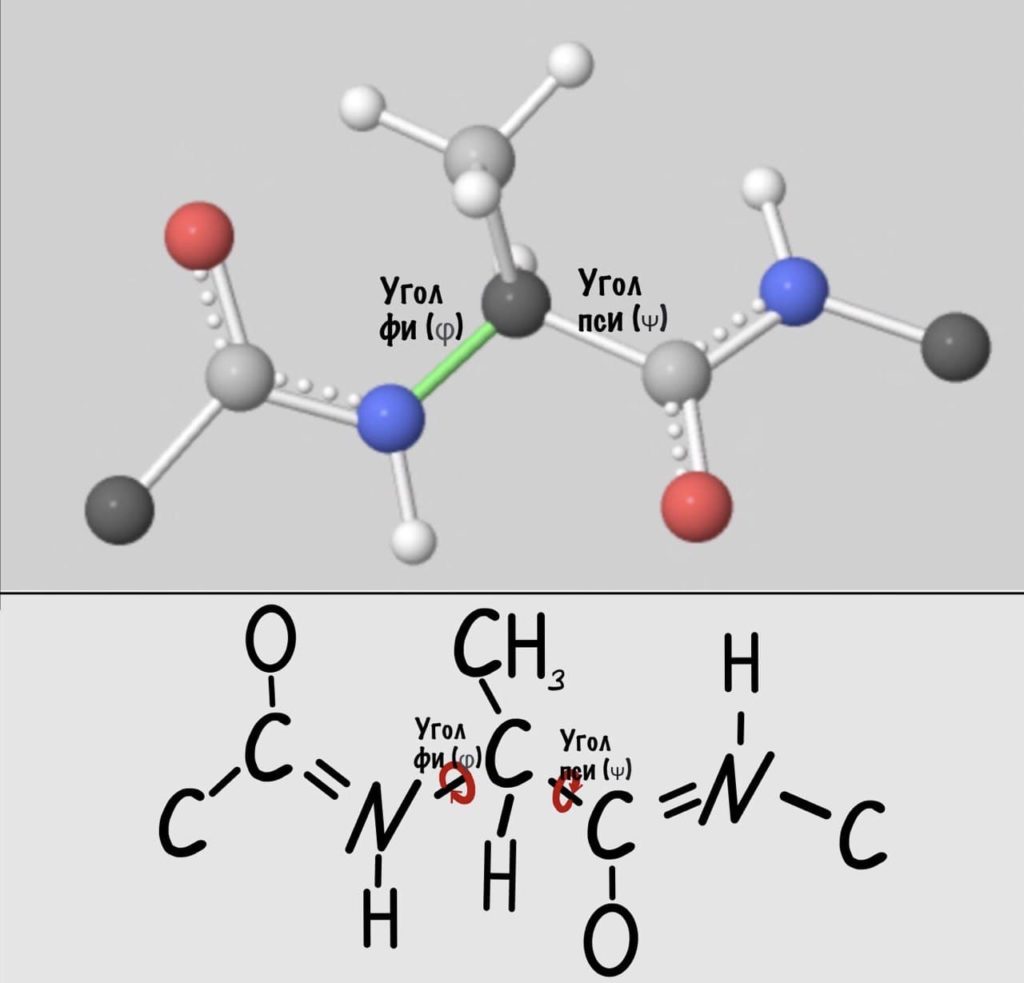
А теперь главный вопрос — как измерить эти углы? Хорошо, что уже это придумали… И мы можем сделать это вместе — заходите сюда и поехали! Первым делом нам нужно перевернуть молекулу так, чтобы расположить атом углерода с карбоксильной группой сверху. Зачем такие выкрутасы? Расскажу позже. А теперь посмотрим прямо в альфа атом углерода, да так что за ним спрятался азот. Как-то это странно звучит, но давайте попробуем.
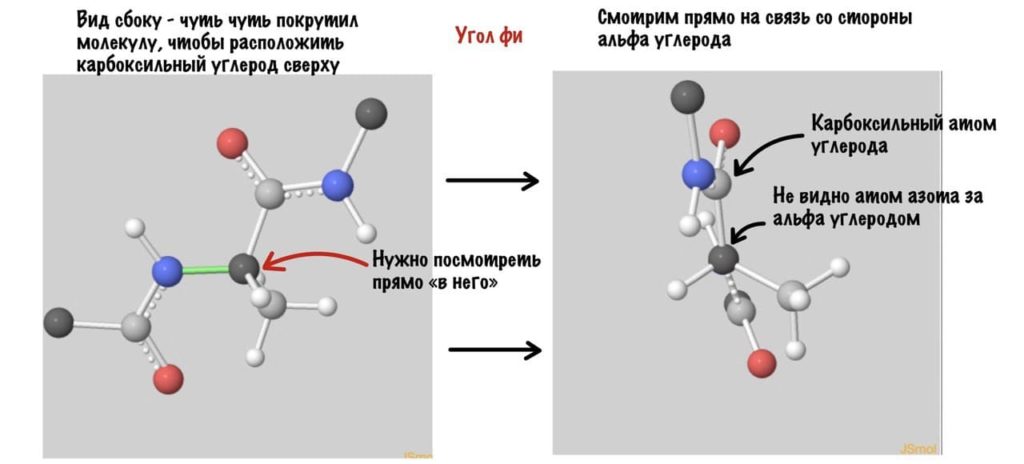
wiki/index.php/Tutorial:Ramachandran_principle_and_phi_psi_angles
Еще это можно посмотреть графически с помощью проекций Ньюмана.
Так, повторим что такое угол фи — это угол между двумя карбоксильными атомами углерода. На рисунке уже их видно.
Поняли зачем так крутили молекулу? Да, просто так нам удобнее смотреть угол. А теперь начнем вращать и посмотрим как меняются углы.
Угол пси по такой же логике. Крутим молекулу, чтобы атом азота оказался сверху и смотрим прямо в альфа атом углерода.
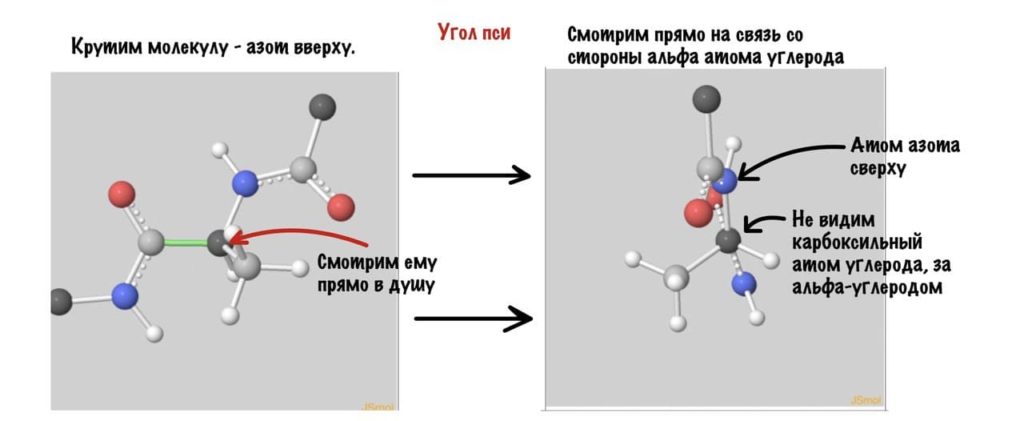
wiki/index.php/Tutorial:Ramachandran_principle_and_phi_psi_angles
Еще разок построим проекцию Ньюмана, она немного отличается, и сразу же отметим углы.
Думаю, что принцип понятен. Дальше можете покрутить сами, правильно? Я не сказал про одно большое «НО» — не каждый угол возможен, так как у атомов есть электронные оболочки, которые заряжены отрицательно. Если электронные оболочки подходят слишком близко, то они отталкиваются и угол меняется. Какие углы возможны? Для этого еще разок зайдите сюда и включите на панельке справа силы Ван-дер-Вальса и show clashes.
Подробнее о влиянии этих углов в следующей статье.
Хочешь задать вопрос, похвалить или наговорить гадостей? Тогда залетай в телегу. Там ты сможешь предложить новый формат или разбор темы. А если серьёзно, то эти статьи пишутся для вас, поэтому мне важна обратная связь.
Видео:АМИНОКИСЛОТЫ. ГОТОВИМСЯ К МИКРОКОНТРОЛЮСкачать

Пептидная связь — это основа первичной структуры белка. Характеристика и образование пептидной связи
Пептидная связь — это прочное соединение между фрагментами двух аминокислот, которое лежит в основе образования линейных структур белков и пептидов. В таких молекулах каждая аминокислота (за исключением концевых) соединяется с предыдущей и последующей.
В зависимости от количества звеньев пептидные связи могут создавать дипептиды (состоят из двух аминокислот), трипептиды (из трех), тетрапептиды, пентапептиды и т. д. Короткие цепочки (от 10 до 50 мономеров) называют олигопептидами, а длинные — полипептидами и белками (мол. масса более 10 тыс. Да).
Видео:Что такое пептидная связь? Душкин объяснитСкачать

Характеристика пептидной связи
Пептидная связь — это ковалентное химическое соединение между первым атомом углерода одной аминокислоты и атомом азота другой, возникающее в результате взаимодействия альфа-карбоксильной группы (COOH) с альфа-аминогруппой (NH2). При этом происходит нуклеофильное замещение OH-гидроксила на аминогруппу, от которой отделяется водород. В итоге образуется одинарная C-N связь и молекула воды.
Так как во время реакции происходит потеря некоторых компонентов (ОН-группы и атома водорода), звенья пептида называют уже не аминокислотами, а аминокислотными остатками. Из-за того, что последние содержат по 2 атома углерода, в пептидной цепи происходит чередование С-С и C-N-связей, которые формируют пептидный остов. По бокам от него располагаются аминокислотные радикалы. Расстояние между атомами углерода и азота варьирует от 0,132 до 0,127 нм, что свидетельствует о неопределенной связи.
Пептидная связь — это очень прочный вид химического взаимодействия. При стандартных биохимических условиях, соответствующих клеточной среде, она не подвергается самостоятельному разрушению.
Для пептидной связи белков и пептидов характерно свойство копланарности, поскольку все атомы, участвующие в ее образовании (C, N, O и H), располагаются в одной плоскости. Это явление объясняется жесткостью (т. е. невозможностью вращения элементов вокруг связи), возникающей в результате резонансной стабилизации. В пределах аминокислотной цепи между плоскостями пептидных групп находятся α-углеродные атомы, связанные с радикалами.
Видео:22 Аминокислоты, пептидная связь, первичная и вторичная структуры белка; кератинСкачать

Типы конфигурации
В зависимости от положения альфа-углеродных атомов относительно пептидной связи последняя может иметь 2 конфигурации:
- «цис» (расположены с одной стороны);
- «транс» (находятся с разных сторон).
Транс-форма характеризуется большей устойчивостью. Иногда конфигурации характеризуют по расположению радикалов, что не меняет сути, поскольку они связаны с альфа-углеродными атомами.
Видео:ЛЕКЦИЯ 4. АМИНОКИСЛОТЫ, БЕЛКИСкачать

Явление резонанса
Особенность пептидной связи заключается в том, что она на 40% двойная и может находится в трех формах:
- Кетольной (0,132 нм) — C-N-связь стабилизирована и полностью одинарна.
- Переходной или мезомерной – промежуточная форма, имеет частично неопределенный характер.
- Енольной (0,127 нм) — пептидная связь становится полностью двойной, а соединение С-О — полностью одинарным. При этом кислород приобретает частично отрицательный заряд, а атом водорода — частично положительный.
Такая особенность называется эффектом резонанса и объясняется делокализованностью ковалентной связи между атомом углерода и азота. При этом гибридные sp 2 -орбитали формируют электронное облако, распространяющееся на атом кислорода.
Видео:Биохимия. Определение заряда аминокислот и пептидов в различных средах.Скачать

Формирование пептидной связи
Формирование пептидной связи — это типичная реакция поликонденсации, которая термодинамически невыгодна. В естественных условиях равновесие смещается в сторону свободных аминокислот, поэтому для осуществления синтеза требуется катализатор, активирующий или модифицирующий карбоксильную группу для более легкого ухода гидроксильной.
В живой клетке образование пептидной связи происходит в белоксинтезирующем центре, где в роли катализатора выступают специфические ферменты, работающие с затратой энергии макроэргических связей.
📺 Видео
Биохимия. Лекция 1. АминокислотыСкачать

Движение пептидов в электрофоретическом поле при разных рН. Биохимия.Скачать

Введение в аминокислоты (видео 8) | Макромолекулы | БиологияСкачать
Биохимия. Белки. Строим полипептидную цепь.Скачать

Аминокислоты. Белки. 1 часть. 9 класс.Скачать

Белки. Видеоурок 6. Биология 9 классСкачать

РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Химия 10 класс (Урок№12 - Аминокислоты. Белки.)Скачать

Лекция: Химия - АминокислотыСкачать



 И вращаем!
И вращаем! Вращаем
Вращаем