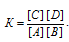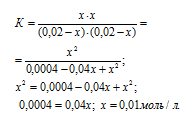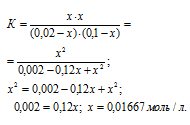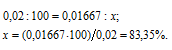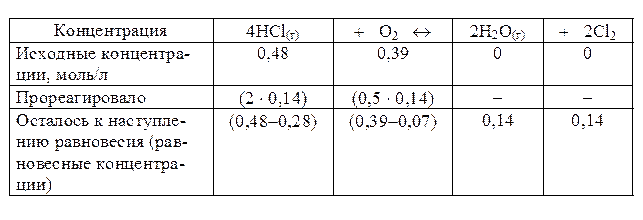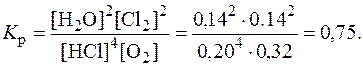Задача 361.
Константа равновесия реакции А(г) + В(г) ⇔ С(г) + D(г) равна единице. Начальная концентрация = 0,02 моль/л. Сколько процентов вещества А подвергается превращению, если начальные концентрации [A]0 = равны 0,02,
[B]0 = 0,1 и 0,2 моль/л?
Решение:
Уравнение реакции имеет вид: А(г) + В(г)⇔ С(г) + D(г).
Согласно уравнению реакции из 1 моля вещества А и 1 моля вещества В образуется по 1 молю веществ С и D. Следовательно, выражение для константы реакции будет иметь вид:
Обозначим количество прореагировавших веществ через «x». Следовательно, начальные концентрации реагирующих веществ можно записать:
Тогда выражение для константы реакции можно записать:
Теперь рассчитаем, сколько процентов вещества А подвергнется превращению из пропорции:
0,02 : 100 = 0,01 : x; x = (0,01 . 100)/0,02 = 50%.
Тогда выражение для константы реакции можно записать:
Теперь рассчитаем, сколько процентов вещества А подвергнется превращению из пропорции:
0,02 : 100 = 0,01667 : x; x = (0,01667 . 100)/0,02 = 83,35%.
Тогда выражение для константы реакции можно записать:
Теперь рассчитаем, сколько процентов вещества А подвергнется превращению из пропорции:
0,02 : 100 = 0,01818 : x; x = (0,01818 . 100)/0,02 = 90,9%.
Ответ: а) 50%; б) 83,35%; в) 90,9%.
Задача 362.
Система:
C(графит) + СО2(г) ⇔ 2СО(г); 
находится в состоянии равновесия. Указать: а) как изменится содержание СО в равновесной смеси с повышением температуры при неизменном давлении? С ростом общего давления при неизменной температуре? б) изменится ли константа равновесия при повышении общего давления и неизменной температуре? При увеличении температуры? При введении в систему катализатора?
Решение:
Уравнение реакции имеет вид:
C (графит) + СО 2(г) ⇔ 2СО (г) ; 
- а) Изменения содержания СО в равновесной смеси с повышением температуры при неизменном давлении? С ростом общего давления при неизменной температуре?
- б) Изменения константы равновесия при повышении общего давления и неизменной температуре? При увеличении температуры? При введении в систему катализатора?
- Константа равновесия реакции А + В ⇆ С + D равна 1. Сколько процентов вещества А подвергается превращению, если смешать 3 моля вещества
- Ваш ответ
- решение вопроса
- Похожие вопросы
- Обратимые реакции. Константа равновесия
- 🌟 Видео
а) Изменения содержания СО в равновесной смеси с повышением температуры при неизменном давлении? С ростом общего давления при неизменной температуре?
(1) Реакция протекает с поглощением теплоты, поэтому с повышением температуры при неизменном давлении, согласно принципу Ле-Шателье, равновесие системы сместится вправо, т. е. в сторону прямой реакции и концентрация СО при этом повысится.
(2) Реакция протекает с увеличением объёма газообразных веществ, поэтому при повышении общего давления в системе, согласно принципу Ле-Шателье, равновесие системы сместится влево, т.е. в сторону обратной реакции и содержание СО при этом уменьшится.
б) Изменения константы равновесия при повышении общего давления и неизменной температуре? При увеличении температуры? При введении в систему катализатора?
(1) Реакция протекает с увеличением содержания газообразных веществ, поэтому при повышении общего давления и неизменной температуре в системе, согласно принципу Ле-Шателье, равновесие системы сместится влево в сторону уменьшения общего числа молей газообразных веществ, т.е. в сторону образования СО2. Значит, константа обратной реакции будет больше константы прямой реакции ( k2 > k1) или (k1
(2) Так как реакция протекает с поглощением теплоты, поэтому при увеличении температуры, согласно принципу
Ле-Шателье, равновесие системы сместится вправо в сторону прямой реакции, т.е. (k1 > k2).
(3) При введении в систему катализатора равновесие системы не изменится, потому что катализатор увеличит скорость как прямой, так и обратной реакции, т.е. (k1 = k2).
Ответ: а) (1) содержание СО повысится, (2) содержание СО понизится; б) (1) k1 k2, (3) k1 = k2.
Задача 363.
В каком направлении сместятся равновесия:
2C(г) + О2(г) ⇔ 2СО(г); 
N2(г) + О2(г) ⇔ 2NО(г); 
а) при понижении температуры? б) при повышении давления?
Решение:
Уравнения реакций имеют вид:
2C(г) + О2(г) ⇔ 2СО(г); 
N2(г) + О2(г) ⇔ 2NО(г); 
а) При понижении температуры, согласно принципу Ле-Шателье, равновесие реакции (1) сместится вправо, так как данная реакция протекает с выделением теплоты; равновесие реакции (2) сместится влево, потому что эта реакция протекает с поглощением теплоты.
б) При повышении давления в системе, согласно принципу Ле-Шателье, равновесие реакции (1) сместится вправо, так как данная реакция протекает с уменьшением числа молей газообразных веществ; смещение равновесия реакции (2) не произойдёт, так как данная реакция протекает числа молей газообразных веществ.
Ответ: а) (1) вправо, (2) влево; б) (1) вправо, (2) не сместится.
Задача 364.
Как повлияет на равновесие следующих реакций:
H2(г) + О2(г) ⇔ 2H2O(г); 
СаСО3(к) ⇔ СаО(к) + СО2(г); 
а) повышение давления; б) повышение температуры?
Решение:
Уравнения реакций имеют вид:
H2(г) + О2(г) ⇔ 2H2O(г); 
СаСО3(к) ⇔ СаО(к) + СО2(г); 
а) При повышении давления в системе, согласно принципу Ле-Шателье, равновесие реакции (1) сместится вправо, так как данная реакция протекает с уменьшением числа молей газообразных веществ; равновесие реакции (2) сместится влево, так как данная реакция протекает с увеличением числа молей газообразных веществ.
б) При повышении температуры системы, согласно принципу Ле-Шателье, равновесие реакции (1) сместится влево, так как данная реакция протекает с выделением теплоты; равновесие реакции (2) сместится вправо, так как данная реакция протекает с поглощением теплоты.
Ответ: а) (1) вправо, (2) влево; б) (1) влево, (2) вправо.
Задача 365.
Указать, какими изменениями концентраций реагирующих веществ можно сместить вправо равновесие реакции C(графит) + СО2(г) ⇔ 2СО(г).
Решение:
Уравнение реакции имеет вид:
1). Продуктом данной реакции является угарный газ, поэтому, согласно принципу Ле-Шателье, отведение из системы СО сместит равновесие системы вправо, т. е. в сторону дополнительного образования СО.
2). Увеличение концентрации исходного газообразного вещества СО2, согласно принципу Ле-Шателье, сместит равновесие системы вправо, т.е. в сторону уменьшения содержания данного вещества и при этом будет образовываться дополнительное количество СО.
Ответ: 1) уменьшение концентрации СО; 2) увеличение концентрации СО2
Видео:Решение задач на тему: "Нахождение константы равновесия и равновесных концентраций". 1ч. 10 класс.Скачать

Константа равновесия реакции А + В ⇆ С + D равна 1. Сколько процентов вещества А подвергается превращению, если смешать 3 моля вещества
Видео:Химическое равновесие. Константа равновесия. 10 класс.Скачать

Ваш ответ
Видео:Химическое равновесие. Константа равновесия. Обратимость реакций.Скачать

решение вопроса
Видео:Обратимость и необратимость химических реакций. Химическое равновесие. 1 часть. 9 класс.Скачать

Похожие вопросы
- Все категории
- экономические 43,415
- гуманитарные 33,633
- юридические 17,906
- школьный раздел 608,079
- разное 16,856
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
Видео:Химическое равновесие. Закон действующих масс.Скачать

Обратимые реакции. Константа равновесия
Химические реакции, которые протекают только в одном направлении и завершаются полным превращением исходных веществ в конечные, называются необратимыми. Реакций этого типа очень мало, большинство реакций являются обратимыми. В обратимых реакциях образовавшиеся вещества взаимодействуют между собой, превращаясь в исходные, т. е. такие реакции могут протекать как в прямом, так и в обратном направлении. В уравнениях обратимых реакций вместо знака = используется знак «.
Рассмотрим гомогенную обратимую реакцию
Реакция, направленная слева направо, называется прямой, а противоположная – обратной. Согласно закону действия масс скорость прямой реакции определяется выражением
а скорость обратной реакции – выражением
В начальный момент времени t скорость прямой реакции максимальна, со временем она уменьшается, так как расходуются исходные вещества А и В. Напротив, скорость обратной реакции со временем возрастает, так как накапливаются вещества С и D (рис. 3). Через некоторое время tравн скорости прямой и обратной реакции будут равны друг другу.
Такое состояние называется динамическим химическим равновесием. В состоянии химического равновесия прямая и обратная реакции не прекращаются, однако химический состав системы сохраняется постоянным. Например, за некоторый промежуток времени в системе (5.1) по прямой реакции образуется х моль вещества С. За этот же промежуток времени в обратной реакции расходуется также х моль вещества С, аналогично и для веществ А, В и D данной системы. Следовательно, в состоянии равновесия концентрация каждого вещества остается во времени постоянной и называется равновесной. Равновесные концентрации обозначаются формулами веществ, заключенными в квадратные скобки, например, [A], [B], [C], [D], тогда как неравновесные концентрации обозначают CA, CB, CC, CD.
Рис. 3. Состояние химического равновесия
Подставив в уравнение (5.4) выражения для скорости прямой (5.2) и обратной (5.3) реакций с учетом равновесных концентраций, получим
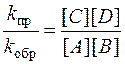
Отношение констант скоростей kпр/kобр при данной температуре также является постоянной величиной, называемой константой равновесия Кр.

Тогда окончательно получаем

Чем больше значение константы равновесия, тем «глубже» протекает прямая реакция до момента установления в системе химического равновесия.
Для реакции общего вида
выражение константы равновесия имеет вид

В случае гетерогенной реакции концентрации твердых веществ в выражение Кр не входят, так как они, как правило, остаются постоянными.
Пример 1. Написать выражение константы равновесия для следующих реакций: а) 2SO2 + O2 « 2SO3; б) 3Fe + 4H2O(г) « Fe3O4 + 4H2.
Решение. Вещества SO2, O2 и SO3 – газы, следовательно, реакция 2SO2 + O2 « 2SO3 – гомогенная:

Реакция 3Fe + 4H2O(г) « Fe3O4 + 4H2 является гетерогенной, концентрации твердых веществ Fe и Fe3O4 в выражение константы равновесия не входят:

Пример 2.В гомогенной системе 4HCl(г) + O2 « 2H2O(г) + 2Cl2 равновесие установилось при концентрации Cl2, равной 0,14 моль/л. Исходные концентрации HCl и O2 составляли соответственно 0,48 и 0,39 моль/л. Вычислить константу равновесия.
Решение. Из уравнения реакции видно, что на образование 0,14 моль Cl2 расходуется 2 × 0,14 = 0,28 моль HCl и 0,5 × 0,14 = 0,07 моль O2. Следовательно, к моменту равновесия осталось (0,48 — 0,28) = 0,20 моль HCl и (0,39 — 0,07) = 0,32 моль O2. Равновесная концентрация H2O равна равновесной концентрации Cl2. Эти расчеты удобно представить в виде таблицы:
Рассчитаем константу равновесия:
Пример 3. Константа равновесия гомогенной системы H2 + I2 « 2HI при некоторой температуре равна 36. Определить, какой процент водорода и йода перейдет в HI, если исходные концентрации этих веществ одинаковы и составляют 0,01 моль/л.
Решение. Пусть к моменту равновесия прореагировало х моль H2. Выразим равновесные концентрации веществ через исходные в виде таблицы:
Подставим значения равновесных концентраций в выражение константы равновесия:
Извлекая из обеих частей уравнения корень, получим
Таким образом, из 0,01 моль водорода и 0,01 моль йода прореагировало по 0,0075 моль, что составляет 75 %.
Значение константы равновесия зависит только от природы участвующих в реакции веществ и температуры. Если в системе присутствует катализатор, то он в равной степени изменяет скорости и прямой, и обратной реакции, ускоряет достижение химического равновесия, но не изменяет значения Кр.
Существует связь между константой равновесия и энергией Гиббса. Чем более отрицательно значение DG°, тем сильнее сдвинуто равновесие в сторону продуктов реакции, т. е. тем больше константа равновесия. При температуре Т связь между Кр и DG выражается уравнением
🌟 Видео
Задания на константу равновесия по учебнику ЕреминаСкачать
Как выучить Химию с нуля за 10 минут? Принцип Ле-ШательеСкачать

Обратимые и необратимые реакции | Химическое равновесие и условия его смещенияСкачать

Решение задач на тему: "Нахождение константы равновесия и равновесных концентраций". 4ч. 10 класс.Скачать

Решение задач на тему: "Нахождение константы равновесия и равновесных концентраций". 3ч. 10 классСкачать

3.4. Химическое равновесие, ч.1Скачать

Решение задач на тему: "Нахождение константы равновесия и равновесных концентраций". 2ч. 10 класс.Скачать

Задача химическое равновесие. РАВНОВЕСНЫЕ КОНЦЕНТРАЦИИ и Кр.Скачать

ФИЗХА 10 класс | Химическое равновесие | Олимпиадные задачи по химииСкачать

Обратимые и необратимые реакции. Понятие о химическом равновесии.Скачать

Химия 9 класс (Урок№4 - Обратимые и необратимые реакции. Понятие о химическом равновесии.)Скачать

Химическое равновесие / Решение задач на химическое равновесиеСкачать

27.1. Константа равновесия.Скачать

Обратимость и необратимость химических реакций. Химическое равновесие. 2 часть. 9 класс.Скачать

83. Химическое равновесиеСкачать