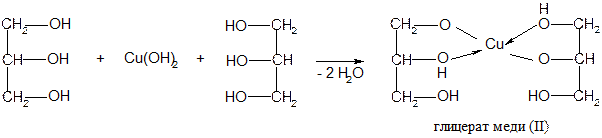| Название | Методические указания по выполнению лабораторных работ по курсу Органическая химия |
| Анкор | Методичка по органике.doc |
| Дата | 14.12.2017 |
| Размер | 2.59 Mb. |
| Формат файла |  |
| Имя файла | Методичка по органике.doc |
| Тип | Методические указания #11402 |
| страница | 4 из 7 |
| Подборка по базе: Практическая работа №4 _ требования к выполнению-2.docx, Памятка по выполнению разборов.docx, Методические указания для выполнения СРС № 3 (1).docx, Рекомендации к выполнению Практикум по нейродиагностике (1).docx, ЛР2 Метод указания по СМО.doc, Практическая работа №4 _ требования к выполнению-2.docx, Методические указания по выполнению рейтинговой работы 1 дисципл, Чек лист Методические рек. по проведению анализа урока занятия.d, МЕТОДИЧЕСКИЕ РЕКОМЕНДАЦИИ ПО ВЫПОЛНЕНИЮ ДИПЛОМНОЙ РАБОТЫ.doc, Рекомендации по выполнению Практической работы. 5 docx.docx Опыт 2. Определение углерода и водорода сожжением вещества с оксидом меди (II) Реактивы и материалы: глюкоза (или глицерин, крахмал, сахар); оксид меди (порошок); баритовая вода, насыщенный водный раствор; сульфат меди (II) безводный. Оборудование: газоотводная трубка с пробкой; стеклянная палочка; микролопатка. В Нижний конец трубки опускают в пробирку 2, предварительно налив в нее 5-6 капель баритовой (или известковой) воды. Пробирку 1нагревают на пламени Через несколько секунд из газоотводной трубки начинают выходить пузырьки газа, и баритовая вода мутнеет вследствие выделения белого осадка углекислого бария. Пробирку 2удаляют. Продолжают нагревать пробирку 1, пока пары воды не достигнут белого порошка обезвоженного медного купороса, находящегося на ватной пробке, и не вызовут изменения его окраски вследствие образования кристаллогидрата CuSO4*5H2O . Метод основан на том, что при прокаливании органического вещества в смеси с окислителем (СuО) происходит окисление углерода органического вещества в диоксид углерода, а водорода – в воду. Оксид меди при этом восстанавливается до металлической меди. Выделение диоксида углерода доказывается появлением белого осадка углекислого бария. Воду в продуктах сжигания обнаруживают по образованию синих кристаллов медного купороса. Реактивы и материалы: мочевина кристаллическая; натрий металлический, сульфат железа (II) FeSО4, 0,1 н. раствор; хлорид железа (III) FeCl3, 0,1 н. раствор; соляная кислота, 2 н. раствор; этиловый спирт, 90%-ный. Оборудование: стекла предметные; пипетки. В сухую пробирку помещают 5-10 мг мочевины (несколько кристаллов) и вносят небольшой кусочек металлического натрия. Смесь осторожно нагревают в пламени микрогорелки до сплавления мочевины с натрием. При этом иногда наблюдается небольшая вспышка. После охлаждения пробирки со сплавом в нее добавляют 3 капли этилового спирта для устранения остатков металлического натрия, который реагирует со спиртом, но не так бурно, как с водой. При этом образуется алкоголят натрия и выделяется водород: Затем в пробирку добавляют 5 капель дистиллированной воды и нагревают на пламени горелки для растворения образовавшегося цианистого натрия. С помощью пипетки переносят раствор цианистого натрия на предметное стекло, добавляют 1 каплю железного купороса и 1 каплю хлорида железа (III), которые в присутствии щелочи, образовавшейся при реакции алкоголята натрия с водой, дают грязно-зеленый осадок гидроксида железа (II) Fe(ОН)2 и желтый осадок гидроксида железа (III) Fe(ОН)3: Если в растворе имеется избыток цианистого натрия, то образуется гексациано(II)феррат натрия Na4[Fe(CN)6]. Наносят пипеткой на фильтровальную бумагу (30*30 мм) одну каплю мутной жидкости. После того как капля впитается, на это же место наносят одну каплю соляной кислоты. Образовавшийся комплекс с солями железа (III) может дать синий осадок – берлинскую лазурь. Однако присутствующая в растворе щелочь связывает ионы Fe 3+ в гидроксид железа (III). Поэтому берлинская лазурь может образоваться только после растворения гидроксида в кислоте: При проведении опыта необходимо обратить внимание на то, чтобы натрий плавился вместе с органическим веществом. Если натрий плавится отдельно от вещества, то даже при наличии в веществе азота цианистый натрий не образуется и опыт будет неудачным. Реактивы и материалы: металлический натрий; стрептоцид белый (или сульфаниловая кислота); этиловый спирт; уксуснокислый свинец, 0,1 н. раствор; нитропруссид натрия, 0,5 н. раствор. Оборудование: фильтровальная бумага. В сухую пробирку помещают испытуемое вещество, например белый стрептоцид или сульфаниловую кислоту (несколько крупинок 5-6 мг), и вносят небольшой кусочек металлического натрия. Держа пробирку вертикально, нагревают смесь докрасна, чтобы натрий плавился в смеси с веществом. Затем пробирку со сплавом охлаждают и добавляют в нее 3 капли этилового спирта для удаления остатка металлического натрия. После окончания выделения пузырьков газа (водорода) сплав растворяют при нагревании в 5 каплях дистиллированной воды. Складывают вместе два кусочка фильтровальной бумаги 30*30 мм и наносят с помощью пипетки по 2 капли темной жидкости на противоположные углы бумажки (рис.). Верхняя фильтровальная бумажка служит фильтром, через который фильтруется раствор сернистого натрия от частичек угля, образовавшегося при обугливании вещества. На нижней фильтровальной бумажке появляются два бесцветных пятна. На одно из них наносят каплю раствора уксуснокислого свинца: мгновенно появляется коричневое окрашивание от образовавшегося сульфида свинца. На другое пятно наносят одну каплю свежеприготовленного раствора нитропруссида натрия Na2[Fe(CN)5(NO)], при этом тотчас появляется красно-фиолетовое окрашивание, постепенно изменяющее свой цвет. Эта цветная реакция на ион S 2- обусловлена образованием комплексной соли состава Na4[Fe(CN)5(NO)S]. Na2S + Na2[Fe(CN)5NO] → Na4[Fe(CN)5(NO)S]. Реактивы и материалы: хлороформ (или дихлорэтан); медная Галогены проще всего открываются по Бейльштейну – прокаливанием органического вещества с оксидом меди в пламени горелки. Медную проволоку длиной 10 см с петлей на конце прокаливают на пламени горелки до исчезновения посторонней окраски пламени (признак отсутствия загрязнения медной петли). Остывшую петлю, покрывшуюся черным налетом оксида меди, опускают в пробирку с 1-2 каплями испытуемого вещества, например хлороформа, и вновь вносят в пламя горелки. Немедленно появляется характерная ярко-зеленая окраска пламени. При прокаливании кислород оксида меди окисляет углерод и водород органического вещества в диоксид углерода и воду, медь же образует с галогеном летучие соединения, которые и окрашивают пламя горелки в зеленый цвет. Появление зеленого окрашивания указывает на присутствие в органическом соединении галогена. Чтобы очистить проволоку, ее смачивают соляной кислотой и снова прокаливают. Для открытия галогенов органическое вещество разрушают. При этом галогены переходят в неорганические соли, которые могут быть обнаружены обычными ионными реакциями. Галогены можно отщепить и перевести в соли галогеноводородных кислот методом А. В. Степанова – действием металлического натрия на спиртовой раствор органического вещества. Этот метод будет рассмотрен нами в дальнейшем. Лабораторная работа №8 Спирты Реактивы и материалы: реактив Лукаса; пропанол; 2-пропанол, спирт; трет-бутанол. Берут 3 пробирки, нумеруют восковым карандашом и приливают в каждую по 2 капли спирта (в первую – пропанол, во вторую – 2-пропанол и в третью – трет-бутанол). Затем в пробирки приливают по 5 капель реактива Лукаса (хлористый цинк, растворенный в концентрированной соляной кислоте), взбалтывают содержимое пробирок и оставляют стоять 1 мин. В пробирке с пропанолом спиртом раствор остается прозрачным, раствор 2-пропанола слегка мутнеет, а в пробирке с трет-бутанолом образуется на дне маслянистая капля. При помощи пробы Лукаса можно установить, является ли данный спирт первичным, вторичным или третичным: первичный спирт отается прозрачным, вторичный – мутнеет, а третичный вступает в химическую реакцию с образованием галогеналкила. Сформулируйте вывод по работе. Реактивы и материалы: этанол (ректификат); сульфат меди безводный (порошок). В сухую пробирку помещают несколько кристаллов безводного сульфата меди и добавляют 3-4 капли этанола спирта. Смесь хорошо встряхивают и слегка нагревают. Белый порошок быстро окрашивается в голубой цвет. Спирты содержат примесь растворенной воды. В обычном спирте-ректификате содержится около 5% воды, которую нельзя удалить перегонкой, так как ректификат является азеотропной смесью. Безводный сульфат меди, связывая воду, переходит в синий кристаллогидрат CuSO4*5H2O. По изменению окраски судят о наличии воды в спирте и о ходе обезвоживания спирта. Сформулируйте вывод по работе. Реактивы и материалы: изоамиловый спирт; раствор йода в KI, 0,1 н. В сухую пробирку помещают 2 капли изоамилового спирта и отмечают его запах. Изоамиловый спирт имеет специфический запах, он раздражает дыхательные пути (вызывает кашель). К 2 каплям изоамилового спирта добавляют 5 капель воды и взбалтывают. Образуется мутная жидкость – эмульсия, которая быстро расслаивается. В пробирку со смесью изоамилового спирта и воды добавляют каплю водного раствора йода в йодистом калии и взбалтывают. Йод растворяется в изоамиловом спирте лучше, чем в воде, поэтому при встряхивании переходит из водного в спиртовой слой, окрашивая его в желтый цвет. Сформулируйте вывод по работе. Реактивы и материалы: глицерин; сульфат меди, 0,2 н. раствор; едкий натр, 2 н раствор. Помещают в пробирку 2 капли раствора сульфата меди, 2 капли раствора едкого натра и перемешивают — образуется голубой студенистый осадок гидроксида меди (П). В пробирку добавляют 1 каплю глицерина и взбалтывают содержимое. Осадок растворяется и появляется темно-синее окрашивание вследствие образования глицерата меди.
Однако способность его образовывать металлические производные (глицераты) с многовалентными металлами объясняется не столько его повышенной кислотностью, сколько тем, что при этом образуются внутрикомплексные соединения, обладающие особой устойчивостью. Соединения такого типа часто называют хелатными(от греческого «хела» — клешня). Реактивы и материалы: этанол; фуксинсернистая кислота; спираль из медной проволоки, пинцет. В сухую пробирку помещают 2 капли этанола. Держа спираль из медной проволоки пинцетом, нагревают ее в пламени горелки до появления черного налета оксида меди (II). Далее горячую спираль опускают в пробирку с этанолом. Черная поверхность спирали немедленно становится золотистой вследствие восстановления оксида меди. При этом ощущается характерный запах этаналя (запах яблок). Подтверждением образования этаналя может служеть цветная реакция с фуксинсернистой кислотой. В пробирку помещают 3 капли раствора фуксинсернистой кислоты и пипеткой вносят 1 каплю полученного раствора. Появляется розово-фиолетовая окраска (цветная реакция на альдегид). Сформулируйте вывод по работе. Реактивы и материалы: этанол; дихромат калия, 0,5 н. раствор; серная кислота, 2 н. раствор. Окисление спиртов в лабораторных условиях чаще всего осуществляется хромовой смесью. В пробирку помещают 2 капли этанола, добавляют 1 каплю раствора серной кислоты и 2 капли раствора двухромовокислого калия. Оранжевый раствор нагревают над пламенем горелки до начала изменения окраски на синевато-зеленую. Одновременно ощущается характерный запах этаналя. Сформулируйте вывод по работе. Реактивы и материалы: этанол, 96%-ный; серная кислота. В сухую пробирку вносят 2 капли этанола и 2 капли серной кислоты. Смесь осторожно нагревают над пламенем горелки до побурения раствора. К горячей смеси очень осторожно добавляют еще 2 капли этанола. Ощущается характерный запах диэтилового эфира. Химизм процесса: C Реакция проходит в две стадии. Сначала спирт реагирует с серной кислотой, образуя кислый сложный эфир серной кислоты – этилсульфат, или этилсерную кислоту: Если спирт берется в избытке, то образуется простой эфир: Если в реакцию вступает относительно много серной кислоты и мало спирта, то при дальнейшем нагревании (до 160 о С) образуется олефин. Следовательно, в зависимости от темпрературы реакции и количественных соотношений спирта и серной кислоты возможны два случая дегидратации: а) с образованием этиленового углеводорода (внутримолекулярная дегидротация) и б) с образованием простого эфира (межмолекулярная дегидротация). Лабораторная работа №9 Фенолы Реактивы и материалы: раствор фенола. Помещают в пробирку 2 капли раствора фенола, прибавляют 2 капли воды и взбалтывают. Образуется мутная жидкость — эмульсия фенола. Дают содержимому пробирки отстояться. После отстаивания эмульсия постепенно расслаивается: верхний слой — раствор фенола в воде, нижний — раствор воды в феноле. Фенол плохо растворим в холодной воде. Осторожно нагревают содержимое пробирки. Получается однородный раствор. При охлаждении вновь образуется мутная жидкость. При повышении температуры увеличивается растворимость как воды в феноле, так и фенола в воде, и при 68°С они смешиваются друг с другом в любых соотношениях. Примечание. Простейший фенол С6Н5ОН представляет собой бесцветное кристаллическое вещество с характерным запахом, плавящееся при 41°С. Температура плавления фенола сильно понижается от примеси небольших количеств воды (кристаллогидрат С6Н6ОН*Н20 плавится при 16°С). Фенол гигроскопичен, кристаллы его при стоянии на воздухе расплываются, образуя так называемый жидкий фенол. Видео:7.4. Спирты: Химические свойства. ЕГЭ по химииСкачать  Обнаружение воды в спирте и обезвоживание спирта уравнение реакцииЯ буду вам признателен, если вы разместите кнопку этого сайта на своем ресурсе. Если вы хотите видеть свою кнопку на этом сайте, пишите в гостевой книге —> |
 |
—> —>
| —>Скачать е-книги —> |
| —> |
Скачать бесплатные электронные книги http://www.electrobook.ru
—>

—> —>
| —>География гостей —> |
| —> —> |
 |
—>
—>
Оборудование: этиловый спирт, обезвоженный сульфат меди (II), полученный прокаливанием кристаллогидрата CuSO 4 · 5Н 2 О, пробирка. Налейте в пробирку 3 мл спирта, добавьте туда немного обезвоженного сульфата меди и хорошо встряхните. Соль окрашивается в голубой цвет, что указывает на присутствие воды в спирте. Содержащаяся в спирте вода взаимодействует с обезвоженной солью, образуя кристаллогидрат CuSO 4 · 5Н 2 О ярко-голубого цвета. Видео:Обнаружение воды в спиртах и обезвоживание спиртов.Скачать  Экспериментальная часть. Опыт 1. Влияние радикала и количества гидроксильных групп на растворимость спиртовОпыт 1. Влияние радикала и количества гидроксильных групп на растворимость спиртов. В три пробирки внесите 4-5 капель этилового, изоамилового спиртов и глицерина. В каждую пробирку добавьте по 5-6 капель воды, взболтайте. Что наблюдали? Опыт 2.Обнаружение воды в этиловом спирте и его обезвоживание. В сухую пробирку внесите 10 капель этилового спирта, добавьте немного обезвоженного сульфата меди, тщательно перемешайте, дайте отстояться. Если спирт содержит воду, осадок сульфата меди окрасится в голубой цвет вследствии образования медного купороса СuSO4 · 5H2O. Сохраните обезвоженный спирт для дальнейшего опыта. Опыт 3. Образование этилата натрия. Поместите в сухую пробирку маленький кусочек натрия, добавьте 3 капли обезвоженного этилового спирта (из предыдущего опыта) и закройте отверстие пробирки пальцем. Тут же начинается выделение водорода. По окончании реакции, не отрывая пальца от отверстия пробирки, поднесите ее к пламени горелки. При открытии пробирки водород воспламеняется с характерным звуком, образуя колечко голубоватого цвета. На дне пробирки остается беловатый осадок этилата натрия или его раствор. При добавлении в пробирку 1 капли спиртового раствора фенолфталеина появляется красное окрашивание. Напишите уравнения протекающих реакций. Опыт 4. Окисление этилового спирта хромовой смесью. Введите в пробирку 3-4 капли этилового спирта. Добавьте 1 каплю 2н раствора серной кислоты и 2 капли 0,5н раствора бихромата калия. Полученный оранжевый раствор нагрейте над пламенем горелки до начала изменения цвета. Обычно уже через несколько секунд цвет раствора становится синевато-зеленым. Одновременно ощущается характерный запах уксусного альдегида, напоминающий запах яблок. Метод можно применять для распознавания первичных и вторичных спиртов. Напишите уравнения реакций. Опыт 5. Получение этилацетата. В сухую пробирку поместите немного порошка обезвоженного ацетата натрия (высота слоя около 2мм) и 3 капли этилового спирта. Добавьте 2 капли концентрированной серной кислоты и нагрейте осторожно над пламенем горелки. Через несколько секунд появляется характерный приятный освежающий запах уксусноэтилового эфира. Опыт 6.Реакция глицерина с гидроксидом меди (II) в щелочной среде. Поместите в пробирку 3 капли 0,2н раствора СuSO4, 2 капли 2н раствора NаОН и перемешайте. Появляется студенистый осадок гидроксида меди (II): При нагревании в щелочной среде до кипения полученный гидроксид меди (II) разлагается. Это обнаруживается по выделению черного осадка оксида меди (II): Повторите опыт, но перед кипячением гидроксида меди (II) добавьте в пробирку 1 каплю глицерина. Взболтайте. Нагрейте до кипения полученный раствор и убедитесь в том, что раствор глицерата меди при кипячении не разлагается. Здесь образуется хелатное соединение Опыт 7. Образовавние акролеина из глицерина. Поместите в пробирку 3-4 кристалла бисульфата калия и 1 каплю глицерина. Нагрейте на пламени горелки. Признаком начавшегося разложения глицерина служит побурение жидкости в пробирке и появление тяжелых паров образующегося акролеина, обладающего очень резким запахом. Опыт 8.Растворимость фенола в воде. Поместите в пробирку 1 каплю жидкого фенола, добавьте 1 каплю воды и взболтайте. Получится мутная жидкость – эмульсия фенола. При стоянии такая эмульсия расслаивается, причем внизу будет раствор воды в феноле, или жидкий фенол, а вверху – раствор фенола в воде, или карболовая вода. Прибавляйте по каплям воду, каждый раз встряхивая пробирку, пока не получится прозрачный раствор фенола в воде. Сохраните полученную фенольную воду для последующих опытов. Опыт 9.Цветные реакции на фенольную воду. Поместите в пробирку 3 капли прозрачной фенольной воды и добавьте 1 каплю 0,1н раствора FeCl3 – появляется фиолетовое окрашивание. Более чувствительной реакцией на фенол является цветная индофеноловая Поместите в пробирку 1 каплю прозрачной карболовой воды. Добавьте к ней 3 капли 2н раствора NН4ОН и затем 3 капли насыщенного раствора бромной воды. Через несколько секунд на белом фоне бумаги можно заметить синее окрашивание, постепенно увеличивающееся за счет образования красящего вещества – индофенола. Опыт 10.Образование трибромфенола. Поместите в пробирку 3 капли бромной воды и добавьте 1 каплю прозрачной карболовой воды. Фенолы со свободными орто- и пара-положениями обесцвечивают бромную воду и образуют при этом продукты замещения, которые обычно выпадают в осадок. Опыт 11.Доказательство кислотного характера фенола. К остатку фенольной воды добавьте еще 1 каплю фенола и встряхните. К вновь полученной эмульсии добавьте 1 каплю 2н раствора NаОН. Моментально образуется прозрачный раствор фенолята натрия, так как он хорошо растворяется в воде. §10. Задачи для самостоятельного решения. 1. Напишите структурные формулы следующих соединений: 3-метил-2-пентанол; 2-метил-3-бутин-2-ол; 1-фенилпропанол-1. 2. Реакцией Гриньяра получите следующие спирты: 3. Получите гидратацией соответствующих этиленовых углеводородов а) 2-метилпентанол-2; б) 3,3-диметилбутанол-2. 4. Напишите реакции окисления вторичного бутилового спирта; 5. Подвергните 2-пентанол дегидратации, затем продукт реакции окислите водным раствором перманганата калия. Полученное соединение обработайте уксусной кислотой. Напишите уравнения реакций и назовите все продукты. 6. Получите фенол из бензола и 1-бутена через стадию образования гидроперекиси втор.бутила. 7. Опишите схему следующих превращений: 8. Расположите следующие соединения в порядке убывания кислотных свойств: 📺 ВидеоОбнаружение воды в спиртах и обезвоживание спиртов.Скачать  Несколько лайфхаков со спиртом. Химия – просто.Скачать  Спирт и вода. Испарение (видео 5) | Биологическая роль воды | БиологияСкачать  Химия. Растворимость спиртов в воде, горение спиртов, качественные реакцииСкачать  Опыты по химии. Сравнение свойств спиртов в гомологическом рядуСкачать  Абсолютный спирт. Химия – ПростоСкачать  Химия 9 класс (Урок№30 - Производные углеводородов. Спирты.)Скачать  Получение этилового спирта по наукеСкачать  Химия 10 класс (Урок№6 - Одноатомные предельные спирты.)Скачать  Опыты по физике. Уменьшение объема при смешивании воды и спиртаСкачать  Вода + спирт (суммарное уменьшение объема)Скачать  10 класс - Химия - Химические свойства этанола. Применение на базе свойствСкачать  7.1. Спирты: Номенклатура, классификация, изомерия. ЕГЭ по химииСкачать  Классификация и химические свойства спиртов. Практическая часть. 10 класс.Скачать  Разбавление спирта с водой от А до ЯСкачать  Видеоурок по химии "Понятие о спиртах"Скачать  Как получить этиловый спирт?Скачать  Эксперимент с маслом в спирте (форма жидкости)Скачать  |
 сухую пробирку 1(рис. 8) насыпают черный порошок оксида меди (слой высотой около 5 мм). Добавляют половину микролопатки глюкозы и тщательно перемешивают, встряхивая пробирку. В верхнюю часть пробирки помещают небольшой комочек ваты, на который насыпают немного белого порошка безводного сульфата меди (II). Пробирку закрывают пробкой с газоотводной трубкой. При этом конец трубки должен почти упираться в вату с CuSО4.
сухую пробирку 1(рис. 8) насыпают черный порошок оксида меди (слой высотой около 5 мм). Добавляют половину микролопатки глюкозы и тщательно перемешивают, встряхивая пробирку. В верхнюю часть пробирки помещают небольшой комочек ваты, на который насыпают немного белого порошка безводного сульфата меди (II). Пробирку закрывают пробкой с газоотводной трубкой. При этом конец трубки должен почти упираться в вату с CuSО4.

 2H5-OH + HO-C2H5 C2H5–O–C2H5 + H2O
2H5-OH + HO-C2H5 C2H5–O–C2H5 + H2O СН3С(О)ОNа + НОSО3Н NаНSО4 + СН3С(О)ОН
СН3С(О)ОNа + НОSО3Н NаНSО4 + СН3С(О)ОН С2Н5ОН + НОSО3Н Н2О + С2Н5ОSО3Н
С2Н5ОН + НОSО3Н Н2О + С2Н5ОSО3Н СН3С(О)ОН + НОSО3Н Н2SО4 + СН3С(О)О С2Н5
СН3С(О)ОН + НОSО3Н Н2SО4 + СН3С(О)О С2Н5