В современной науке наблюдается тенденция объединения различных отраслей знания. Приметой времени можно считать появление биофизики, биохимии, физической химии, космической медицины и т.п.
К сожалению, часто приходится наблюдать, что учащиеся не могут применить знания, полученные на уроках химии и физики, при анализе закономерностей, изучаемых на уроках биологии. Эти предметы им кажутся несовместимыми.
Предлагаем обобщающий урок-семинар, раскрывающий взаимосвязь биологии, химии и физики. На уроке рассмотрены строение, свойства и значение белков с точки зрения химии, биологии и физики.
Такие занятия имеют большое значение в формировании научного мировоззрения учащихся.
Задачи урока. Познавательные. Сформировать знания о белках как макромолекулах – биополимерах, о мономерах белков, о свойствах и функциях белков, их ведущей роли в процессах жизнедеятельности; рассказать о физических методах познания природы, в частности биологических микросистем; обобщить знания, получаемые учащимися на уроках химии и биологии по теме «Белки», с использованием физических теорий.
Развивающие. Развивать умения анализировать результаты лабораторных опытов, устанавливать причинно-следственные связи между явлениями живой и неживой природы, развивать познавательный интерес учащихся на основе межпредметных связей, научить применять знания, получаемые на одном предмете, при анализе явлений или процессов, изучаемых другими предметами.
Воспитательные. Формировать научное мировоззрение, представление о роли естественных наук в современном обществе, целостную картину мира.
Оборудование и реактивы. Эпипроектор, графопроектор, экран, опорный конспект, таблица «Элементный состав белков», схемы «Способы классификации белков», «Классификация белков по составу» и другие, модели молекул, таблички с вопросами учащимся; реактивы для проведения практической части.
Оформление доски. На доске цветными мелками изображен опорный конспект урока.
Эпиграф. «Мыслящий ум не чувствует себя счастливым, пока ему не удастся связать воедино разрозненные факты, им наблюдаемые» (Д.Хевеши).
План
Значимость белков.
Строение белков.
Классификация белков.
Свойства белков.
Белок и окружающая среда.
Итог урока.
ХОД УРОКА
Учитель химии. Сегодня мы рассмотрим белки с разных сторон, чтобы связать воедино разрозненные сведения об этих веществах. Чем же удивительны белки?
Учитель биологии. С чем связана тайна жизни? Важную, а может быть, и главную роль во всех жизненных процессах играют белки. Белки составляют 10–18% от общей массы клетки. В каждой клетке находится более 3000 молекул белков. В организме человека насчитывается свыше 10 млн белков. В клетках белки играют важнейшую роль. Есть белки – переносчики веществ, ионов, протонов, электронов; есть биокатализаторы, есть регуляторы разнообразных процессов в клетках и организмах. Важную роль играют опорные и сократительные белки. Белки защищают организм от инфекции. Контакты клетки с внешней средой выполняют разнообразные белки, умеющие различать форму молекул, регистрировать температурные изменения, ничтожные примеси веществ, отличать один цвет от другого. Уже из этого можно сделать вывод: наиболее важными органическими соединениями клетки являются белки.
Для понимания функций белков в клетке, обеспечивающих ее жизнедеятельность, необходимо знать строение белковых молекул.
Учитель химии. Вещества белковой природы известны с давних времен. Начало их изучению положено в середине XVIII в. итальянцем Я.Б.Беккари, который предложил углеродную теорию. Через 100 лет ученые пришли к выводу, что белки – главный компонент живых организмов. Затем из белковых гидролизатов были получены продукты расщепления, и возникла гипотеза о том, что белки состоят из остатков аминокислот (А.Я.Данилевский). Над проблемой строения белков долгое время работал Э.Г.Фишер. На основе его работ была создана полипептидная теория строения белков. Было доказано, что в состав белков входят атомы углерода, водорода, кислорода, азота, серы, фосфора и другие (табл.).
- Элементный состав белков
- Вопросы по строению белков
- Способы классификации белков
- Вопросы по классификации белков
- Каталитическая функция белков
- Опыт 2. Наблюдение расщепления пероксида водорода ферментом каталазой
- Защитная функция белков
- Физические свойства белков
- Химические свойства белков
- Опыт 3. Биуретовая реакция
- Опыт 4. Ксантопротеиновая реакция
- Опыт 5. Обнаружение белка в мясном бульоне
- Опыт 6. Обнаружение натуральной шерсти
- Вопросы по свойствам белков
- Опыт 7. Действие этилового спирта на белок
- Вопросы по разделу «Белок и окружающая среда»
- Цветные и именные качественные реакции на белки
- ЦВЕТНЫЕ И ИМЕННЫЕ КАЧЕСТВЕННЫЕ РЕАКЦИИ
- НА БЕЛКИ
- Ксантопротеиновая реакция (Мульдера)
- 📸 Видео
Элементный состав белков
| Элемент | Содержание, % |
|---|---|
| C | 50–55 |
| H | 6,5–7,3 |
| O | 19–24 |
| N | 15–19 |
| S | 0,2–2,4 |
Особенно характерен для белков 15–18%-й уровень содержания азота. На заре белковой химии этот показатель играл большую роль при решении вопроса о принадлежности высокомолекулярного вещества к классу белков.
Чтобы доказать наличие азота и серы в курином белке, выполните опыт. Сделайте вывод и запишите его в тетрадь.
К раствору белка добавить крепкий раствор щелочи и нагреть. Выделяется аммиак, который обнаруживается по посинению влажной лакмусовой бумажки. После нагревания раствор разбавить в 3–4 раза водой и прилить раствор ацетата свинца, образуется осадок сульфида свинца.
Учитель химии. Согласно полипептидной теории белки имеют первичную, вторичную, третичную, а некоторые и четвертичную структуру. Послушайте сообщение о первичной структуре белка.
Ученик. Под первичной структурой белка понимают последовательность расположения аминокислотных остатков в одной или нескольких полипептидных цепях, составляющих молекулу белка. Если принять аминокислоту за бусинку, то даже из небольшого числа бусинок можно составить несколько разных сочетаний. (Демонстрирует несколько бус, собранных из одинаковых бусинок трех цветов.) Так и в молекуле белки образуют большое число изомеров (рис. 1).
 | |||||||||||||||||||||
 | ||||||||||||||||||||
 | |||||||||||||||||||
 | ||||||||||||||||||
 | |||||||||||||||||
 | ||||||||||||||||
 | |||||||||||||||
 | ||||||||||||||
| № | Название реакции | Применяемые реактивы | Появление окрашивания | Что открывает данная реакция, её химизм |
Практическая часть.
Биуретовая реакция
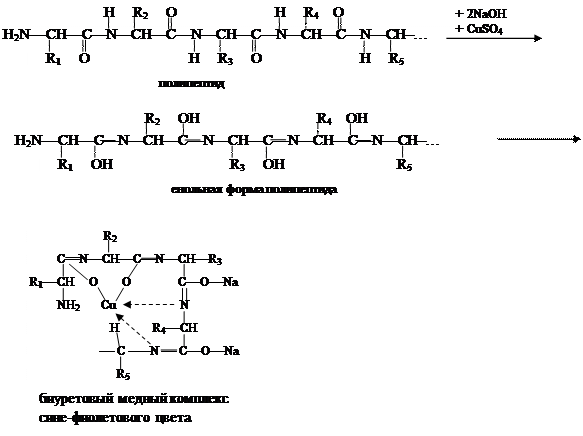 |
Принцип метода.Биуретовая реакция открывает пептидную связь в белке. В щелочной среде раствор белка при взаимодействии с ионами меди приобретает сине–фиолетовый цвет, а продукты неполного гидролиза его — пептоны — розовое окрашивание. Биуретовую реакцию способны давать вещества, которые содержат не менее двух пептидных связей. Биуретовая реакция схематично протекает так:
Енольная форма полипептида, образованная в сильно щелочной среде, дает отрицательный заряд, и кислород, взаимодействуя с медью, образует ковалентную связь, а, взаимодействуя с атомами азота, медь образует координационные связи. Степень окраски биуретового комплекса зависит от концентрации белка и количества медной соли в растворе. Нельзя добавлять избыток сульфата меди, так как синий осадок гидрата окиси меди маскирует характерное фиолетовое окрашивание биуретового комплекса белка.
Отдельные аминокислоты, такие как гистидин, серин, трионин, аспарагин дают положительную биуретовую реакцию при условии больших концентраций их в растворе.
 |
Примечание: биуретовая реакция получила свое название от производного мочевины — биурета. Биурет, имеющий группировку –CO-NH- образуется при нагревании мочевины с отщеплением от неё аммиака и дает то же окрашивание, что и белки.
|

 |
Как можно видеть из приведенной выше формулы, биурет в щелочной среде претерпевает полную енолизацию по схеме:
 |
Реактивы: раствор яичного белка (1—2 белка куриных яиц отделяют от желтков, взбалтывают с 1 л воды); едкий натр 10% раствор; сернокислая медь 1% раствор.
Ход работы: к 5 каплям раствора белка прибавляют 3 капли 10% раствора едкого натра и 1 каплю сернокислой меди, перемешивают; содержимое пробирки приобретает фиолетовый цвет.
Нингидриновая реакция.
Принцип метода.Нингидриновая реакция характерна для аминокислот, чья аминогруппа находится в α-положении, а также белков и полипептидов. Аминокислоты, полипептиды, белки при кипячении с водным раствором нингидрина дают синее или сине-фиолетовое окрашивание. В результате взаимодействия α-аминокислоты с нингидрином образуется шиффово основание, которое перегруппировывается, декарбоксилируется и расщепляется на альдегид и аминодикетогидринден. Химизм реакции с водным раствором нингидрина следующий:
 |
Аминодикетогидринден конденсируется ещё с одной молекулой нингидрина. Образовавшееся соединение, енолизируясь, переходит в окрашенную форму, получившую название «сине-фиолетовый комплекс Руэмана», формула которого
 |
Реактивы: раствор яичного белка, нингидрин, 0,1 % раствор.
Ход работы: к 5 каплям раствора белка приливают 5 капель раствора нингидрина, кипятят 1-2 минуты. Появляется сине-фиолетовое окрашивание. С течением времени раствор синеет.
Примечание: нингидриновая реакция со спиртовым раствором нингидрина широко используется для разделения аминокислот хроматографическим методом, для открытия отдельных аминокислот и определения их количества. В присутствии органических растворителей образовавшееся шиффово основание не распадается, поскольку в соединении нет воды. Конденсируясь с нингидрином, оно содержит в своем составе радикал исходной аминокислоты, который обусловливает различную окраску: синюю, фиолетовую, а в присутствии пролина — желтую.
Ксантопротеиновая реакция (Мульдера).
 |
Принцип метода.Ксантопротеиновая реакция доказывает присутствие в белке ароматических аминокислот: триптофана, фенилаланина, тирозина. При обработке раствора белка концентрированной азотной кислотой появляется желтое окрашивание (нитрование), которое при добавлении щелочи переходит в оранжевое. Химизм реакции нитрования с образованием нитросоединения следующий:
Реактивы: раствор яичного белка; раствор тирозина 0,05 %; раствор желатина; азотная кислота концентрированная; аммиак концентрированный.
Ход работы:Берут 3 пробирки. В первую вносят 4 капли раствора тирозина, во вторую — 4 капли раствора желатина, в третью — столько же раствора яичного белка. В каждую пробирку добавляют по 2 капли азотной кислоты. Нагревают пробирки и отмечают появление желтого окрашивания. После охлаждения добавляют в каждую пробирку по 5-7 капель водного раствора аммиака, при этом желтая окраска сменяется на оранжевую.
Примечание: реакция носит название ксантопротеиновой от греческого xanthos — желтый. Реакция обеспечивает появление желтого окрашивания при попадании конц. азотной кислоты на кожу, ногти и т.д. Такую реакцию дают более простые ароматические соединения, например, фенолы. Желатин, сальмин, клупеин (протамины) дают отрицательную реакцию, так как в них отсутствуют ароматические аминокислоты.
Реакция Фоля.
Принцип метода.Реакция Фоля указывает на присутствие в белке аминокислот цистеина и цистина, содержащих слабосвязанную серу. Метионин, хотя и является содержащей серу аминокислотой, данной реакции не дает, поскольку сера в нем связана прочно. Реакция состоит в том, что при кипячении белка со щелочью аминокислоты цистеин и цистин легко отщепляют серу в виде сульфида металла, который с плюмбитом дает черный или бурый осадок сернистого свинца.
Реактив Фоля состоит из 5 % раствора уксуснокислого свинца и избытка 10 % раствора едкого натрия. Реакция протекает в реактиве Фоля по следующим уравнениям:
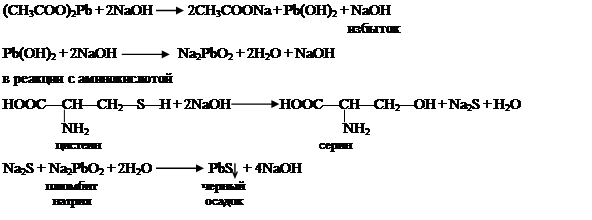 |
Реактивы: раствор яичного белка; реактив Фоля (к 5-10 % раствору уксуснокислого свинца добавляют раствор едкого натра до растворения).
Ход работы: к 5 каплям раствора белка добавляют 5 капель реактива Фоля. Интенсивно прокипятить и дать постоять 1-2 минуты. При этом появляется черный или бурый осадок сульфида свинца.
📸 Видео
Биохимия. Лекция 43. Переваривание белков. 1 частьСкачать

Экзамен по биохимии | БЕЛКИСкачать

Вторичная структура белкаСкачать
БЕЛКИ: строение, функции, классификация, аминокислоты / БиохимияСкачать

ЛЕКЦИЯ 4. АМИНОКИСЛОТЫ, БЕЛКИСкачать

Определение протеина по методу КьельдаляСкачать

Химия 10 класс (Урок№12 - Аминокислоты. Белки.)Скачать

Аминокислоты. Белки. 1 часть. 9 класс.Скачать

Гладилин А. К. - Биохимия - Катаболизм аминокислот, выведение азотаСкачать

2.17. Строение аминокислот и структуры белков | Цитология к ЕГЭ | Георгий МишуровскийСкачать

 Значимость белков.
Значимость белков.  -спирали
-спирали 





 сравнима со средней плотностью водной оболочки нашей планеты. Это позволяет человеку удерживаться на поверхности воды при минимальныx затратах энергии (уравновешивание силы тяжести и Архимедовой силы – условие плавания тел).
сравнима со средней плотностью водной оболочки нашей планеты. Это позволяет человеку удерживаться на поверхности воды при минимальныx затратах энергии (уравновешивание силы тяжести и Архимедовой силы – условие плавания тел). в.
в.



 -структура, рис. 9).
-структура, рис. 9).
 2 /2 = 3/2kT). Поэтому повышение температуры (увеличение внутренней энергии движения) вызывает увеличение амплитуды колебаний атомов звеньев структуры. Следовательно, увеличивается расстояние между атомами, связываемыми водородной связью. При больших амплитудах колебаний водородная связь разрушается, при этом увеличивается нагрузка на соседние связи спиральной структуры, и в конечном итоге структура белка быстро распадается (рис. 10).
2 /2 = 3/2kT). Поэтому повышение температуры (увеличение внутренней энергии движения) вызывает увеличение амплитуды колебаний атомов звеньев структуры. Следовательно, увеличивается расстояние между атомами, связываемыми водородной связью. При больших амплитудах колебаний водородная связь разрушается, при этом увеличивается нагрузка на соседние связи спиральной структуры, и в конечном итоге структура белка быстро распадается (рис. 10).
 —лучами (рис. 11). Испускание
—лучами (рис. 11). Испускание 















