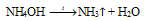Обращаем Ваше внимание, что в соответствии с Федеральным законом N 273-ФЗ «Об образовании в Российской Федерации» в организациях, осуществляющих образовательную деятельность, организовывается обучение и воспитание обучающихся с ОВЗ как совместно с другими обучающимися, так и в отдельных классах или группах.
Рабочие листы и материалы для учителей и воспитателей
Более 2 500 дидактических материалов для школьного и домашнего обучения
Практическая работа №3
« Получение аммиака и изучение его свойств»
Получение аммиака и растворение его в воде.
В фарфоровой чашке перемешайте по 1 мерной ложечке кристаллического хлорида аммония и гидроксида кальция. Поместите в пробирку и закройте ее пробкой с газоотводной трубкой, на конец которой наденьте сухую пробирку. Смесь нагрейте. Осторожно снимите пробирку с газоотводной трубки, закрыв ее большим пальцем и не убирая его, опустите пробирку с аммиаком в кристаллизатор с водой. Вновь закройте пробирку под водой пальцем, извлеките из кристаллизатора и переверните.
Задание. 1. О выделении какого газа свидетельствует ваши наблюдения? Напишите уравнения соответствующих реакций. 2. Какое вещество образуется при растворении полученного газа в воде? Какие наблюдения подтверждают этот вывод? Напишите уравнения данной реакции.
Свойства водного раствора аммиака.
В две пробирки налейте водный раствор аммиака. В одну из них опустите универсальную индикаторную бумажку. В другую добавьте несколько капель раствора фенолфталеина, а затем немного разбавленной соляной кислоты.
Задание. 1. О каких свойствах водного раствора аммиака свидетельствует его действие на индикаторы? Как это можно объяснить с позиции теории электролитической диссоциации? 2. Что происходит при действии на водный раствор аммиака кислоты? 3. Составьте уравнение соответствующей химической реакции в молекулярном, полном ионном и сокращенном ионном виде.
- Получение аммиака и изучение его физических и химических свойств
- Получение аммиака.
- Изучение свойств аммиака
- Изучение свойств водного раствора аммиака.
- Практическая работа «Получение аммиака и изучение его свойств» методическая разработка по химии (9 класс) на тему
- Скачать:
- Предварительный просмотр:
- По теме: методические разработки, презентации и конспекты
- 🎦 Видео
Видео:Химия. 9 класс. Получение аммиака. Производство аммиака /19.02.2021/Скачать

Получение аммиака и изучение его физических и химических свойств
Видео:Химия 9 класс (Урок№14 - Азот: свойства и применение. Аммиак. Физические и химические свойства.)Скачать

Получение аммиака.
Проведем все действия, описанные в учебнике. Из газоотводной трубки будет выделяться аммиак. Он растворяется в воде, пропитавшей фенолфталеиновую бумажку. Уравнение реакции имеет вид:
В результате образуется гидроксид аммония, который имеет щелочную реакцию окрашивает индикатор в малиновый цвет.
Изучение свойств аммиака
Если поднести к отверстию пробки стеклянную палочку, смоченную концентрированной соляной кислотой, то над отверстием образуется белая дымка. Происходит реакция:
NH4Cl обладает летучестью, его частички поднимаются вместе с аммиаком. Их мы и видим в виде белой дымки. Проведем растворение аммиака так как это описало в учебнике. Из-за очень хорошей растворимости аммиака вода в пробирке поднимается. Образуется NH4OH.
1. Запишем уравнение реакции между Са(ОН)2 и NH4Cl:
Как можно видеть из уравнения, в реакции образуются пары воды. Они конденсируются на более холодных стенках пробирки. Если капельки воды попадут на раскалённое дно, то пробирка может треснуть. Поэтому ее наклоняют таким образом, чтобы капельки скатывались к отверстию пробирки.
2. Аммиак легче воздуха (т.к. М(NH3) = 17 г/моль.
М(воздуха) = 29 г/моль). Он поднимается вверх, поэтому его надо собирать в перевернутую пробирку. Аналогично можно собирать Н2 (М = 2 г/моль), СН4 — метан (М= 16 г/моль); Не (М= 4г/моль) и другие.
З. Если вместо НСl поднести к отверстию пробирки с аммиаком палочку, смоченную концентрированной азотной кислотой, то мы ничего не увидим:
NH4NO3 — не обладает летучестью.
4. Обычно для определения оснований используют реакции с образованием нерастворимых гидроксидов, например, Mg(OH)2. Уравнение реакции имеет вид:
Выпадает белый осадок.
Изучение свойств водного раствора аммиака.
1. Водный раствор аммиака имеет щелочную среду, т.е. дает малиновую окраску с фенолфталеином. При кипячении раствора гидроксид аммония разлагается, в результате чего аммиак улетучивается, а раствор становится нейтральным.
Фенолфталеин в нейтральной среде — бесцветный.
2. Фенолфталеин дает малиновую окраску в растворе гидроксида аммония, так как тот является основанием. При добавлении соляной кислоты происходит нейтрализация раствора и цвет исчезает.
3. Происходит взаимодействие между раствором АlCl3 и NH4OH.
Видео:Аммиак и соли аммония. Видеоурок 29-30. Химия 9 классСкачать

Практическая работа «Получение аммиака и изучение его свойств»
методическая разработка по химии (9 класс) на тему
Практическая работа
«Получение аммиака и изучение его свойств»
Инструкция к практической работе, форма оформления отчета, дополнительные задания к теме.
Видео:Горение аммиака в кислородеСкачать

Скачать:
| Вложение | Размер |
|---|---|
| prakticheskaya_rabota_pol-1_ammiaka.doc | 39.5 КБ |
Видео:Соли аммонияСкачать

Предварительный просмотр:
«Получение аммиака и изучение его свойств»
Цель: Получить аммиак и ознакомиться со свойствами водного раствора аммиака.
Оборудование: лабораторный штатив, сухие пробирки, пробка с газоотводной трубкой, ступка, ложки для сыпучих веществ, спиртовка, спички, стакан с водой.
Реактивы: кристаллический гидроксид кальция, кристаллический хлорид аммония, раствор соляной кислоты, раствор ф – ф.
Уравнения реакций в молекулярном, полном и сокращенном ионном виде
1. Получение аммиака и исследование его физических свойств.
Получаем аммиак нагреванием смеси гидроксида кальция и хлорида аммония в пробирке
Собираем аммиак в пробирку дном .
Разрыхление реакционной массы.
Образование тумана.
Индикаторная бумага окрасилась в .
О выделении какого газа свидетельствуют наблюдения ?
Написать уравнение реакции:
Ca(OH) 2 + NH 4 Cl = . + NH 3 ↑ + .
Физические свойства аммиака: . Аммиак . воздуха, поэтому сухая пробирка – приемник находится дном. .
2. Исследование химических свойств аммиака
1 . Растворение аммиака в воде.
.Изучение кислотно-основных свойств водного раствора аммиака.
3. Взаимодействие с кислотами:
Сняв с газоотводной трубки прибора пробирку, помещаем её в химический стакан с водой.
Убираем из стакана пробирку и в образовавшийся раствор добавляем фенолфталеин .
В стакан с водным раствором аммиака в присутствии фенолфталеина вливают 1мл раствора серной кислоты
Пробирка наполняется водой.
Написать уравнение реакции, назвать образующееся вещество:
NH 4 OH + H + + . = NH 4 + + . + .
NH 4 OH + H + = NH 4 + + H 2 O
Аммиак . растворим в воде . Продукт взаимодействия аммиака с водой называется . . Относится к классу . . Механизм образования химической связи в катионе . . Тип реакции . .
Почему исчезла первоначальная окраска раствора?
Название продукта взаимодействия гидроксида аммония с соляной кислотой . . К какому классу относится продукт реакции? .
4. Окислительно-восстановительные свойства аммиака
На основе электронного баланса написать уравнение реакции, определить окислитель и восстановитель:
а) Горение аммиак без катализатора
б) Горение аммиак в присутствии катализатора
Какие вещества образуются в процессе горения аммиака а) без катализатора; б) в присутствии катализатора?
1) Какая масса хлорида аммония получится при взаимодействии 3 моль аммиака с соляной кислотой?
2) Какой объем кислорода потребуется для сжигания 34 г аммиака?
3) Закончите уравнения химических реакций, дайте названия продуктам реакций:
б) NH 3 + H 2 SO 4 = .
в) NH 3 + H 2 SO 4 = .
г) NH 3 + H 3 PO 4 = .
Видео:Аммиак. Химия 9 классСкачать

По теме: методические разработки, презентации и конспекты
Практическая работа «Получение аммиака и изучение его свойств»
Практическая работа № 2 9 класс.
Практическая работа «Получение кислорода и изучение его свойств»
Практическая работа № 2 8 класс.
Практическая работа «Получение аммиака и изучение его свойств».
При проведении практической работы должны показать умения Ø составлять технологическую карту;Ø применять теоретические знания о свойствах и лабораторном способе получения аммиака, при.
Инструкционная карта к практической работе «Получение аммиака и изучение его свойств»
Инструкционная карта выдается ученикам на урок-практикум. В карте представлена схема сбора прибора для получения газа, даны подробные инструкции по работе, представлена таблица для оформления ра.
Практическая работа «Получение водорода и изучение его свойств»
УМК Н.Е. Кузнецовой.
Практическая работа » Получение водорода и изучение его свойств»
В данной работе представлена презентация и технологическая карта к уроку в 8 классе по учебнику «Химия.8» автора О.С. Габриелян.
🎦 Видео
Аммиак: как образуется и с чем реагирует? #аммиак #химия #видеоурок #егэхимияСкачать

Аммиак. 9 класс.Скачать

Практическая работа получение аммиакаСкачать

Химия | Решение задач на газыСкачать

Практическая работа №6. Получение аммиака и опыты с ним. 9 класс.Скачать

Аммиак. Химические свойства. Соли аммония | ХимияСкачать

Получение аммиака в лаборатории. Задание 14. Химия ОГЭСкачать

Промышленное получение аммиака. 11 класс.Скачать

Химия. 9 класс. Аммиак. Применение аммиака /12.02.2021/Скачать

Химия. 9 класс. Свойства и получение аммиака /17.02.2021/Скачать

Получение аммиака. Химический опытСкачать

Получение аммиакаСкачать

Реакция аммиака с сульфатом меди. Химический опытСкачать

Аммиак 9 классСкачать