Обращаем Ваше внимание, что в соответствии с Федеральным законом N 273-ФЗ «Об образовании в Российской Федерации» в организациях, осуществляющих образовательную деятельность, организовывается обучение и воспитание обучающихся с ОВЗ как совместно с другими обучающимися, так и в отдельных классах или группах.
Рабочие листы и материалы для учителей и воспитателей
Более 300 дидактических материалов для школьного и домашнего обучения
«Получение аммиака и изучение его свойств»
Цель: Получить аммиак и ознакомиться со свойствами водного раствора аммиака.
Оборудование: лабораторный штатив, сухие пробирки, пробка с газоотводной трубкой, ступка, ложки для сыпучих веществ, спиртовка, спички, стакан с водой.
Реактивы: кристаллический гидроксид кальция, кристаллический хлорид аммония, раствор соляной кислоты, раствор ф – ф.
Уравнения реакций в молекулярном, полном и сокращенном ионном виде
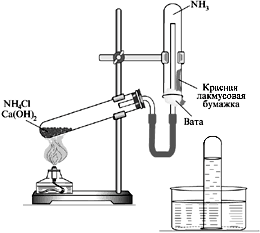
1. Получение аммиака и исследование его физических свойств.
Получаем аммиак нагреванием смеси гидроксида кальция и хлорида аммония в пробирке

Собираем аммиак в пробирку дном .
Разрыхление реакционной массы.
Образование тумана.
Индикаторная бумага окрасилась в .
О выделении какого газа свидетельствуют наблюдения ?
Написать уравнение реакции:
Физические свойства аммиака: . Аммиак . воздуха, поэтому сухая пробирка – приемник находится дном. .

2. Исследование химических свойств аммиака
1 . Растворение аммиака в воде.
.Изучение кислотно-основных свойств водного раствора аммиака.
3. Взаимодействие с кислотами:
Сняв с газоотводной трубки прибор а пробирку, помещаем её в химический стакан с водой.
Убираем из стакана пробирку и в образовавшийся раствор добавляем фенолфталеин .
В стакан с водным раствором аммиака в присутствии фенолфталеина вливают 1 мл раствора серной кислоты
Пробирка наполняется водой.
Написать уравнение реакции, назвать образующееся вещество:
Аммиак . растворим в воде . Продукт взаимодействия аммиака с водой называется . . Относится к классу . . Механизм образования химической связи в катионе . . Тип реакции . .
Почему исчезла первоначальная окраска раствора?
Название продукта взаимодействия гидроксида аммония с соляной кислотой . . К какому классу относится продукт реакции? .
4. Окислительно-восстановительные свойства аммиака
На основе электронного баланса написать уравнение реакции, определить окислитель и восстановитель:
а) Горение аммиак без катализатора
б) Горение аммиак в присутствии катализатора
Какие вещества образуются в процессе горения аммиака а) без катализатора; б) в присутствии катализатора?
1) Какая масса хлорида аммония получится при взаимодействии 3 моль аммиака с соляной кислотой?
2) Какой объем кислорода потребуется для сжигания 34 г аммиака?
3) Закончите уравнения химических реакций, дайте названия продуктам реакций:
Курс повышения квалификации
- Дистанционное обучение как современный формат преподавания
- Педагогическая деятельность в контексте профессионального стандарта педагога и ФГОС
- Инструменты онлайн-обучения на примере программ Zoom, Skype, Microsoft Teams, Bandicam
- Дистанционные курсы для педагогов
- Найдите материал к любому уроку, указав свой предмет (категорию), класс, учебник и тему:
- Материал подходит для УМК
- Другие материалы
- Вам будут интересны эти курсы:
- Оставьте свой комментарий
- Автор материала
- Дистанционные курсы для педагогов
- Подарочные сертификаты
- Практическая работа «Получение аммиака и изучение его свойств»
- Просмотр содержимого документа «Практическая работа «Получение аммиака и изучение его свойств»»
- Please wait.
- We are checking your browser. gomolog.ru
- Why do I have to complete a CAPTCHA?
- What can I do to prevent this in the future?
- 📽️ Видео
Дистанционное обучение как современный формат преподавания
- Сейчас обучается 864 человека из 78 регионов
Курс повышения квалификации
Педагогическая деятельность в контексте профессионального стандарта педагога и ФГОС
- Сейчас обучается 48 человек из 23 регионов
Курс повышения квалификации
Инструменты онлайн-обучения на примере программ Zoom, Skype, Microsoft Teams, Bandicam
- Курс добавлен 31.01.2022
- Сейчас обучается 39 человек из 23 регионов
«Профессиональный имидж педагога: стереотипы и методы их преодоления»
Свидетельство и скидка на обучение каждому участнику
«Мотивация здорового образа жизни. Организация секций»
Свидетельство и скидка на обучение каждому участнику
- Для всех учеников 1-11 классов
и дошкольников - Интересные задания
по 16 предметам
Видео:Получение ГИДРОКСИДА КАЛЬЦИЯ Ca(OH)2. Растворение КАЛЬЦИЯ в ВОДЕ. Опыты по химии дома. ЭкспериментыСкачать

Дистанционные курсы для педагогов
Самые массовые международные дистанционные
Школьные Инфоконкурсы 2022
33 конкурса для учеников 1–11 классов и дошкольников от проекта «Инфоурок»
Найдите материал к любому уроку, указав свой предмет (категорию), класс, учебник и тему:
5 839 193 материала в базе
Материал подходит для УМК
«Химия», Габриелян О.С.
Ищем педагогов в команду «Инфоурок»
Другие материалы
- 31.10.2021
- 40
- 0
- 30.10.2021
- 132
- 2
- 30.10.2021
- 66
- 0
- 30.10.2021
- 47
- 0
- 30.10.2021
- 80
- 0
- 30.10.2021
- 69
- 0
- 30.10.2021
- 182
- 3
- 30.10.2021
- 129
- 12
Вам будут интересны эти курсы:
Оставьте свой комментарий
Авторизуйтесь, чтобы задавать вопросы.
Добавить в избранное
- 31.10.2021 1526
- DOCX 39.5 кбайт
- 11 скачиваний
- Оцените материал:
Настоящий материал опубликован пользователем Киселева Елена Юрьевна. Инфоурок является информационным посредником и предоставляет пользователям возможность размещать на сайте методические материалы. Всю ответственность за опубликованные материалы, содержащиеся в них сведения, а также за соблюдение авторских прав несут пользователи, загрузившие материал на сайт
Если Вы считаете, что материал нарушает авторские права либо по каким-то другим причинам должен быть удален с сайта, Вы можете оставить жалобу на материал.
Автор материала
- На сайте: 5 лет и 7 месяцев
- Подписчики: 1
- Всего просмотров: 24534
- Всего материалов: 18
Московский институт профессиональной
переподготовки и повышения
квалификации педагогов
Видео:9 класс Химия Практическая работа Получение углекислого газа и изучение его свойств.Скачать

Дистанционные курсы
для педагогов
663 курса от 690 рублей
Выбрать курс со скидкой
Выдаём документы
установленного образца!
Учителя о ЕГЭ: секреты успешной подготовки
Время чтения: 11 минут
Минпросвещения проведет Всероссийский конкурс для органов опеки и попечительства
Время чтения: 1 минута
Российские школьники начнут изучать историю с первого класса
Время чтения: 1 минута
Инфофорум о буллинге в школе: итоги и ключевые идеи
Время чтения: 6 минут
Минпросвещения рекомендует школьникам сдавать телефоны перед входом в школу
Время чтения: 1 минута
Опубликовано расписание ОГЭ 2022
Время чтения: 1 минута
С 1 сентября в российских школах будут исполнять гимн России
Время чтения: 1 минута
Подарочные сертификаты
Ответственность за разрешение любых спорных моментов, касающихся самих материалов и их содержания, берут на себя пользователи, разместившие материал на сайте. Однако администрация сайта готова оказать всяческую поддержку в решении любых вопросов, связанных с работой и содержанием сайта. Если Вы заметили, что на данном сайте незаконно используются материалы, сообщите об этом администрации сайта через форму обратной связи.
Все материалы, размещенные на сайте, созданы авторами сайта либо размещены пользователями сайта и представлены на сайте исключительно для ознакомления. Авторские права на материалы принадлежат их законным авторам. Частичное или полное копирование материалов сайта без письменного разрешения администрации сайта запрещено! Мнение администрации может не совпадать с точкой зрения авторов.
Видео:Практическая работа №6. Получение аммиака и опыты с ним. 9 класс.Скачать

Практическая работа «Получение аммиака и изучение его свойств»
Материал может быть использован в 9 классе при изучении темы «Азот и фосфор». Разработка включает: экспериментальные задания, форму отчета и задания для самоконтроля.
Просмотр содержимого документа
«Практическая работа «Получение аммиака и изучение его свойств»»
Практическая работа № 4 9 класс
«Получение аммиака и изучение его свойств»
Цель: Получить аммиак и ознакомиться со свойствами водного раствора аммиака.
Оборудование: лабораторный штатив, сухие пробирки, пробка с газоотводной трубкой, ступка, ложки для сыпучих веществ, спиртовка, спички, стакан с водой.
Реактивы: кристаллический гидроксид кальция, кристаллический хлорид аммония, раствор соляной кислоты, раствор фенолфталеина или универсальн. индикатор.
II. Выполнение работы, оформление отчета
Уравнения реакций в молекулярном, полном и сокращенном ионном виде
1.Получение аммиака и исследование его физических свойств.
Получаем аммиак нагреванием смеси гидроксида кальция и хлорида аммония в пробирке
Собираем аммиак в пробирку дном .
Разрыхление реакционной массы.
Образование тумана.
Индикаторная бумага окрасилась в .
О выделении какого газа свидетельствуют наблюдения ?
Написать уравнение реакции:
Физические свойства аммиака. . Аммиак . воздуха, поэтому сухая пробирка – приемник находится дном. .
2. Исследование химических свойств аммиака
1. Растворение аммиака в воде.
.Изучение кислотно-основных свойств водного раствора аммиака.
3. Взаимодействие с кислотами:
Сняв с газоотводной трубки прибора пробирку, помещаем её в химический стакан с водой.
Убираем из стакана пробирку и в образовавшийся раствор добавляем индикатор … (указать название)
В стакан с водным раствором аммиака в присутствии индикатора вливают 1мл раствора соляной кислоты
Пробирка наполняется водой.
Над раствором образуется … .
Написать уравнение реакции, назвать образующееся вещество:
Аммиак . растворим в воде. Продукт взаимодействия аммиака с водой называется . . Относится к классу . . Механизм образования химической связи в катионе . . Тип реакции . .
Почему изменилась первоначальная окраска раствора?
Название продукта взаимодействия гидроксида аммония с соляной кислотой . . К какому классу относится продукт реакции? .
4. Окислительно-восстановительные свойства аммиака
На основе электронного баланса написать уравнение реакции, определить окислитель и восстановитель:
а) Горение аммиак без катализатора
б) Горение аммиак в присутствии катализатора
Какие вещества образуются в процессе горения аммиака а) без катализатора; б) в присутствии катализатора?
1) Какая масса хлорида аммония получится при взаимодействии 3 моль аммиака с соляной кислотой?
2) Какой объем кислорода потребуется для сжигания 34 г аммиака?
3) Закончите уравнения химических реакций, дайте названия продуктам реакций:
Видео:Химия 9 класс (Урок№14 - Азот: свойства и применение. Аммиак. Физические и химические свойства.)Скачать

Please wait.
Видео:ОГЭ химия. Задания на признаки химических реакций.Скачать

We are checking your browser. gomolog.ru
Видео:NH3 + HCl = NH4Cl | Получение хлорида аммонияСкачать

Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
Видео:Химия (8 класс) - Приёмы обращения с лабораторным оборудованием. Наблюдение за горящей свечой...Скачать

What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 6ff013470e9a0bfd • Your IP : 178.45.155.83 • Performance & security by Cloudflare
📽️ Видео
Аммиак и соли аммония. Видеоурок 29-30. Химия 9 классСкачать

Практическая работа химия 9 класс: аммиакСкачать

Аммиак. Химия 9 классСкачать

Химия-9. Практическая работа 5. Получение углекислого газа. Качественная реакция на карбонат-ион.Скачать

ОВР Окислительно-восстановительные реакции. Как определить окислитель и восстановительСкачать

Получение аммиака в лабораторных условиях. Растворимость в воде. Индикаторы.Скачать

Аммиак: как образуется и с чем реагирует? #аммиак #химия #видеоурок #егэхимияСкачать

Уравнение состояния идеального газа. 10 класс.Скачать

Соли аммонияСкачать

Химия. 9 класс. Получение аммиака. Производство аммиака /19.02.2021/Скачать

Практическая работа получение аммиакаСкачать

Практическая работа №5. Разбавленная серная кислота и её соли. 9 класс.Скачать

Практич работа Получение аммиакаСкачать