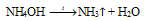Обращаем Ваше внимание, что в соответствии с Федеральным законом N 273-ФЗ «Об образовании в Российской Федерации» в организациях, осуществляющих образовательную деятельность, организовывается обучение и воспитание обучающихся с ОВЗ как совместно с другими обучающимися, так и в отдельных классах или группах.
Рабочие листы и материалы для учителей и воспитателей
Более 300 дидактических материалов для школьного и домашнего обучения
«Получение аммиака и изучение его свойств»
Цель: Получить аммиак и ознакомиться со свойствами водного раствора аммиака.
Оборудование: лабораторный штатив, сухие пробирки, пробка с газоотводной трубкой, ступка, ложки для сыпучих веществ, спиртовка, спички, стакан с водой.
Реактивы: кристаллический гидроксид кальция, кристаллический хлорид аммония, раствор соляной кислоты, раствор ф – ф.
Уравнения реакций в молекулярном, полном и сокращенном ионном виде
1. Получение аммиака и исследование его физических свойств.
Получаем аммиак нагреванием смеси гидроксида кальция и хлорида аммония в пробирке

Собираем аммиак в пробирку дном .
Разрыхление реакционной массы.
Образование тумана.
Индикаторная бумага окрасилась в .
О выделении какого газа свидетельствуют наблюдения ?
Написать уравнение реакции:
Физические свойства аммиака: . Аммиак . воздуха, поэтому сухая пробирка – приемник находится дном. .

2. Исследование химических свойств аммиака
1 . Растворение аммиака в воде.
.Изучение кислотно-основных свойств водного раствора аммиака.
3. Взаимодействие с кислотами:
Сняв с газоотводной трубки прибор а пробирку, помещаем её в химический стакан с водой.
Убираем из стакана пробирку и в образовавшийся раствор добавляем фенолфталеин .
В стакан с водным раствором аммиака в присутствии фенолфталеина вливают 1 мл раствора серной кислоты
Пробирка наполняется водой.
Написать уравнение реакции, назвать образующееся вещество:
Аммиак . растворим в воде . Продукт взаимодействия аммиака с водой называется . . Относится к классу . . Механизм образования химической связи в катионе . . Тип реакции . .
Почему исчезла первоначальная окраска раствора?
Название продукта взаимодействия гидроксида аммония с соляной кислотой . . К какому классу относится продукт реакции? .
4. Окислительно-восстановительные свойства аммиака
На основе электронного баланса написать уравнение реакции, определить окислитель и восстановитель:
а) Горение аммиак без катализатора
б) Горение аммиак в присутствии катализатора
Какие вещества образуются в процессе горения аммиака а) без катализатора; б) в присутствии катализатора?
1) Какая масса хлорида аммония получится при взаимодействии 3 моль аммиака с соляной кислотой?
2) Какой объем кислорода потребуется для сжигания 34 г аммиака?
3) Закончите уравнения химических реакций, дайте названия продуктам реакций:
Курс повышения квалификации
- Дистанционное обучение как современный формат преподавания
- Педагогическая деятельность в контексте профессионального стандарта педагога и ФГОС
- Химия: теория и методика преподавания в образовательной организации
- Дистанционные курсы для педагогов
- Найдите материал к любому уроку, указав свой предмет (категорию), класс, учебник и тему:
- Материал подходит для УМК
- Другие материалы
- Вам будут интересны эти курсы:
- Оставьте свой комментарий
- Автор материала
- Дистанционные курсы для педагогов
- Подарочные сертификаты
- Получение аммиака и изучение его физических и химических свойств
- Получение аммиака.
- Изучение свойств аммиака
- Изучение свойств водного раствора аммиака.
- Cборник практических работ по химии
- 9 КЛАСС
- Практическая работа 12. Получение и свойства аммиака и его водного раствора
- Практическая работа № 13. Азотная кислота. Нитраты
- 📽️ Видео
Дистанционное обучение как современный формат преподавания
- Сейчас обучается 859 человек из 78 регионов
Курс повышения квалификации
Педагогическая деятельность в контексте профессионального стандарта педагога и ФГОС
- Сейчас обучается 49 человек из 21 региона
Курс профессиональной переподготовки
Химия: теория и методика преподавания в образовательной организации
- Сейчас обучается 376 человек из 64 регионов
«Мотивация здорового образа жизни. Организация секций»
Свидетельство и скидка на обучение каждому участнику
- Для всех учеников 1-11 классов
и дошкольников - Интересные задания
по 16 предметам
«Как закрыть гештальт: практики и упражнения»
Свидетельство и скидка на обучение каждому участнику
Видео:Химия 9 класс (Урок№14 - Азот: свойства и применение. Аммиак. Физические и химические свойства.)Скачать

Дистанционные курсы для педагогов
Самые массовые международные дистанционные
Школьные Инфоконкурсы 2022
33 конкурса для учеников 1–11 классов и дошкольников от проекта «Инфоурок»
Найдите материал к любому уроку, указав свой предмет (категорию), класс, учебник и тему:
5 842 056 материалов в базе
Материал подходит для УМК
«Химия», Габриелян О.С.
Ищем педагогов в команду «Инфоурок»
Другие материалы
- 31.10.2021
- 40
- 0
- 30.10.2021
- 136
- 2
- 30.10.2021
- 66
- 0
- 30.10.2021
- 49
- 0
- 30.10.2021
- 81
- 0
- 30.10.2021
- 74
- 0
- 30.10.2021
- 185
- 3
- 30.10.2021
- 143
- 17
«Учись, играя: эффективное обучение иностранным языкам дошкольников»
Свидетельство и скидка на обучение
каждому участнику
Вам будут интересны эти курсы:
Оставьте свой комментарий
Авторизуйтесь, чтобы задавать вопросы.
Добавить в избранное
- 31.10.2021 1535
- DOCX 39.5 кбайт
- 11 скачиваний
- Оцените материал:
Настоящий материал опубликован пользователем Киселева Елена Юрьевна. Инфоурок является информационным посредником и предоставляет пользователям возможность размещать на сайте методические материалы. Всю ответственность за опубликованные материалы, содержащиеся в них сведения, а также за соблюдение авторских прав несут пользователи, загрузившие материал на сайт
Если Вы считаете, что материал нарушает авторские права либо по каким-то другим причинам должен быть удален с сайта, Вы можете оставить жалобу на материал.
Автор материала
- На сайте: 5 лет и 7 месяцев
- Подписчики: 1
- Всего просмотров: 24602
- Всего материалов: 18
Московский институт профессиональной
переподготовки и повышения
квалификации педагогов
Видео:Аммиак. 9 класс.Скачать

Дистанционные курсы
для педагогов
663 курса от 690 рублей
Выбрать курс со скидкой
Выдаём документы
установленного образца!
Учителя о ЕГЭ: секреты успешной подготовки
Время чтения: 11 минут
Эвакуированные в Россию из ДНР и ЛНР дети смогут поступить в вузы по квоте
Время чтения: 1 минута
Минпросвещения проведет Всероссийский конкурс для органов опеки и попечительства
Время чтения: 1 минута
С 1 сентября в российских школах будут исполнять гимн России
Время чтения: 1 минута
Минпросвещения рекомендует школьникам сдавать телефоны перед входом в школу
Время чтения: 1 минута
Российские школьники начнут изучать историю с первого класса
Время чтения: 1 минута
Инфофорум о буллинге в школе: итоги и ключевые идеи
Время чтения: 6 минут
Подарочные сертификаты
Ответственность за разрешение любых спорных моментов, касающихся самих материалов и их содержания, берут на себя пользователи, разместившие материал на сайте. Однако администрация сайта готова оказать всяческую поддержку в решении любых вопросов, связанных с работой и содержанием сайта. Если Вы заметили, что на данном сайте незаконно используются материалы, сообщите об этом администрации сайта через форму обратной связи.
Все материалы, размещенные на сайте, созданы авторами сайта либо размещены пользователями сайта и представлены на сайте исключительно для ознакомления. Авторские права на материалы принадлежат их законным авторам. Частичное или полное копирование материалов сайта без письменного разрешения администрации сайта запрещено! Мнение администрации может не совпадать с точкой зрения авторов.
Видео:Практическая работа №6. Получение аммиака и опыты с ним. 9 класс.Скачать

Получение аммиака и изучение его физических и химических свойств
Видео:Химия. 9 класс. Аммиак. Применение аммиака /12.02.2021/Скачать

Получение аммиака.
Проведем все действия, описанные в учебнике. Из газоотводной трубки будет выделяться аммиак. Он растворяется в воде, пропитавшей фенолфталеиновую бумажку. Уравнение реакции имеет вид:
В результате образуется гидроксид аммония, который имеет щелочную реакцию окрашивает индикатор в малиновый цвет.
Изучение свойств аммиака
Если поднести к отверстию пробки стеклянную палочку, смоченную концентрированной соляной кислотой, то над отверстием образуется белая дымка. Происходит реакция:
NH4Cl обладает летучестью, его частички поднимаются вместе с аммиаком. Их мы и видим в виде белой дымки. Проведем растворение аммиака так как это описало в учебнике. Из-за очень хорошей растворимости аммиака вода в пробирке поднимается. Образуется NH4OH.
1. Запишем уравнение реакции между Са(ОН)2 и NH4Cl:
Как можно видеть из уравнения, в реакции образуются пары воды. Они конденсируются на более холодных стенках пробирки. Если капельки воды попадут на раскалённое дно, то пробирка может треснуть. Поэтому ее наклоняют таким образом, чтобы капельки скатывались к отверстию пробирки.
2. Аммиак легче воздуха (т.к. М(NH3) = 17 г/моль.
М(воздуха) = 29 г/моль). Он поднимается вверх, поэтому его надо собирать в перевернутую пробирку. Аналогично можно собирать Н2 (М = 2 г/моль), СН4 — метан (М= 16 г/моль); Не (М= 4г/моль) и другие.
З. Если вместо НСl поднести к отверстию пробирки с аммиаком палочку, смоченную концентрированной азотной кислотой, то мы ничего не увидим:
NH4NO3 — не обладает летучестью.
4. Обычно для определения оснований используют реакции с образованием нерастворимых гидроксидов, например, Mg(OH)2. Уравнение реакции имеет вид:
Выпадает белый осадок.
Изучение свойств водного раствора аммиака.
1. Водный раствор аммиака имеет щелочную среду, т.е. дает малиновую окраску с фенолфталеином. При кипячении раствора гидроксид аммония разлагается, в результате чего аммиак улетучивается, а раствор становится нейтральным.
Фенолфталеин в нейтральной среде — бесцветный.
2. Фенолфталеин дает малиновую окраску в растворе гидроксида аммония, так как тот является основанием. При добавлении соляной кислоты происходит нейтрализация раствора и цвет исчезает.
3. Происходит взаимодействие между раствором АlCl3 и NH4OH.
Видео:Аммиак: как образуется и с чем реагирует? #аммиак #химия #видеоурок #егэхимияСкачать

Cборник
практических работ
по химии
Видео:Аммиак. Химия 9 классСкачать

9 КЛАСС
Продолжение. См. № 34, 35, 36, 37/2003
Видео:Получение аммиака в лаборатории. Задание 14. Химия ОГЭСкачать

Практическая работа 12.
Получение и свойства аммиака
и его водного раствора
Цели. Научиться получать и собирать аммиак лабораторным способом, проверять его свойства и свойства его водных растворов.
Оборудование и реактивы. Фарфоровая ступка, пестик, вата, пробка для пробирки, железный штатив с двумя лапками, штатив с химическими пробирками, спиртовка, спички, кристаллизатор с водой, стеклянные трубки (3 шт.), лучинка, санитарная склянка; красная лакмусовая бумажка, спиртовой раствор фенолфталеина, NH4Cl (крист.), гашеная известь Са(ОН)2, KMnO4 (крист.), , H2SO4 (конц.), HCl (конц.).
В обычных условиях аммиак – бесцветный газ, легче воздуха, с едким запахом и вкусом.
tсжиж = –33,35 °C (при p = 9•10 5 Па), tзатверд = –77,7 °С.
Хорошо растворим в воде (700 объемов NH3 в 1 объеме воды), спиртах, бензоле, ацетоне.
Неподеленная электронная пара атома азота усиливает полярность молекулы аммиака. С этим связана легкость его сжижения и высокая теплота парообразования. Жидкий аммиак, подобно воде, хороший растворитель ионных соединений.
Молекула NH3 cпособна к структурной инверсии (атом азота постоянно перемещается перпендикулярно плоскости основания пирамиды, оказываясь то над, то под ней). Инверсия сопровождается излучением в диапазоне сверхвысоких частот (СВЧ). Это послужило основой мазера – генератора излучения (аналогично лазеру).
Аммиак – очень реакционноспособное вещество.
Реакции присоединения
За счет неподеленной электронной пары атом азота (донор) способен образовывать координационную связь с атомом-акцептором (имеющим вакантные ячейки в валентном слое). Легче всего происходит присоединение протона (Н+) из воды и кислот:
Способность молекул NH3 притягивать протоны (Н + ) – свойство основания.
Реакции окисления
Аммиак – сильный восстановитель. При нагревании с хлором, бромом, кислородом, пероксидом водорода образуется свободный азот (N2):
В присутствии катализатора (сплав Pt и Rh) идет процесс:
В промышленности аммиак получают прямым синтезом из азота и водорода. Аммиак используется главным образом в производстве азотной кислоты и азотных удобрений – натриевой, калиевой, аммиачной селитры, сульфата аммония (NaNO3, KNO3, NH4NO3, (NH4)2SO4), карбамида (CO(NH2)2), аммофосов (NH4H2PO4, (NH4)2HPO4); применяется как хладагент в холодильных установках.
В лабораторных условиях аммиак получают из солей аммония.
Аммиак требует осторожного обращения из-за физиологической активности, он поражает дыхательные пути (обезвоживание).
| Порядок работы | Задания | Наблюдения и выводы |
|---|---|---|
 В фарфоровой ступке перемолоть примерно равные объемы кристаллического хлорида аммония NH4Cl и порошка Ca(OH)2. Приготовленную смесь насыпать в пробирку на 1/3 ее объема. Собрать прибор по приведенной схеме, нагревать смесь до появления острого запаха (нюхать осторожно!). Затем пробирку-сборник, не переворачивая, осторожно закрыть пробкой, погрузить в сосуд с водой и открыть пробку. После заполнения сборника водой снова закрыть его пробкой, вынуть из воды, проверить содержимое красной лакмусовой бумажкой, а затем несколькими каплями фенолфталеина. В фарфоровой ступке перемолоть примерно равные объемы кристаллического хлорида аммония NH4Cl и порошка Ca(OH)2. Приготовленную смесь насыпать в пробирку на 1/3 ее объема. Собрать прибор по приведенной схеме, нагревать смесь до появления острого запаха (нюхать осторожно!). Затем пробирку-сборник, не переворачивая, осторожно закрыть пробкой, погрузить в сосуд с водой и открыть пробку. После заполнения сборника водой снова закрыть его пробкой, вынуть из воды, проверить содержимое красной лакмусовой бумажкой, а затем несколькими каплями фенолфталеина. (Прибор не разбирать.) |
.
На основе электронного баланса написать уравнение реакции, учитывая, что данный процесс ведется без катализатора
…
а лишь приближать к ним? Описать наблюдения и ощущения (нюхать осторожно!).
…
Видео:Аммиак и соли аммония. Видеоурок 29-30. Химия 9 классСкачать

Практическая работа № 13.
Азотная кислота.
Нитраты
Цели. Закрепить знания о свойствах азотной кислоты, ее окислительной активности, свойствах нитратов, умение распознавать нитрат-анион.
Оборудование и реактивы. Шпатель (3 шт.), Г-образная газоотводная трубка, выпаривательная чашечка, железный штатив с кольцом и лапкой, штатив с химическими пробирками, спиртовка, спички, держатель для пробирок, санитарная склянка, лучина; азотная кислота (разб. и конц.), набор индикаторов, оксид меди(II), медь (стружки), FeCl3 (р-р), NаОН (р-р), Na2CO3 (крист.), Сa(OH)2 (известковая вода), дифениламиновый индикатор (C6H5)2NH в конц. H2SO4, сера, BaCl2 (р-р), водный аммиак, NaNO3 (крист.), уголь древесный (С), белок (p-р альбумина), AgNO3 (р-р), в пробирках № 1–3 – растворы нитрата, хлорида и сульфата натрия.

Диссоциация в воде:
Азотная кислота – бесцветная жидкость с резким удушающим запахом, 
4HNO3 = 2H2O + 4NO2 

Подобная реакция происходит и на свету. Замерзает при –41,15 °С. Смешивается с водой в любых соотношениях. Устойчива лишь в твердом состоянии (при плавлении: 2HNO3 = H2O + N2O5). Массовая доля кислоты 

Сильная одноосновная кислородсодержащая кислота проявляет общие с другими кислотами свойства и, являясь сильным окислителем, специфические свойства.
Задание 1. К общим свойствам кислот относятся: окраска индикаторов, реакции ионного обмена с основными и амфотерными оксидами, основаниями (нерастворимыми и щелочами), солями более слабых и более летучих кислот. Выберите необходимые реагенты, проверьте опытным путем их взаимодействие с разбавленной HNO3, заполните таблицу и сделайте выводы.
📽️ Видео
9 класс. Качественные реакцииСкачать

Промышленное получение аммиака. 11 класс.Скачать

Практическая работа №4 Получение аммиака и изучение его свойствСкачать

Практическая работа химия 9 класс: аммиакСкачать

Химия (8 класс) - Приёмы обращения с лабораторным оборудованием. Наблюдение за горящей свечой...Скачать

Лабораторная работа №2. Классы неорганических веществ: оксидов, оснований, кислот.Скачать

Химия. 9 класс. Получение аммиака. Производство аммиака /19.02.2021/Скачать

Соли аммонияСкачать

Практическая работа получение аммиакаСкачать

Химия | Лабораторная работа №7.7 "Свойства солей аммония"Скачать

Получение аммиакаСкачать

Качественная реакция на катион аммонияСкачать