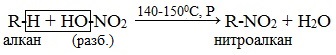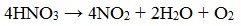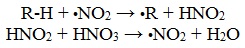Задача 122.
1. Напишите формулы и дайте названия всем изомерам состава С7Н16.
2. Напишите формулу 2-метил-3-этилгептан и двух его гомологов.
3. Получите бутан всеми возможными способами.
4. Напишите химические реакции характерные для алканов на примере 2-метилбутана.
Решение:
- 1-е задание. Изомеры гептана
- 2-е задание. Гомологи 2-метил-3-этилгептана
- 3-е задание. Получение бутана
- 1. Реакция Вюрца
- 4-е задание. Химические реакции характерные для алканов на примере 2-метилбутана.
- 4) Реакции окисления.
- а) Горение (окисление кислородом воздуха при высоких температурах):
- 7) Реакции отщепления
- 8) Изомеризация алканов
- Нитрование 2 метилбутана уравнение реакции
- Индивидуальные онлайн-занятия с репетиторами
- Наши репетиторы
- Вопрос ученика
- Ответ репетитора
- Задайте свой вопрос!
- Новые вопросы
- Нитрование 2 метилбутана уравнение реакции
- 📽️ Видео
Видео:Как решать ОРГАНИЧЕСКИЕ ЦЕПОЧКИ? Основные типы химических реакцийСкачать

1-е задание. Изомеры гептана
Видео:Химические свойства алканов. 1 часть. 10 класс.Скачать

2-е задание. Гомологи 2-метил-3-этилгептана
Гомологи — это химические соединения, имеющие структурную формулу одного типа, например: алканы, алкены, алкины, и т. д. 2-метил-3-этилгептан (изомер декана) относится к гомологическому ряду алканов : метан, этан, пропан, бутан, пентан, гексан, гептан, октан, нонан, декан — это только первые десять, они газы.
Примеры гомологов:
Видео:ВСЕ ПРО АЛКАНЫ за 8 минут: Химические Свойства и ПолучениеСкачать

3-е задание. Получение бутана
1. Реакция Вюрца
2. Гидрирование бутина.
Первоначально 1-бутин гидрируют до 1-бутена, а затем 1-бутен вторично гидрируют до бутана:
CH3-CH2-C 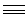
СН3—СН2-C 
3. Дегидратация бутилового спирта
Дегидратацию бутилового спирта проводят в присутствии Al2O3 при температуре 300-400 о C:
Затем, полученный 1-бутен гидрируют по водородному радикалу до бутана:
4. Получение из солей карбоновых кислот (реакция Дюма)
При сплавлении безводных солей карбоновых кислот с щелочами получаются алканы, содержащие на один атом углерода меньше по сравнению с углеродной цепью исходных карбоновых кислот:
5. Метод Фишера-Тропша
Смесь угарного газа и водорода (синтез-газ) пропускают над катализатором при нагревании, получают:
6. Реакция Гриньяра
7. Электролиз соли (реакция Кольбе)
CH3-CH2-CH2-COONa + 2Н2О электролиз 
на аноде на катоде
8. Получение бутана из спирта
Катализатором служит LiAlH4:
Видео:Химические свойства алканов | Химия ЕГЭ для 10 класса | УмскулСкачать

4-е задание. Химические реакции характерные для алканов на примере
2-метилбутана.
1) Галогенирование (замещение атома водорода атомом галогена — F, Cl, Br с образованием галогеналкана):
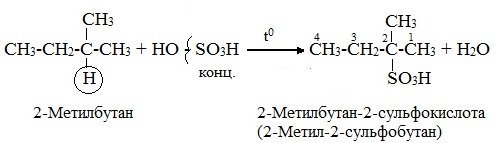
2) Сульфирование (замещение атомов водорода сульфогруппой SO3Н с образованием алкансульфокислот RSO3Н). Сульфирующий реагент – серная кислота Н2SO4 (НО-SO3Н).
1. Сульфирование алканов происходит при действии очень концентрированной Н2SO4 при небольшом нагревании. Наиболее легко замещается атом водорода у третичного атомауглерода:
2.При совместном действии сернистого ангидрида и кислорода воздуха под влиянием ультрафиолетовых лучей или добавок перекисей парафиновые углеводороды, даже нормального строения, реагируют с образованием сульфокислот (реакция сульфоокисления):
3. Реакция сульфохлорирования.
При совместном действии сернистого ангидрида и хлора при освещении ультрафиолетовым излучением или под влиянием некоторых катализаторов происходит замещение атома водорода с образованием так называемых сульфохлоридов (реакция сульфохлорирования):
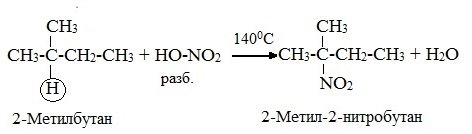
3) Нитрование (замещение атома водорода нитрогруппой – NO2 с образованием нитроалканов R-NO2).
Разбавленная азотная кислота HNO3 (НО-NО2) является нитрующим компонентом. Нитрование алкенов при нагревании называется реакцией М.И.Коновалова. Наиболее легко замещаются атомы водорода у третичного атома:
4) Реакции окисления.
У 2-метилбутана первичные атомы углерода имеют стпень окисления (-3), вторичный атом углерода имеет степень окисления (-2), а третичный — (-1). При обычных условиях алканы устойчивы к действию сильных окислителей (КМnO4, К2Сr2О7). Алканы могут окисляться с образованием различных соединений:
а) Горение (окисление кислородом воздуха при высоких температурах):
б) Каталитическое окисление алканов
Каталитическое окисление может протекать с разрывом связей С–С и С–Н. Например, при неполном окислении 2-метилбутана происходит разрыв связи (С2–С3) и получается молекула кислоты и ацетона:
Из алканов под влиянием каталитических веществ и нагревании до 200 °C получаются молекулы спирта, альдегида или карбоновой кислоты.
Примеры с 2-метилбутаном:
Окисление с образованием гидропероксидов:
5) Крекинг (анг. сracking — расщепление) алканов:
а) Термический крекинг — это разрыв связей С — С в молекулах алканов:
H3C–CH(CH3)–CH2–CH3 
б) Термический крекинг в присутствии катализаторов
Термический крекинг проводят в присутствии катализаторов (обычно оксидов алюминия и кремния) при температуре 500 0 С и атмосферном давлении.Изоалканы термически менее устойчивы, чем алканы нормального строения. Для разветвленных углеводородов преимущественно происходит разрыв связи у третичного или четвертичного атома углерода. При этом с разрывом молекул происходит реакция изомеризации и дегидрирования:
7) Реакции отщепления
а) Дегидрирование
Дегидрирование [отщепление водорода; происходит в результате разрыва связей С — Н; осуществляется в присутствии катализатора (Pt, Pd, Ni, А12О3, Сг2О3) при повышенных температурах (400 — 600°С)]. При этом от молекулы алкена отщепляется молекула водорода:
8) Пиролиз.
Процесс протекает при температуре 1000°С и выше разрываются все связи, образуютс конечные продукты – С и Н2:
8) Изомеризация алканов
Алканы нормального строения под влиянием катализаторов и при нагревании способны превращаться в разветвленные алканы без изменения состава молекул, т.е. вступать в реакции изомеpизации. В этих pеакциях участвуют алканы, молекулы которых содержат не менее 4-х углеродных атомов. Например, изомеризация н-пентана в изопентан (2-метилбутан) происходит при 100°С в присутствии катализатора хлорида алюминия:
Теоретически можно предположить, что из 2-метилбутана можно получить 2,2-диметилпропан:
Видео:Видео №3. Как составить изомерыСкачать

Нитрование 2 метилбутана уравнение реакции
репетиторы онлайн от проекта «ИнфоУрок»
- Главная
- Вопрос-ответ
- Страница вопроса
Видео:Гидрируем и дегидрируем углеводородыСкачать

Индивидуальные онлайн-занятия с репетиторами
- Бесплатное вводное занятие
- Подготовка к ЕГЭ/ОГЭ и ВПР
- По всем предметам 1-11 классов
Цена занятия фиксированная и не зависит от их количества в пакете!
Наши репетиторы
Вопрос ученика
15 октября 2021
Напишите уравнение реакции нитрования по Коновалову для 2-метилбутана
Ответ репетитора
15 октября 2021
Предметы: Подготовка к ЕГЭ, Химия, Подготовка к ОГЭ, Биология
Азотная кислота разбавленная является нитрующим веществом. Нитрование при нагревании называется реакцией Коновалова. Легко замещаются атомы водорода у третичного атома. Продукты называют нитросоединениями.
Видео:Нитрование алкановСкачать

Задайте свой вопрос!
Наши репетиторы максимально быстро дадут на него развёрнутый ответ. Это бесплатно!
Видео:Составление формул органических соединений по названиюСкачать

Новые вопросы
15 февраля 2022
Предметы: Подготовка к ЕГЭ, Литература, Подготовка к ОГЭ, Русский язык
Видео:химические свойства алканов/органическая химия/ЕГЭСкачать

Нитрование 2 метилбутана уравнение реакции
Реакция Коновалова (нитрование алканов) – это нитрование алифатических, алициклических и жирноароматических соединений разбавленной НNО3 (жидкофазное нитрование) при нагревании и давлении.
В результате реакции происходит замещение атома водорода на нитрогруппу NO2 с образованием продуктов реакции – нитросоединений (нитроалканов).
Впервые нитрование алканов было проведено в 1888 г. химиком М.И. Коноваловым. По образному выражению самого Коновалова, ему удалось оживить «химических мертвецов», заставив реагировать неактивные в химическом отношении парафины.
С помощью реакции Коновалова нитруют жидкие алканы (начиная с пентана С5Н12). Жидкие алканы запаивают в ампулы вместе с нитрующим реагентом 10-25%-м раствором азотной кислоты и нагревают (140-150 0 С).
В реакцию вступают практически все алканы, но скорость реакции и выход нитросоединений невелики.
Жирноароматические соединения легко нитруются в α-положение боковой цепи.
Наиболее легко замещаются атомы водорода у третичного атома углерода, сложнее у вторичного и наиболее сложно – у первичного.
Механизм реакции
Нитрование алканов, циклоалканов и алкиларенов в боковую цепь представляет собой цепной процесс и протекает по механизму свободнорадикального замещения (SR).
При нагревании азотная кислота разлагается с выделением диоксида азота:
Молекула NO2, обладающая неспаренным электроном, является истинным нитрующим агентом. Под действием диоксида азота из углеводорода образуется радикал R• и азотистая кислота, которая при взаимодействии с азотной кислотой снова дает диоксид азота:
Далее радикал R• реагирует с NO2, давая нитросоединение и эфир азотистой кислоты в качестве побочного продукта:
В промышленности широкое применение нашло парофазное нитрование (реакция Хасса). Его осуществляют пропускании паров азотной кислоты и алкана через трубчатый реактор при 420-450 0 С с последующим резким охлаждением.
Реакция сопровождается крекингом (от англ. crack – «расщеплять») – высокотемпературным расщеплением углеродных связей. Образуются нитроалканы с меньшим количеством углеродных атомов.
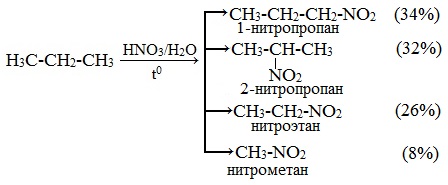
Например, нитрование пропана происходит по схеме:
Из нитропарафинов наибольшее значение имеют низшие мононитропарафины (нитрометан, нитроэтан, нитропропан и нитробутан), которые применяются как полупродукты нефтехимического синтеза и как растворители. К ним проявляется интерес, как к возможным компонентам ракетного топлива.
Полинитросоединения (ди- , три- и тетранитрометан, гексанитроэтан) используются как взрывчатые вещества и в производстве ракетных топлив.
📽️ Видео
25. Схема реакции и химическое уравнениеСкачать

Изомеры, гомологи, органическая химияСкачать

РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

НитрированиеСкачать

Бензол. Механизм реакции электрофильного замещения. Нитрование бензола.Скачать

Номенклатура алканов. Учимся давать названия алканам.Скачать

Галогенирование алкановСкачать

Органическая Химия — Алканы и Цепь из АтомовСкачать

ЭТО ПОМОЖЕТ разобраться в Органической Химии — Алкены, Урок ХимииСкачать

Химические свойства алканов / Часть 1. Углублённый уровеньСкачать

Алканы. Химические свойства. Ч.1. Реакции радикального замещения.Скачать