Что такое нитробензол? Это органическое соединение, которое представляет собой ароматическое ядро и присоединенную к нему нитрогруппу. По внешнему виду, в зависимости от температуры, — это ярко-желтые кристаллы или маслянистая жидкость. Имеет миндальных запах. Токсичен.
- Структурная формула нитробензола
- Получение нитробензола в промышленности
- Получение нитробензола в лаборатории
- Физические свойства
- Электрофильное замещение
- Нуклеофильное замещение
- Реакция восстановления
- Применение
- Опасность
- Лечение
- Нитросоединения
- Свойства нитросоединений
- Восстановление нитросоединений
- Реакции замещения нитробензола
- Получение нитросоединений
- Нитрование алканов и ароматических углеводородов
- Замещение галогена на нитрогруппу
- Добавить комментарий
- Формула нитробензола: физические и химические свойства
- Структурная формула нитробензола
- Получение нитробензола в промышленности
- Получение нитробензола в лаборатории
- Физические свойства
- Электрофильное замещение
- Нуклеофильное замещение
- Реакция восстановления
- Применение
- Опасность
- Лечение
Видео:Химия 9 класс (Урок№15 - Азотная кислота. Строение молекулы.Соли азотной кислоты.Азотные удобрения.)Скачать

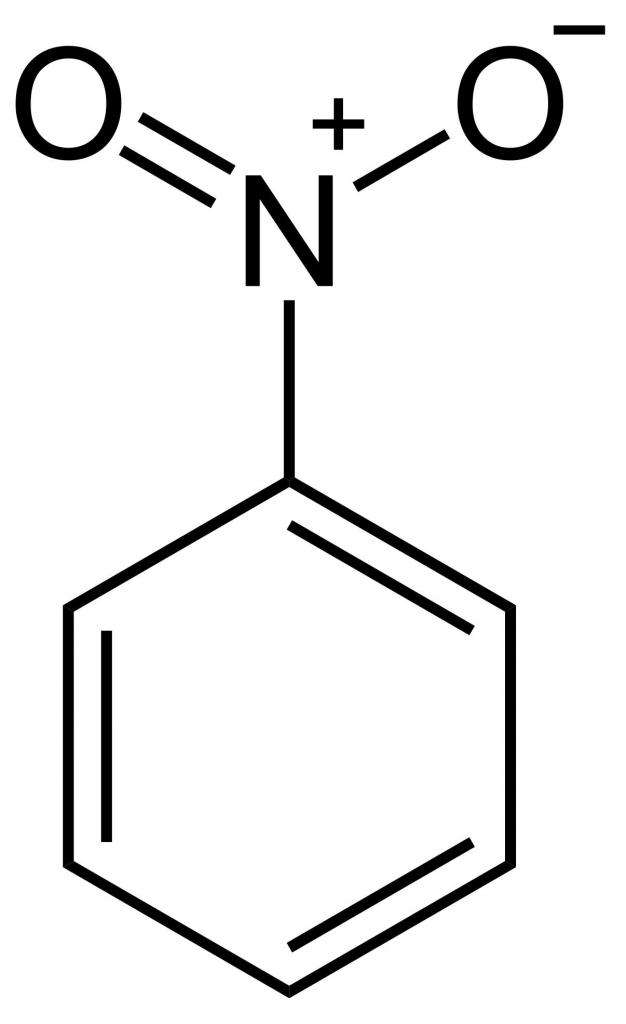
Структурная формула нитробензола
Нитрогруппа — это очень сильный акцептор электронной плотности. Поэтому молекула нитробензола обладает отрицательным индуктивным и отрицательным мезомерным эффектом. Нитрогруппа довольно сильно притягивает на себя электронную плотность ароматического ядра, дезактивируя его. Электрофильные реагенты уже не так сильно притягиваются к ядру, и потому нитробензол не так активно вступает в подобные реакции. Чтобы напрямую присоединить к нитробензолу еще одну нитрогруппу, необходимы очень жесткие условия, гораздо более жесткие, чем при синтезе мононитробензола. Тоже самое касается галогенов, сульфогруппы и др.
Из структурной формулы нитробензола видно, что одна связь азота с кислородом одинарная, а другая — двойная. Но на самом деле, из-за мезомерного эффекта, они обе равнозначны и имеют одинаковую длину 0,123 нм.

Видео:Азотная кислота. Физические и химические свойства азотной кислоты. Подготовка к ЕГЭ по химии | ХимияСкачать

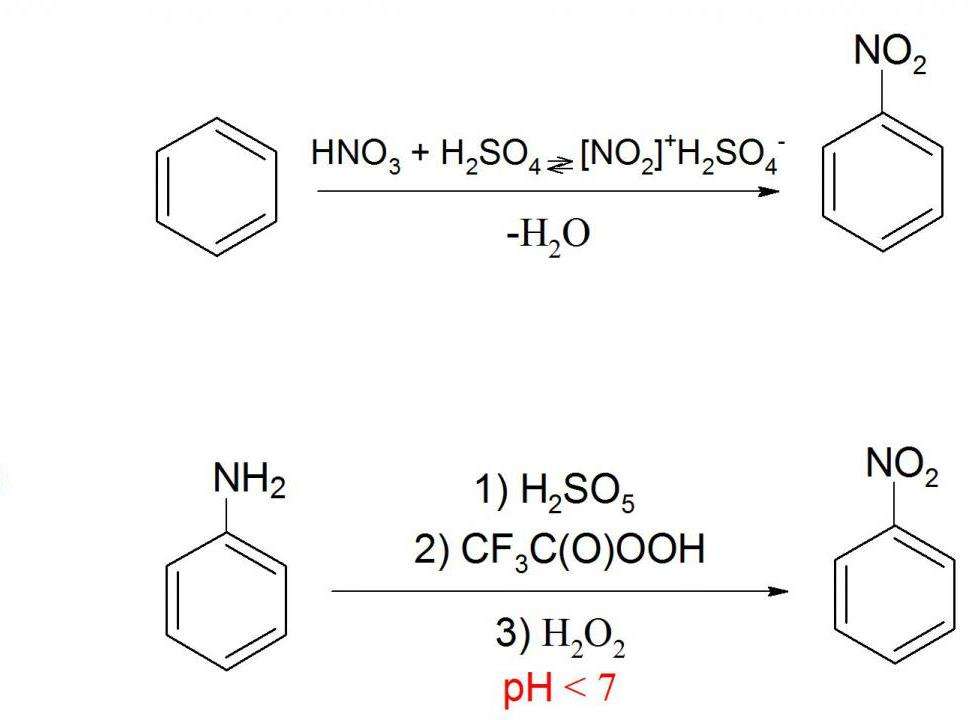
Получение нитробензола в промышленности
Нитробензол — важный промежуточный продукт в синтезе многих веществ. Поэтому его производят в промышленных масштабах. Основной способ получения нитробензола — это нитрование бензола. Обычно для этого используют нитрующую смесь (смесь концентрированных серной и азотной кислоты). Реакцию ведут 45 минут при температуре примерно 50 °C. Выход нитробензола составляет 98 %. Именно поэтому данный способ в основном применяют в промышленности. Для его реализации существуют специальные установки как периодического, так и непрерывного типа. На 1995 г производство нитробензола в США составляло 748 000 тонн в год.
Нитрование бензола можно также вести просто концентрированной азотной кислотой, но в таком случае выход продукта будет ниже.
Видео:Азотная кислота на ОГЭ по химии | ОГЭ 2023 | УмскулСкачать

Получение нитробензола в лаборатории
Существует еще один способ получения нитробензола. В качестве сырья здесь используется анилин (аминобензол), который окисляют пероксисоединениями. Благодаря этому аминогруппа заменяется на нитрогруппу. Но в ходе этой реакции образуется несколько побочных продуктов, что мешает эффективно использовать данный способ в промышленности. Тем более, нитробензол в основном и используют для синтеза анилина, поэтому применять анилин для производства нитробензола не имеет смысла.
Видео:Азотная кислота. Физические и химические свойства. 9 класс.Скачать

Физические свойства
При комнатной температуре нитробензол представляет из себя бесцветную маслянистую жидкость с запахом горького миндаля. При температуре 5,8 °C она затвердевает, превращаясь в желтые кристаллы. При 211 °C нитробензол кипит, а при 482 °C самовоспламеняется. Данное вещество, почти как любое ароматическое соединение, нерастворимо в воде, зато хорошо растворимо в органических соединениях, особенно в бензоле. Также он может перегоняться водяным паром.
Видео:Реакции 16ти металлов с азотной кислотой разной концентрации Reactions of 16 metals with nitric acidСкачать

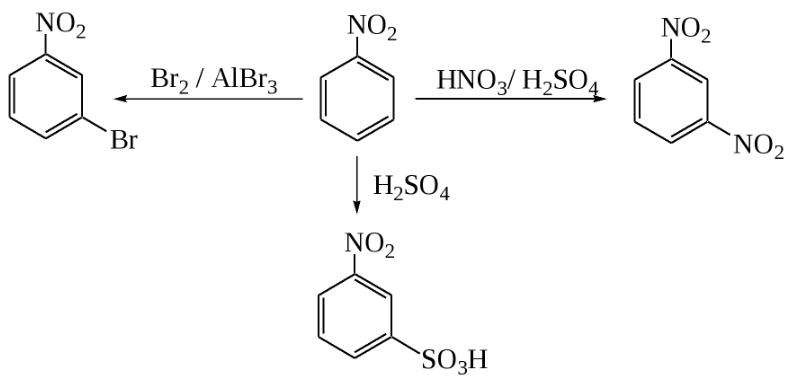
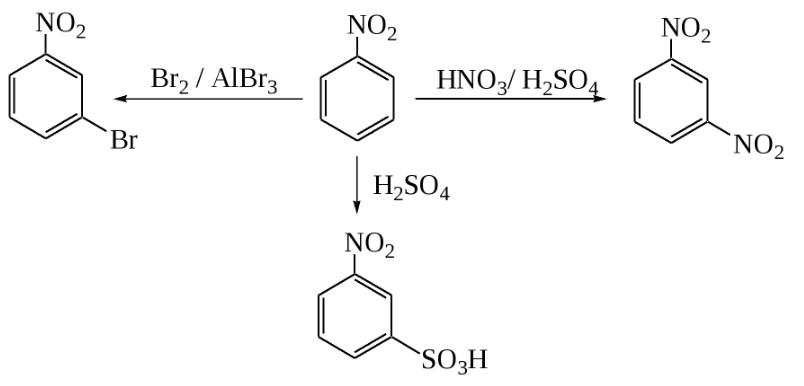
Электрофильное замещение
Для нитробензола, как и для любого арена, характерны реакции электрофильного замещения в ядро, хотя они и несколько затруднены по сравнению с бензолом из-за влияния нитрогруппы. Так, из нитробензола можно получить динитробензол путем дальнейшего нитрования смесью азотной и серой кислот при повышенной температуре. Полученный продукт будет преимущественно (93 %) состоять из мета-динитробензола. Возможно даже получение тринитробензола прямым путем. Но для этого необходимо использовать еще более жесткие условия, а также трехфтористый бор.
Точно так же нитробензол может сульфироваться. Для этого используют очень сильный сульфирующий реагент — олеум (раствор оксида серы VI в серной кислоте). Температура реакционной смеси должна составлять не менее 80 °C. Еще одна реакция электрофильного замещения — прямое галогенирование. В качестве катализаторов используют сильные кислоты Льюиса (хлорид алюминия, трехфтористый бор и др.), а также повышенную температуру.
Видео:Азотная кислота и металлы за 13 минут | ХИМИЯ ЕГЭ | СОТКАСкачать

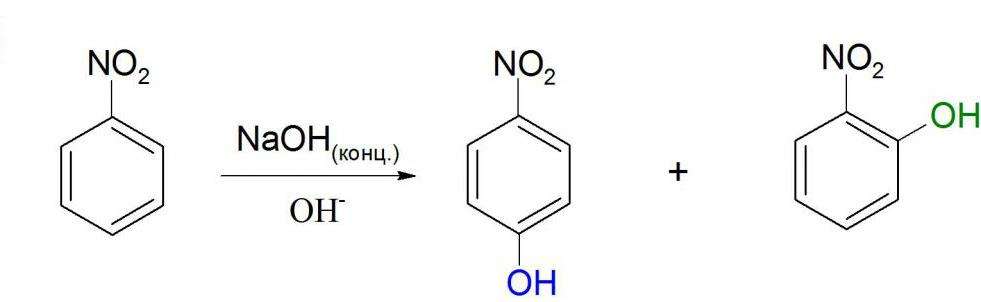
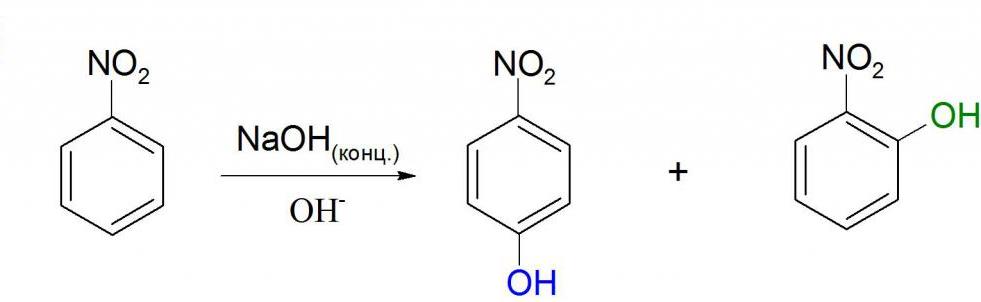
Нуклеофильное замещение
Как видно из структурной формулы, нитробензол может вступать в реакции с сильными электронодонорными соединениями. Это возможно из-за влияния нитрогруппы. Примером такой реакции может служить взаимодействие с концентрированными или твердыми гидроксидами щелочных металлов. Но в этой реакции не образуется нитробензол натрия. Химическая формула нитробензола предполагает скорее присоединение гидроксильной группы в ядро, т. е. образование нитрофенола. Но происходит это только при достаточно жестких условиях.
Подобная реакция протекает и с магнийорганическими соединениями. Углеводородный радикал присоединяется к ядру в орто- или пара- положения к нитрогруппе. Побочным процессом в этом случае является восстановление нитрогруппы до аминогруппы. Реакции нуклеофильного замещения идут проще, если нитрогрупп несколько, так как они еще сильнее будут оттягивать на себя электронную плотность ядра.
Видео:реакция меди с азотной кислотойСкачать

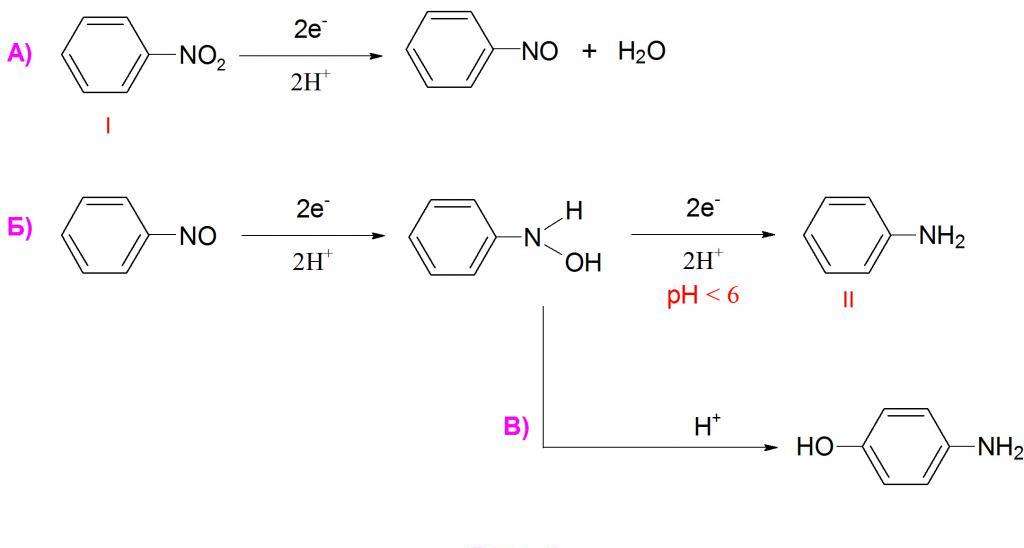
Реакция восстановления
Как известно, нитросоединения могут восстанавливаться до аминов. Не является исключением и нитробензол, формула которого предполагает возможность этой реакции. Она часто применяется в промышленности для синтеза анилина.
Но нитробензол может давать и очень много других продуктов восстановления. Чаще всего используют восстановление атомарным водородом в момент его выделения, т. е. в реакционной смеси проводят реакцию взаимодействия кислоты с металлом, и выделяющийся водород вступает в реакцию с нитробензолом. Обычно при таком взаимодействии получается анилин.
Если на нитробензол подействовать цинковой пылью в растворе хлорида аммония, то продуктом реакции будет являться N-фенилгидроксиламин. Это соединение довольно легко может быть восстановлено стандартным способом до анилина, либо же окислено обратно в нитробензол сильным окислителем.
Восстановление также может вестись в газовой фазе молекулярным водородом в присутствии платины, палладия или никеля. В этом случае также получается анилин, но существует вероятность восстановления самого бензольного ядра, что зачастую нежелательно. Иногда также применяют такой катализатор, как никель Ренея. Он представляет из себя пористый никель, насыщенный водородом и содержащий 15 % алюминия.
При восстановлении нитробензола алкоголятами калия или натрия образуется азоксибензол. Если использовать более сильные восстановители в щелочной среде, то получается азобензол. Эта реакция также довольно важна, так как с ее помощью синтезируют некоторые красители. Азобензол может быть подвергнут дальнейшему восстановлению в щелочной среде до образования гидразобензола.
Изначально восстановление нитробензола проводилось сульфидом аммония. Этот способ в 1842 г предложил Зинин Н. Н., поэтому реакция носит его имя. Но в настоящий момент ее уже редко применяют на практике из-за низкого выхода.
Видео:Азотная кислота. 11 класс.Скачать

Применение
Сам по себе нитробензол применяют очень редко, только как селективный растворитель (например, для эфиров целлюлозы) или мягкий окислитель. Иногда его добавляют в полировочные растворы для металлов.
Почти весь производимый нитробензол используется для синтеза других полезных веществ (например, анилина), которые, в свою очередь, используются для синтеза лекарственных препаратов, красителей, полимеров, взрывчатых веществ и др.
Видео:Разложение нитратов (солей азотной кислоты)Скачать

Опасность
Из-за своих физических и химических свойств, нитробензол — очень опасное соединение. Он имеет третий уровень опасности для здоровья из четырех по стандарту NFPA 704. Помимо того, что он может попасть в организм при дыхании или через слизистые оболочки, он также всасывается через кожу. При отравлении большой концентрацией нитробензола человек может потерять сознание и умереть. При небольших концентрациях симптомами отравления являются недомогание, головокружение, шум в ушах, тошнота и рвота. Особенность отравления нитробензолом — высокая скорость заражения. Симптомы проявляются очень быстро: нарушаются рефлексы, кровь приобретает темно-бурый цвет из-за образования в ней метгемоглобина. Иногда могут присутствовать высыпания на коже. Концентрация, достаточная для отправления, очень мала, хотя точных данных по смертельной дозе нет. В специальной литературе часто встречается информация, что 1-2 капли нитробензола хватает, чтобы убить человека.
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Лечение
При отравлении нитробензолом пострадавшего необходимо немедленно удалить из токсичной зоны и избавить его от зараженной одежды. Тело омывают теплой водой с мылом, чтобы удалить нитробензол с кожи. Каждые 15 минут пострадавшему делают ингаляцию карбогеном. При легких отравлениях необходимо принимать цистамин, пиридоксин или липоевую кислоту. В более тяжелых случаях рекомендуется использовать метиленовую синь или хромосмон внутривенно. При отравлении нитробезнолом через рот необходимо немедленно вызывать рвоту и промыть желудок теплой водой. Противопоказано принимать какой-либо жир, в том числе и молоко.
Видео:Азотная кислота. Химические свойства. Взаимодействие с металлами.Скачать

Нитросоединения
| Нитросоединения – это вещества, в которых алкильный или ароматический радикал связан с нитрогруппой —NO2. |
В зависимости от типа углеводородного радикала, связанного с группой NO2, нитросоединения подразделяются на алифатические (жирные) и ароматические.
Простейший представитель алифатических нитросоединений – нитрометан:
Ароматическое нитросоединение – нитробензол С6Н5–NO2:
Видео:азотный кислота чуть не взорвалась до конца смотрите химия реакция лабораторияСкачать

Свойства нитросоединений
Видео:Получение концентрированной азотной кислотыСкачать

Восстановление нитросоединений
При восстановлении нитросоединений образуются первичные амины.
- Нитросоединения восстанавливаются водородом:
- Восстановление сульфидом аммония (реакция Зинина):
- Восстановление алюминием и цинком в щелочной среде.
Алюминий и цинк в щелочной среде образуют гидроксокомплексы.
В щелочной и нейтральной среде получаются амины. Восстановлением нитробензола получают анилин.
- Восстановление металлами в кислой среде.
Железо, олово и цинк в соляной кислоте реагируют с нитросоединениями с образованием солей аминов:
Амины из раствора соли выделяют с помощью щелочи:
Видео:Специфические свойства азотной кислоты и нитратов. 9 класс.Скачать

Реакции замещения нитробензола
Нитробензол вступает в реакции замещения с образованием мета-замещенных продуктов в бензольном кольце.
| Например, при хлорировании нитробензола образуется мета-хлорнитробензол: |
Видео:218. Азотная кислота. Строение молекулы.Скачать

Получение нитросоединений
Видео:Особенности серной и азотной кислот | Химия ЕГЭ, ЦТСкачать

Нитрование алканов и ароматических углеводородов
Алканы взаимодействуют с разбавленной азотной кислотой по радикальному механизму, при нагревании до 140 о С и под давлением. Атом водорода в алкане замещается на нитрогруппу NO2.
При этом процесс протекает избирательно.
| Например, при нитровании пропана образуется преимущественно 2-нитропропан |

Ароматические углеводороды нитруются концентрированной азотной кислотой. Реакция катализируется концентрированной серной кислотой:
При нитровании толуола может получиться трёхзамещённая молекула (2,4,6-тринитротолуол, тротил):
Видео:Медь и азотная кислота 🧑🔬Скачать

Замещение галогена на нитрогруппу
При взаимодействии нитрита серебра с галогеналканами образуются амины:
Добавить комментарий
Этот сайт использует Akismet для борьбы со спамом. Узнайте, как обрабатываются ваши данные комментариев.
Видео:Реакции металлов с азотной кислотой. Химический опытСкачать

Формула нитробензола: физические и химические свойства
Что такое нитробензол? Это органическое соединение, которое представляет собой ароматическое ядро и присоединенную к нему нитрогруппу. По внешнему виду, в зависимости от температуры, — это ярко-желтые кристаллы или маслянистая жидкость. Имеет миндальных запах. Токсичен.
Видео:Азотная кислота и нитраты | Химия ЕГЭ | УмскулСкачать

Структурная формула нитробензола
Нитрогруппа — это очень сильный акцептор электронной плотности. Поэтому молекула нитробензола обладает отрицательным индуктивным и отрицательным мезомерным эффектом. Нитрогруппа довольно сильно притягивает на себя электронную плотность ароматического ядра, дезактивируя его. Электрофильные реагенты уже не так сильно притягиваются к ядру, и потому нитробензол не так активно вступает в подобные реакции. Чтобы напрямую присоединить к нитробензолу еще одну нитрогруппу, необходимы очень жесткие условия, гораздо более жесткие, чем при синтезе мононитробензола. Тоже самое касается галогенов, сульфогруппы и др.
Из структурной формулы нитробензола видно, что одна связь азота с кислородом одинарная, а другая — двойная. Но на самом деле, из-за мезомерного эффекта, они обе равнозначны и имеют одинаковую длину 0,123 нм.
Видео:Химия 9 класс: Азотная кислотаСкачать

Получение нитробензола в промышленности
Нитробензол — важный промежуточный продукт в синтезе многих веществ. Поэтому его производят в промышленных масштабах. Основной способ получения нитробензола — это нитрование бензола. Обычно для этого используют нитрующую смесь (смесь концентрированных серной и азотной кислоты). Реакцию ведут 45 минут при температуре примерно 50 °C. Выход нитробензола составляет 98 %. Именно поэтому данный способ в основном применяют в промышленности. Для его реализации существуют специальные установки как периодического, так и непрерывного типа. На 1995 г производство нитробензола в США составляло 748 000 тонн в год.
Нитрование бензола можно также вести просто концентрированной азотной кислотой, но в таком случае выход продукта будет ниже.
Получение нитробензола в лаборатории
Существует еще один способ получения нитробензола. В качестве сырья здесь используется анилин (аминобензол), который окисляют пероксисоединениями. Благодаря этому аминогруппа заменяется на нитрогруппу. Но в ходе этой реакции образуется несколько побочных продуктов, что мешает эффективно использовать данный способ в промышленности. Тем более, нитробензол в основном и используют для синтеза анилина, поэтому применять анилин для производства нитробензола не имеет смысла.
Физические свойства
При комнатной температуре нитробензол представляет из себя бесцветную маслянистую жидкость с запахом горького миндаля. При температуре 5,8 °C она затвердевает, превращаясь в желтые кристаллы. При 211 °C нитробензол кипит, а при 482 °C самовоспламеняется. Данное вещество, почти как любое ароматическое соединение, нерастворимо в воде, зато хорошо растворимо в органических соединениях, особенно в бензоле. Также он может перегоняться водяным паром.
Электрофильное замещение
Для нитробензола, как и для любого арена, характерны реакции электрофильного замещения в ядро, хотя они и несколько затруднены по сравнению с бензолом из-за влияния нитрогруппы. Так, из нитробензола можно получить динитробензол путем дальнейшего нитрования смесью азотной и серой кислот при повышенной температуре. Полученный продукт будет преимущественно (93 %) состоять из мета-динитробензола. Возможно даже получение тринитробензола прямым путем. Но для этого необходимо использовать еще более жесткие условия, а также трехфтористый бор.
Точно так же нитробензол может сульфироваться. Для этого используют очень сильный сульфирующий реагент — олеум (раствор оксида серы VI в серной кислоте). Температура реакционной смеси должна составлять не менее 80 °C. Еще одна реакция электрофильного замещения — прямое галогенирование. В качестве катализаторов используют сильные кислоты Льюиса (хлорид алюминия, трехфтористый бор и др.), а также повышенную температуру.
Нуклеофильное замещение
Как видно из структурной формулы, нитробензол может вступать в реакции с сильными электронодонорными соединениями. Это возможно из-за влияния нитрогруппы. Примером такой реакции может служить взаимодействие с концентрированными или твердыми гидроксидами щелочных металлов. Но в этой реакции не образуется нитробензол натрия. Химическая формула нитробензола предполагает скорее присоединение гидроксильной группы в ядро, т. е. образование нитрофенола. Но происходит это только при достаточно жестких условиях.
Подобная реакция протекает и с магнийорганическими соединениями. Углеводородный радикал присоединяется к ядру в орто- или пара- положения к нитрогруппе. Побочным процессом в этом случае является восстановление нитрогруппы до аминогруппы. Реакции нуклеофильного замещения идут проще, если нитрогрупп несколько, так как они еще сильнее будут оттягивать на себя электронную плотность ядра.
Реакция восстановления
Как известно, нитросоединения могут восстанавливаться до аминов. Не является исключением и нитробензол, формула которого предполагает возможность этой реакции. Она часто применяется в промышленности для синтеза анилина.
Но нитробензол может давать и очень много других продуктов восстановления. Чаще всего используют восстановление атомарным водородом в момент его выделения, т. е. в реакционной смеси проводят реакцию взаимодействия кислоты с металлом, и выделяющийся водород вступает в реакцию с нитробензолом. Обычно при таком взаимодействии получается анилин.
Если на нитробензол подействовать цинковой пылью в растворе хлорида аммония, то продуктом реакции будет являться N-фенилгидроксиламин. Это соединение довольно легко может быть восстановлено стандартным способом до анилина, либо же окислено обратно в нитробензол сильным окислителем.
Восстановление также может вестись в газовой фазе молекулярным водородом в присутствии платины, палладия или никеля. В этом случае также получается анилин, но существует вероятность восстановления самого бензольного ядра, что зачастую нежелательно. Иногда также применяют такой катализатор, как никель Ренея. Он представляет из себя пористый никель, насыщенный водородом и содержащий 15 % алюминия.
При восстановлении нитробензола алкоголятами калия или натрия образуется азоксибензол. Если использовать более сильные восстановители в щелочной среде, то получается азобензол. Эта реакция также довольно важна, так как с ее помощью синтезируют некоторые красители. Азобензол может быть подвергнут дальнейшему восстановлению в щелочной среде до образования гидразобензола.
Изначально восстановление нитробензола проводилось сульфидом аммония. Этот способ в 1842 г предложил Зинин Н. Н., поэтому реакция носит его имя. Но в настоящий момент ее уже редко применяют на практике из-за низкого выхода.
Применение
Сам по себе нитробензол применяют очень редко, только как селективный растворитель (например, для эфиров целлюлозы) или мягкий окислитель. Иногда его добавляют в полировочные растворы для металлов.
Почти весь производимый нитробензол используется для синтеза других полезных веществ (например, анилина), которые, в свою очередь, используются для синтеза лекарственных препаратов, красителей, полимеров, взрывчатых веществ и др.
Опасность
Из-за своих физических и химических свойств, нитробензол — очень опасное соединение. Он имеет третий уровень опасности для здоровья из четырех по стандарту NFPA 704. Помимо того, что он может попасть в организм при дыхании или через слизистые оболочки, он также всасывается через кожу. При отравлении большой концентрацией нитробензола человек может потерять сознание и умереть. При небольших концентрациях симптомами отравления являются недомогание, головокружение, шум в ушах, тошнота и рвота. Особенность отравления нитробензолом — высокая скорость заражения. Симптомы проявляются очень быстро: нарушаются рефлексы, кровь приобретает темно-бурый цвет из-за образования в ней метгемоглобина. Иногда могут присутствовать высыпания на коже. Концентрация, достаточная для отправления, очень мала, хотя точных данных по смертельной дозе нет. В специальной литературе часто встречается информация, что 1-2 капли нитробензола хватает, чтобы убить человека.
Лечение
При отравлении нитробензолом пострадавшего необходимо немедленно удалить из токсичной зоны и избавить его от зараженной одежды. Тело омывают теплой водой с мылом, чтобы удалить нитробензол с кожи. Каждые 15 минут пострадавшему делают ингаляцию карбогеном. При легких отравлениях необходимо принимать цистамин, пиридоксин или липоевую кислоту. В более тяжелых случаях рекомендуется использовать метиленовую синь или хромосмон внутривенно. При отравлении нитробезнолом через рот необходимо немедленно вызывать рвоту и промыть желудок теплой водой. Противопоказано принимать какой-либо жир, в том числе и молоко.