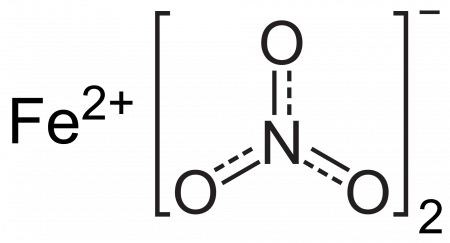
Fe(NO3)2 — соль образованная слабым основанием и сильной кислотой, поэтому реакция гидролиза протекает по катиону.
Видео:Гидролиз солей. 9 класс.Скачать

Первая стадия (ступень) гидролиза
Полное ионное уравнение
Fe 2+ + 2NO3 — + HOH ⇄ FeOH + + NO3 — + H + + NO3 —
Сокращенное (краткое) ионное уравнение
Fe 2+ + HOH ⇄ FeOH + + H +
Видео:Гидролиз солей. 1 часть. 11 класс.Скачать

Вторая стадия (ступень) гидролиза
Полное ионное уравнение
FeOH + + NO3 — + HOH ⇄ Fe(OH)2 + H + + NO3 —
Сокращенное (краткое) ионное уравнение
FeOH + + HOH ⇄ Fe(OH)2 + H +
Видео:ГИДРОЛИЗ СОЛЕЙ | 9 класс | Кратко и понятноСкачать

Среда и pH раствора нитрата железа (II)
В результате гидролиза образовались ионы водорода (H + ), поэтому раствор имеет кислую среду (pH
Видео:Химия 11 класс (Урок№7 - Гидролиз органических и неорганических соединений.)Скачать

Нитрат железа (II)
| Нитрат железа (II) | |
|---|---|
 | |
| Систематическое наименование | Нитрат железа (II) |
| Хим. формула | FeN2O6 |
| Рац. формула | Fe(NO3)2 |
| Состояние | твёрдое |
| Молярная масса | |
| Температура | |
| • плавления | (гексагидрат) 60,5°C |
| Рег. номер CAS | 14013-86-6 |
| PubChem | 9815404 |
| SMILES | |
| RTECS | NO7175000 |
| ChemSpider | 7991154 и 32867051 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Нитрат железа (II) — соль азотной кислоты и двухвалентного железа.
Видео:Гидролиз солей. Классификация солей. Решение примеров.Скачать

Содержание
Видео:Гидролиз солей. 2 часть. 11 класс.Скачать

Физические свойства
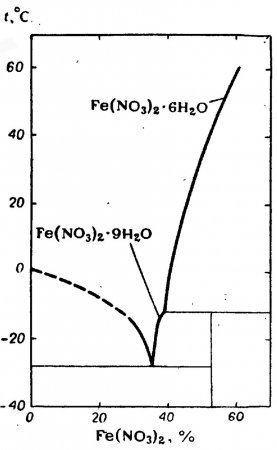
Нитрат железа (II) существует в основном в виде кристаллогидратов Fe(NO3)2·6H2O и Fe(NO3)2·9H2O.
Гексагидрат нитрата железа (II) Fe(NO3)2·6H2O — светло-зелёные кристаллы с ромбической кристаллической решеткой. Хорошо растворяется в воде, причем растворимость растёт вместе с повышением температуры. В равновесии с насыщенным водным раствором существует в интервале от -12 до 60,5 °C и концентрации раствора в пределах 39-69,5%. При более низких температурах и концентрациях растворов устойчив нонагидрат нитрата железа (II) Fe(NO3)2·9H2O.
График растворимости представлен на рисунке.
| Состояние | Температура, °С | Концентрация, % |
| Лед+Fe(NO3)2·9H2O | -28 | (35) |
| Fe(NO3)2·9H2O+Fe(NO3)2·6H2O | (39) | |
| Fe(NO3)2·6H2O | 60,5 | 62,5 |
Безводный нитрат железа (II) и его кристаллогидраты неустойчивы, поэтому легко окисляются на воздухе.
Видео:11 класс. Гидролиз солей.Скачать

Получение
Нитрат железа (II) образуется при растворении железа в разбавленной азотной кислоте на холоде:
В чистом состоянии его лучше получать обменной реакцией сульфата железа (II) с нитратом свинца (II):
Видео:Необратимый гидролиз карбоната алюминия Al2(CO3)3 и карбоната железа (III) Fe2(CO3)3Скачать

Химические свойства
Проявляет восстановительные свойства. Гидролиз практически не проявляется.
- Водный раствор нитрата железа (II) разлагается при кипячении с образованием основного нитрата железа (III):
4 Fe(NO3)2 + O2 + 2H2O → t 4Fe(OH)(NO3)2
- Реагирует с щелочами с образованием гидроксида железа (II):
Fe(NO3)2 + 2NaOH → Fe(OH)2↓ + 2NaNO3
- С растворимыми карбонатами дает белый карбонат железа (II):
Fe(NO3)2 + K2CO3 → FeCO3↓ + 2KNO3
- Восстанавливается до металлического железа при действии более активного металла
Fe(NO3)2 + Mg → Fe + Mg(NO3)2
- Взаимодействует с гексацианоферратом (III) калия (красной кровяной солью) с образованием тёмно-синего осадка гексацианоферрата (II) железа (III)-калия (берлинская лазурь):
Fe(NO3)2 + K3[Fe(CN)6] → KFe[Fe(CN)6]↓ + 2KNO3
- При термическом разложении образуется оксид железа (III), а не оксид железа (II):
4 Fe(NO3)2 → t 2Fe2O3 + 8NO2↑ + O2↑
Видео:Гидролиз солей. 10 класс.Скачать

Acetyl
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. 📺 ВидеоОпыты по химии. Получение гидроксида железа (III) и изучение его свойствСкачать  Опыты по химии. Получение гидроксида железа (II) и изучение его свойствСкачать  Получение гидроксида железа (III) и взаимодействие его с кислотамиСкачать  Химия | ГидролизСкачать  ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать  Получение нитрата железа(железо азотнокислое)Скачать  Химия 9 класс (Урок№8 - Гидролиз солей.)Скачать  Совместный гидролиз | Химия ЕГЭ – Екатерина СтрогановаСкачать  Гидролиз солейСкачать  9 и 11 классы. Железо. Часть 2.Скачать  Уравниваем реакцию окисления сульфата железа (II) в нейтральной средеСкачать  |