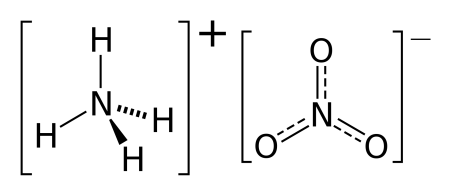NH4NO3 — соль образованная слабым основанием и сильной кислотой, поэтому реакция гидролиза протекает по катиону.
Полное ионное уравнение
NH4 + + NO3 — + HOH ⇄ NH4OH + H + + NO3 —
Сокращенное (краткое) ионное уравнение
NH4 + + HOH ⇄ NH4OH + H +
- Среда и pH раствора нитрата аммония
- Соли аммония: получение и химические свойства
- Соли аммония
- Способы получения солей аммония
- Химические свойства солей аммония
- Нитрат аммония
- Содержание
- Физические свойства
- Растворимость
- Состав
- Методы получения
- Основной метод
- Метод Габера
- Нитрофосфатный метод
- Химические свойства
- Кристаллические состояния нитрата аммония
- Применение
- Удобрения
- Взрывчатые вещества
- Безопасный состав
- Дополнительная информация
- 🔍 Видео
Видео:Химия. Молекулярные и ионные уравненияСкачать

Среда и pH раствора нитрата аммония
В результате гидролиза образовались ионы водорода (H + ), поэтому раствор имеет кислую среду (pH
Видео:Химия | Молекулярные и ионные уравненияСкачать

Соли аммония: получение и химические свойства
Соли аммония
Соли аммония – это соли, состоящие из катиона аммония и аниона кислотного остатка .
Способы получения солей аммония
1. Соли аммония можно получить взаимодействием аммиака с кислотами . Реакции подробно описаны выше.
2. Соли аммония также получают в обменных реакциях между солями аммония и другими солями.
Например , хлорид аммония реагирует с нитратом серебра:
3. Средние соли аммония можно получить из кислых солей аммония . При добавлении аммиака кислая соль переходит в среднюю.
Например , гидрокарбонат аммония реагирует с аммиаком с образованием карбоната аммония:
Химические свойства солей аммония
1. Все соли аммония – сильные электролиты , почти полностью диссоциируют на ионы в водных растворах:
NH4Cl ⇄ NH4 + + Cl –
2. Соли аммония проявляют свойства обычных растворимых солей –вступают в реакции обмена с щелочами, кислотами и растворимыми солями , если в продуктах образуется газ, осадок или образуется слабый электролит.
Например , карбонат аммония реагирует с соляной кислотой. При этом выделяется углекислый газ:
Соли аммония реагируют с щелочами с образованием аммиака.
Например , хлорид аммония реагирует с гидроксидом калия:
NH4Cl + KOH → KCl + NH3 + H2O
Взаимодействие с щелочами — качественная реакция на ионы аммония. Выделяющийся аммиак можно обнаружить по характерному резкому запаху и посинению лакмусовой бумажки.
3. Соли аммония подвергаются гидролизу по катиону , т.к. гидроксид аммония — слабое основание:
4. При нагревании соли аммония разлагаются . При этом если соль не содержит анион-окислителя, то разложение проходит без изменения степени окисления атома азота. Так разлагаются хлорид, карбонат, сульфат, сульфид и фосфат аммония:
Если соль содержит анион-окислитель, то разложение сопровождается изменением степени окисления атома азота иона аммония. Так протекает разложение нитрата, нитрита и дихромата аммония:
При температуре 250 – 300°C:
При температуре выше 300°C:
Разложение бихромата аммония («вулканчик»). Оранжевые кристаллы дихромата аммония под действием горящей лучинки бурно реагируют. Дихромат аммония – особенная соль, в ее составе – окислитель и восстановитель. Поэтому «внутри» этой соли может пройти окислительно-восстановительная реакция (внутримолекулярная ОВР):
Окислитель – хром (VI) превращается в хром (III), образуется зеленый оксид хрома. Восстановитель – азот, входящий в состав иона аммония, превращается в газообразный азот. Итак, дихромат аммония превращается в зеленый оксид хрома, газообразный азот и воду. Реакция начинается от горящей лучинки, но не прекращается, если лучинку убрать, а становится еще интенсивней, так как в процессе реакции выделяется теплота, и, начавшись от лучинки, процесс лавинообразно развивается. Оксид хрома (III) – очень твердое, тугоплавкое вещество зеленого цвета, его используют как абразив. Температура плавления – почти 2300 градусов. Оксид хрома – очень устойчивое вещество, не растворяется даже в кислотах. Благодаря устойчивости и интенсивной окраске окись хрома используется при изготовлении масляных красок.
Видеоопыт разложения дихромата аммония можно посмотреть здесь.
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Нитрат аммония
наименование
210 °C
Нитрат аммония (аммонийная (аммиачная) селитра) — химическое соединение NH4NO3, соль азотной кислоты. Впервые получена Глаубером в 1659 году. Используется в качестве компонента взрывчатых веществ и как азотное удобрение.
Видео:Ионные уравнения реакций. По сокращенному ионному уравнению составляем полное ионное и молекулярное.Скачать

Содержание
- 1 Физические свойства
- 1.1 Растворимость
- 1.2 Состав
- 2 Методы получения
- 2.1 Основной метод
- 2.2 Метод Габера
- 2.3 Нитрофосфатный метод
- 3 Химические свойства
- 4 Кристаллические состояния нитрата аммония
- 5 Применение
- 5.1 Удобрения
- 5.2 Взрывчатые вещества
- 6 Безопасный состав
- 7 Дополнительная информация
Видео:Реакции ионного обмена. 9 класс.Скачать

Физические свойства
Кристаллическое вещество белого цвета. Температура плавления 169,6 °C, при нагреве выше этой температуры начинается постепенное разложение вещества, а при температуре 210 °C происходит полное разложение. Температура кипения при пониженном давлении — 235 °C. Молекулярная масса 80,04 а. е.м. Скорость детонации 2570 м/с.
Растворимость
Растворимость в воде:
| Температура, °C | Растворимость, г/100мл |
|---|---|
| 0 | 119 |
| 10 | 150 |
| 25 | 212 |
| 50 | 346 |
| 80 | 599 |
| 100 | 1024 |
При растворении происходит сильное поглощение тепла (аналогично нитрату калия), что значительно замедляет растворение. Поэтому для приготовления насыщенных растворов нитрата аммония применяется нагревание, при этом твёрдое вещество засыпается небольшими порциями.
Также соль растворима в аммиаке, пиридине, метаноле, этаноле.
Состав
Содержание элементов в нитрате аммония в массовых процентах:
Видео:ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Методы получения
Основной метод
В промышленном производстве используется безводный аммиак и концентрированная азотная кислота:
Реакция протекает бурно с выделением большого количества тепла. Проведение такого процесса в кустарных условиях крайне опасно (хотя в условиях большого разбавления водой нитрат аммония может быть легко получен). После образования раствора, обычно с концентрацией 83 %, лишняя вода выпаривается до состояния расплава, в котором содержание нитрата аммония составляет 95—99,5 % в зависимости от сорта готового продукта. Для использования в качестве удобрения расплав гранулируется в распылительных аппаратах, сушится, охлаждается и покрывается составами для предотвращения слёживания. Цвет гранул варьируется от белого до бесцветного. Нитрат аммония для применения в химии обычно обезвоживается, так как он очень гигроскопичен и процентное количество воды в нём получить практически невозможно.
Метод Габера
По способу Габера из азота и водорода синтезируется аммиак, часть которого окисляется до азотной кислоты и реагирует с аммиаком, в результате чего образуется нитрат аммония:
Нитрофосфатный метод
Этот способ также известен как способ Одда, названный так в честь норвежского города, в котором был разработан этот процесс. Он применяется непосредственно для получения азотных и азотно-фосфорных удобрений из широко доступного природного сырья. При этом протекают следующие процессы:
- Природный фосфат кальция (апатит) растворяют в азотной кислоте:
- Ca3(PO4)2 + 6HNO3 ⟶ 2H3PO4 + 3Ca(NO3)2
- Полученную смесь охлаждают до 0 °C, при этом нитрат кальция кристаллизуется в виде тетрагидрата — Ca(NO3)2·4H2O, и его отделяют от фосфорной кислоты.
- На полученный нитрат кальция, не очищенный от фосфорной кислоты, действуют аммиаком, получая в итоге нитрат аммония:
- Ca(NO3)2 + 4H3PO4 + 8NH3 ⟶ CaHPO4↓ + 2NH4NO3 + 3(NH4)2HPO4
А также амфотерный метод.
Видео:Ионные уравнения реакций. Как составлять полные и сокращенные уравненияСкачать

Химические свойства
Термическое разложение нитрата аммония может происходить по-разному, в зависимости от температуры:
Видео:как составить к сокращенному ионному уравнению молекулярноеСкачать

Кристаллические состояния нитрата аммония
Изменения кристаллического состояния нитрата аммония под воздействием температуры и давления меняют его физические свойства. Обычно различают следующие состояния:
| Система | Диапазон температур (°C) | Состояние | Изменение объёма (%) | |
|---|---|---|---|---|
| — | > 169.6 | жидкость | ||
| I | 169.6 — 125.2 | кубическая | −2.13 | |
| II | 125.5 — 84.2 | тетрагональная | −1.33 | |
| III | 84.2 — 32.3 | α-ромбическая | +0.8 | |
| IV | 32.3 — −16.8 | β-ромбическая | −3.3 | |
| V | −50 — −16.8 | тетрагональная | +1.65 | |
| VI | существует при высоких давлениях | |||
| VII | 170 | |||
| VIII | существует при высоких давлениях | |||
| IX | существует при высоких давлениях |
Фазовый переход от IV к III при 32,3 °C приносит неприятности производителям удобрений, потому как изменения плотности приводят к разрушению частиц при хранении и применении. Это особенно важно в тропических странах, где нитрат аммония испытывает циклические изменения, приводящие к разрушению гранул, слёживанию, повышенному пылению и риску возникновения взрыва.
Видео:Классификация неорганических реакций, РИО, ОВР | Разбор заданий 11,13-15, 20 | Химия ОГЭ 2024Скачать

Применение
Удобрения
Бо́льшая часть нитрата аммония используется либо непосредственно как хорошее азотное удобрение, либо как полупродукт для получения прочих удобрений. Для предотвращения создания взрывчатых веществ на основе нитрата аммония в удобрения, доступные в широкой продаже, добавляют компоненты, снижающие взрывоопасность и детонационные свойства чистого нитрата аммония, такие как мел (карбонат кальция).
В Австралии, Китае, Афганистане, Ирландии и некоторых других странах свободная продажа нитрата аммония даже в виде удобрений запрещена или ограничена. После террористического акта в Оклахома-Сити ограничения на продажу и хранение нитрата аммония были введены в некоторых штатах США.
Взрывчатые вещества
Наиболее широко в промышленности и горном деле применяются смеси аммиачной селитры с различными видами углеводородных горючих материалов, других взрывчатых веществ, а также многокомпонентные смеси:
- составы типа аммиачная селитра/дизельное топливо (АСДТ)
- жидкая смесь аммиачная селитра/гидразин (Астролит)
- водонаполненные промышленные взрывчатые вещества (Акванал, Акванит и др.)
- смеси с другими взрывчатыми веществами (Аммонит, Детонит и др.)
- смесь с алюминиевой пудрой (аммонал)
Аммиачная селитра отличается большой гигроскопичностью, поэтому в качестве взрывчатого вещества не используется, так как в сыром виде взрывчатые свойства утрачиваются.
Видео:Реакция АЛЮМИНИЯ, СЕРЫ и НИТРАТА АММОНИЯ.The reaction of aluminum, sulfur and ammonium nitrateТермитСкачать

Безопасный состав
В 2013 г. сотрудники Sandia National Laboratories объявили о разработке безопасного и эффективного состава на основе смеси нитрата аммония с сульфатом железа, который не может быть использован для создания на его основе взрывчатых веществ. При разложении состава ион SO4 2− связывается с ионом аммония, а ион железа — с нитрат-ионом, что предотвращает взрыв. Введение в состав удобрения сульфата железа может улучшить и технологические характеристики удобрения, особенно на закисленных почвах. Авторы отказались от защиты формулы удобрения патентом с тем, чтобы этот состав мог получить быстрое распространение в регионах с высокой террористической опасностью.
Видео:Реакции ионного обмена. 9 класс.Скачать

Дополнительная информация
Мировое производство аммиачной селитры на 1980 год составляло 14 млн т, в пересчёте на азот.
🔍 Видео
Реакции ионного обменаСкачать

Гидролиз солей. 9 класс.Скачать

ПЕРХЛОРАТ АММОНИЯСкачать

Химический фонтан из УГЛЯ и НИТРАТА АММОНИЯ.Chemical experiment with ammonium nitrate.Опыты по химииСкачать

Разложение нитрита и нитрата аммония ✌️Скачать

Растворение нитрата аммония. Химический опытСкачать

Разложение нитрата аммония! Ammonium nitrate decomposition (and more)!Скачать

Реакции ионного обмена за 45 минут | Химия ЕГЭ 10 класс | УмскулСкачать

разложение НИТРАТА аммония при нагреванииСкачать