При исследованиях веществ в органической химии применяется не один десяток различных качественных реакции, позволяющих определить содержание тех или иных соединений. Такой наглядный анализ позволяет сразу понять, присутствуют ли необходимые вещества, а если же их нет – существенно сократить дальнейшие опыты для их выявления. К таким реакциям относится и нингидриновая, являющаяся основной в визуальном определении аминосоединений.
- Что это такое?
- Вещества, поддающиеся реакции
- Особенности механизма
- Механизм реакции
- Биуретовая проба и другие реакции на белки
- Примеры взаимодействия с аминосоединениями
- Реакция с аминогруппой
- Реакция с гетероциклическим аминосоединением
- Приготовление основного реактива
- Применение
- Реакция с нингидрином на аминокислоты и белки
- Реакция нингидрина с аминокислотами
- ЦВЕТНЫЕ И ИМЕННЫЕ КАЧЕСТВЕННЫЕ РЕАКЦИИ НА БЕЛКИ
- История химии в школьном курсе
- Спектрофотометрическое определение a-аминокислот в разных условиях проведения реакции с нингидрином
- Качественные реакции на аминокислоты, пептиды, белки
- Опыт 5. Реакция глицина с нингидрином.
- Лабораторная работа №1
- 📽️ Видео
Видео:Нингидриновая реакцияСкачать

Что это такое?
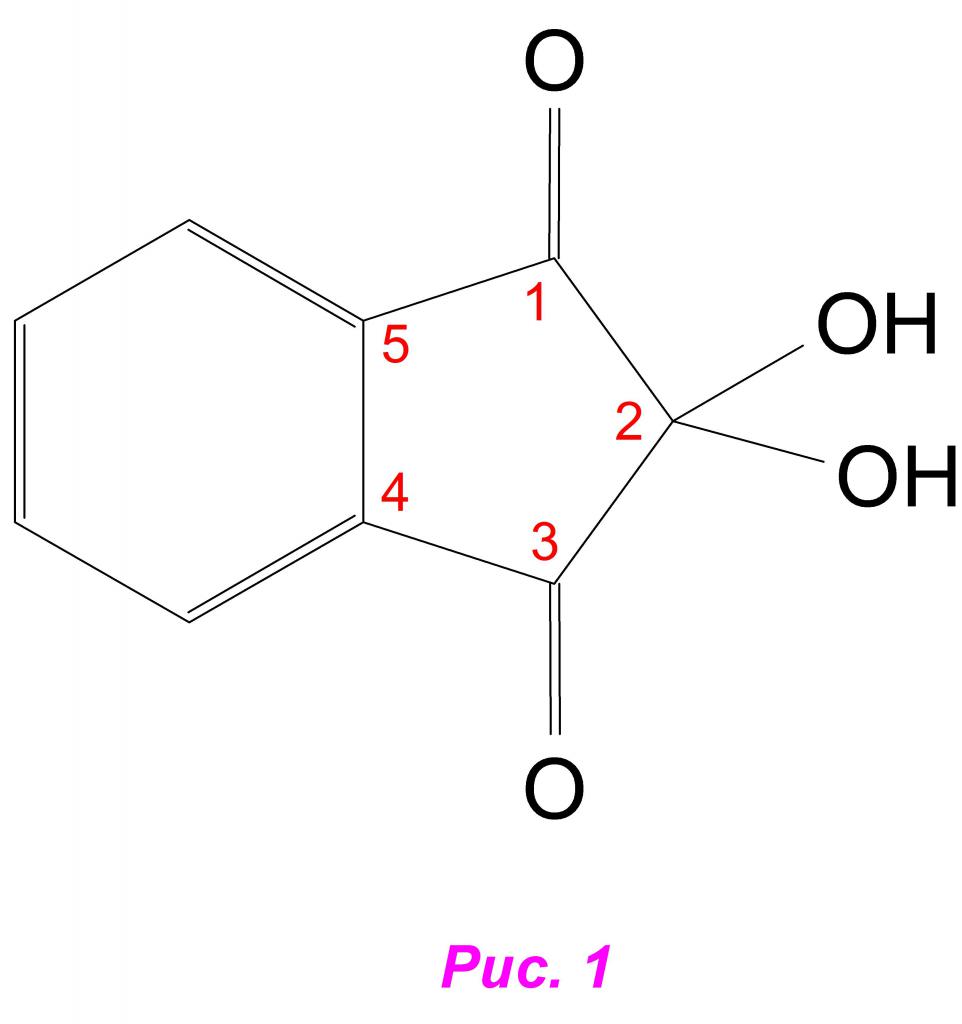
Нингидрин – это дикарбонильное соединение, содержащее одно ароматическое кольцо с присоединенным к нему гетероциклом, у второго атома которого находятся 2 гидроксильные группы (OH — ). Это вещество получают прямым окислением инандиона — 1,3, и, следовательно, по международной номенклатуре оно имеет следующее название: 2,2 – дигидроксиинандион -1,3 (рис. 1).
Чистый нингидрин представляет собой кристаллы желтого или белого цвета, которые при нагревании хорошо растворяются в воде и других полярных органических растворителях, например, в ацетоне. Это довольно вредное вещество, при попадании на кожу в больших количествах или слизистые вызывает раздражение, в том числе и при вдыхании. Работать с этим соединением следует аккуратно и только в перчатках, так как при попадании на кожу дает реакцию с белками клеток кожи и окрашивает ее в фиолетовый цвет.
Видео:Ninhydrin Reaction (Нингидриновая реакция на α-аминокислоты)Скачать

Вещества, поддающиеся реакции
Как было указано выше, нингидриновая реакция используется в первую очередь для визуального определения содержания аминосоединений:
- α-аминокислот (в том числе и в белках);
- аминосахаров;
- алкалоидов, содержащих –NH2 и -NH группы;
- различных аминов.
Следует отметить, что вторичные и третичные амины иногда реагируют очень слабо, поэтому чтобы подтвердить их наличие, необходимо проводить дополнительные исследования.
Для количественного определения используются различные методы хроматографии, например, бумажная (БХ), тонкослойная (ТСХ) или с промыванием твердых носителей раствором нингидрина в различных средах.
Данная реакция не является специфичной по отношению к аминосоединениям, так как вступать в нее реагент может со всеми сразу. Однако со стороны продуктов реакции она имеет особенность в виде выделения пузырьков углекислого газа (CO2), а это характерно только при взаимодействии с α-аминокислотами.
Видео:Нингидрин реакциясы - Нингидриновая реакция - 10 клСкачать

Особенности механизма
В литературе встречаются разные трактовки уравнения нингидриновой реакции. Какие-то исследователи опускают образование гидриндантина из 2-аминоинандиона, который при участии аммиака и нингидрина также образует красящее вещество под названием «пурпурный Руэмана» (или «синий Руэмана»), а другие, наоборот, предполагают только его участие без присутствия промежуточных аминопродуктов. В записи самой реакции также есть некоторые интересные моменты, в особенности это касается способов присоединения аминопроизводного нингидрина к основной его молекуле с образованием красителя. Также остается под вопросом указание места «гулящего водорода», полученного промежуточным амином из водной среды: оно может быть или в кетоновой группе, или рядом с –NH2.
В действительности нюанс с атомом H незначителен, так как его положение в соединении не играет особой роли в ходе реакции, поэтому на него не следует обращать внимание. Что касается пропуска одной из возможных стадий, то здесь причина кроется в теоретическом аспекте: до сих пор точный механизм образования пурпурного Руэмана точно не определен, поэтому можно встретить довольно разные схемы нингидриновой реакции.
Ниже будет предложен наиболее полный возможный ход взаимодействия реактива с аминосоединениями.
Видео:Качественные реакции на белкиСкачать

Механизм реакции
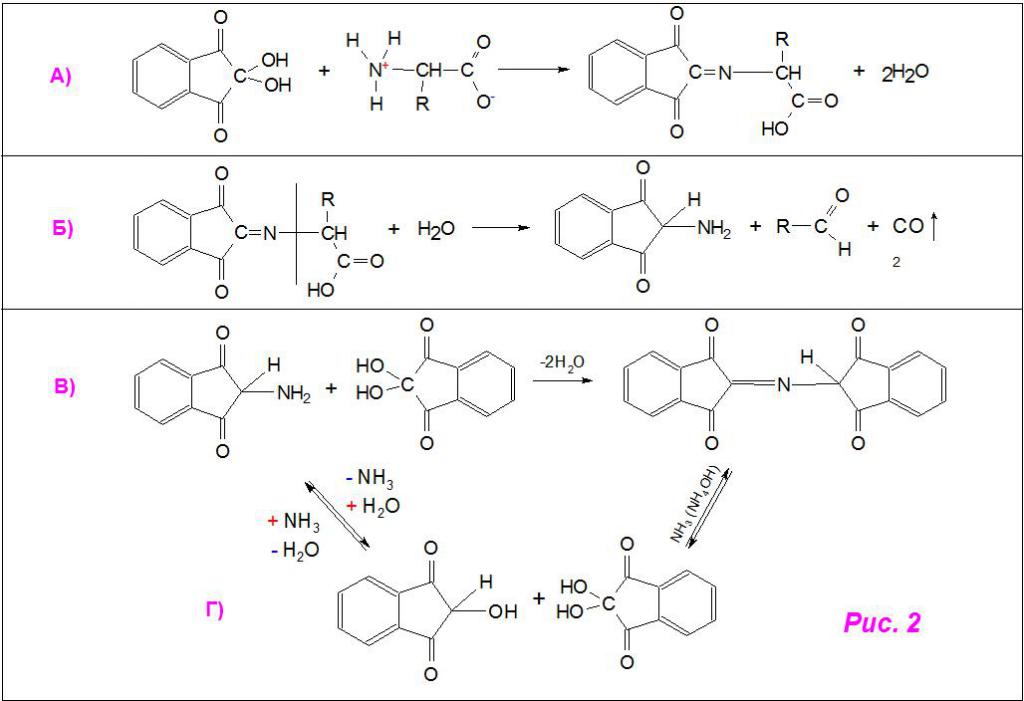
Вначале нингидрин взаимодействует с α-аминокислотой, присоединяя ее по месту отщепления гидрокси-групп и образуя продукт конденсации (рис. 2а). Затем последнее разрушается, выделяя промежуточный амин, альдегид и углекислый газ (рис. 2б). Из конечного продукта при присоединении нингидрина синтезируется структура пурпурного Руэмана (дикетонгидринденкетогидринамин, рис. 2в). Также указано возможное образование из промежуточного амина гидриндантина (восстановленный нингидрин), который в среде аммиака (а точнее, гидроксида аммония) с избытком самого реактива тоже превращается в красящее соединение (рис. 2г).
Образование гидриндантина было доказано самим Руэманом при действии сероводородом на молекулу нингидрина. Это соединение способно растворяться в карбонате натрия Na2CO3, окрашивая раствор в темно-красный цвет. А при добавлении разбавленной соляной кислоты гидриндантин выпадает в осадок.
Скорее всего, промежуточный амин, гидридантин, нингидрин и структура красителя из-за своей неустойчивости при нагревании находятся в некотором равновесии, что позволяет допустить наличие нескольких дополнительных стадий.
Данный механизм подходит для объяснения нингидриновой реакции и с другими аминосоединениями, исключение составляют побочные продукты, образующиеся в результате отщепления остальной части структуры от –NH2, -NH или -N.
Видео:Биуретовая реакцияСкачать

Биуретовая проба и другие реакции на белки
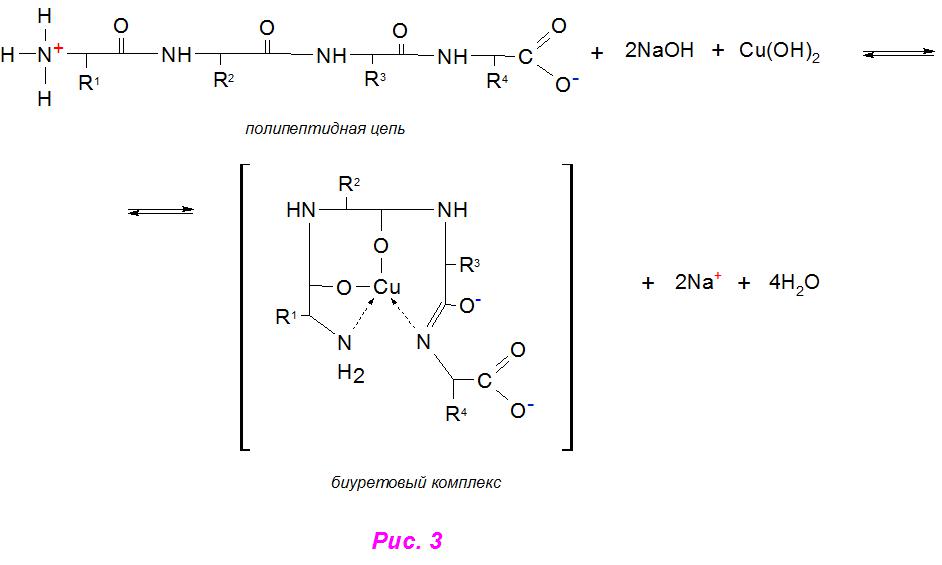
Качественный анализ на пептидные связи даже непротеиновых структур может проходить не только с участием вышеописанного реактива. Однако в случае нингидриновой реакции на белки взаимодействие идет не по –CO-NH‒ группам, а по аминовым. Существует так называемая «биуретовая реакция», которая характеризуется добавлением в раствор с аминосоединениями ионов двухвалентной меди из CuSO4 или Cu(OH)2 в щелочной среде (рис. 3).
В ходе анализа при наличии необходимых структур раствор окрашивается в темно-синий цвет благодаря связыванию пептидных связей в цветной комплекс, что отличает один реактив от другого. Вот почему биуретовая и нингидриновая реакции являются универсальными по отношению к белковым и небелковым структурам с группой –CO-NH‒.
При определении циклических аминокислот используют ксантопротеиновую реакцию с концентрированным раствором азотной кислоты HNO3 , которая при нитровании дает желтую окраску. Капля реактива, попавшая на кожу, также проявляет желтую окраску, реагируя с аминокислотами в клетках кожи. Азотная кислота может оставлять ожоги, поэтому с ней также следует работать в перчатках.
Видео:Видеоурок: Практическая работа № 4. Цветные реакции на белкиСкачать

Примеры взаимодействия с аминосоединениями
Нингидриновая реакция на α-аминокислоты дает хороший визуальный результат, исключением по цвету являются пролиновые и оксипролиновые структуры, которые реагируют с образованием желтой окраски. Возможное объяснение этому эффекту нашли в других условиях среды взаимодействия нингидрина с данными структурами.
Видео:Опыты по химии. Цветные реакции белка: биуретовая; ксантопротеиноваяСкачать

Реакция с аминогруппой
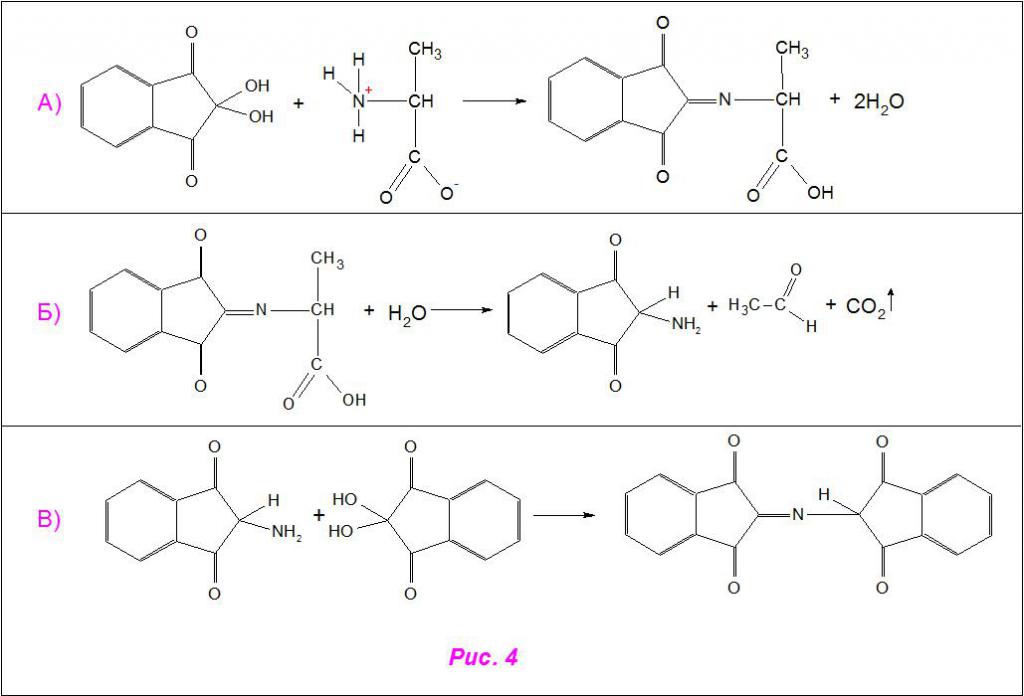
Так как проба не специфична, визуальное обнаружение аланина с помощью нингидриновой реакции в смеси не представляется возможным. Однако методом бумажной хроматографии, при нанесении образцов различных α-аминокислот, их опрыскивании водным раствором нингидрина и проявлением в специальной среде, можно рассчитать количественный состав не только заявленного соединения, но и многих других.
Схематично взаимодействие аланина с нингидрином проходит по тому же принципу. Он присоединяется к реактиву по аминовой группе, а под действием активных ионов гидроксония (H3O + ) отщепляется по месту связи углерода с азотом, распадаясь на уксусный альдегид (CH3COH) и углекислый газ (CO2). Другая молекула нингидрина присоединяется к азоту, вытесняя молекулы воды, и образуется красящая структура (рис. 4).
Видео:Биуретовая реакция белковСкачать

Реакция с гетероциклическим аминосоединением
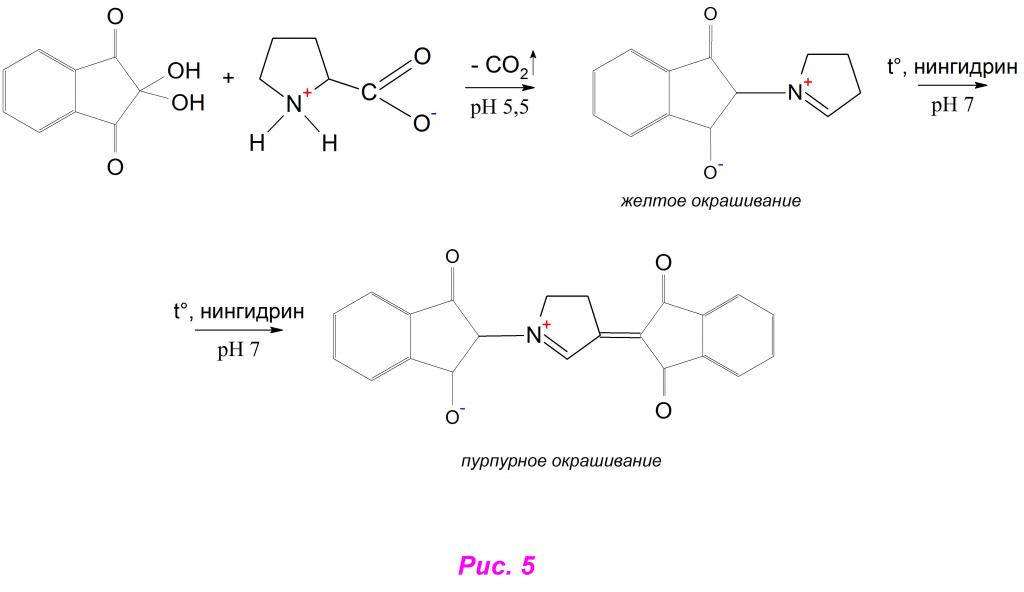
Нингидриновая реакция с пролином является специфичной, особенно в хроматографических анализах, так как такого рода структуры в кислой среде сначала окрашиваются в желтый цвет, а затем в нейтральной приобретают пурпурное окрашивание. Исследователи объясняют это особенностью перестройки цикла в промежуточном соединении, на который влияет именно присутствие большого количества протонов водорода, дополняющих внешний энергетический уровень азота.
Разрушение гетероцикла не происходит, а другая молекула нингидрина присоединяется в нем по 4-му атому углерода. При дальнейшем нагревании полученная структура в нейтральной среде переходит в пурпурный Руэмана (рис.5).
Видео:Биохимия аминокислотСкачать

Приготовление основного реактива
Нингидриновую пробу проводят разными растворами, в зависимости от растворения аминоструктур в тех или иных органических и неорганических соединениях.
Основным реактивом является приготовление 0,2 % раствора в воде. Это универсальная смесь, поскольку большинство соединений хорошо растворяются именно в H2O. Чтобы получить свежеприготовленный реактив, навеску 0,2 г химически чистого нингидрина разбавляют в 100 мл воды.
Стоит отметить, что для некоторых анализируемых растворов эта концентрация является недостаточной, поэтому могут приготовить 1 % или 2 % растворы. Это характерно для вытяжек из лекарственного сырья, поскольку в них содержатся различные классы аминосоединений.
При проведении хроматографических исследований растворы, например, при промывании смеси на твердом носителе через колонку, могут готовить на спирту, диметилсульфоксиде, ацетоне и других полярных растворителях ‒ все будет зависеть от растворителя определенных аминоструктур.
Видео:Транскрипция, трансляция и посттрансляционная модификация белкаСкачать

Применение
Нингидриновая реакция позволяет обнаружить в растворе многие аминосоединения, что определило ее как одну из первых для использования в качественном анализе органических веществ. Визуальное определение значительно сокращает количество опытов, в особенности при анализе малоизученных растений, лекарств и лекарственных форм, а также неизвестных растворов и смесей.
В криминалистике этот метод получил широкое распространение для определения наличия потожировых следов на любых поверхностях.
Даже несмотря на неспецифичность реакции, вывод нингидриновой реакции из химической практики невозможен, так как замены этого вещества на менее токсичные аналоги (например, оксолин) доказали, что они обладают худшей чувствительностью по отношению к аминогруппам и не дают хороших результатов при фотометрических анализах.
Видео:Реакция Фоля на цистеин и цистинСкачать

Реакция с нингидрином на аминокислоты и белки
Видео:Пептидная связь. 11 класс.Скачать

Реакция нингидрина с аминокислотами
Реакция нингидрина с аминокислотами используется для обнаружения и количественного определения аминокислот.
Нингидрин, являющийся сильным окислителем, вызывает окислительное дезаминирование аминокислот, приводящее к образованию СО2, соответствующего альдегида и восстановленной формы нингидрина (1).
Восстановленная форма нингидрина реагирует с избытком нингидрина и NН3. При этом образуется продукт сине-фиолетового цвета (2). Протекающие реакции можно записать следующим образом:
продукт конденсации фиолетового цвета (2)
Ход работы: К 1 мл белка добавляют 2 мл водного 1% р-ра нингидрина и кипятят. Образуется осадок сине-фиолетового цвета.
Видео:Белки - виды аминокислот, суточная потребностьСкачать

ЦВЕТНЫЕ И ИМЕННЫЕ КАЧЕСТВЕННЫЕ РЕАКЦИИ НА БЕЛКИ
История химии в школьном курсе
- РЕАКЦИЯ ПИОТРОВСКОГО (БИУРЕТОВАЯ РЕАКЦИЯ)
В белках аминокислоты связаны друг с другом по типу полипептидов и дикетопиперазинов. Образование полипептидов из аминокислот происходит путем отщепления молекулы воды от аминогруппы одной молекулы аминокислоты и карбоксильной группы другой молекулы:
Образующаяся группа –С(О)–NН– называется пептидной группой, связь С–N, соединяющая остатки млекул аминокислот, – пептидной связью.
При взаимодействии дипептида с новой молекулой аминокислоты получается трипептид и т. д.
Дикетопиперазины образуются при взаимодействии двух молекул аминокислот с отщеплением двух молекул воды:
Дикетопиперазины были выделены из белков Н.Д.Зелинским и В.С.Садиковым в 1923 г.
Наличие в белке повторяющихся пептидных групп подтверждается тем, что белки дают фиолетовое окрашивание при действии небольшого количества раствора медного купороса в присутствии щелочи (биуретовая реакция).
2–3 мл раствора белка нагревают с 2–3 мл 20%-го раствора едкого кали или натра и несколькими каплями раствора медного купороса. Появляется фиолетовое окрашивание вследствие образования комплексных соединений меди с белками.
- РЕАКЦИЯ РУЭМАННА (НИНГИДРИНОВАЯ РЕАКЦИЯ (1911))
a-Аминокислоты реагируют с нингидрином, образуя сине-фиолетовый комплекс (пурпур Руэманна), интенсивность окраски которого пропорциональна количеству аминокислоты.
Реакция идет по схеме:
Реакция с нингидрином используется для визуального обнаружения a-аминокислот на хроматограммах (на бумаге, в тонком слое), а также для колориметрического определения концентрации аминокислот по интенсивности окраски продукта реакции.
В пробирку наливают 1 мл 1%-го раствора глицина и 0,5 мл 1%-го раствора нингидрина. Содержимое пробирки осторожно нагревают до появления сине-фиолетового окрашивания.
Эта реакция на аминокислоту аргинин основана на взаимодействии аргинина с a-нафтолом в присутствии окислителя. Ее механизм еще полностью не выяснен. По-видимому, реакция осуществляется по следующему уравнению:
Поскольку производные хинониминов (в данном случае нафтохинона), у которых водород иминогруппы –NH– замещен на алкильный или арильный радикал, всегда окрашены в желто-красные тона, то, по-видимому, оранжево-красный цвет раствора при проведении реакции Сакагучи объясняется возникновением именно производного нафтохинонимина.
Не исключена, однако, вероятность образования еще более сложного соединения за счет дальнейшего окисления оставшихся NH-групп аргининового остатка и бензольного ядра a-нафтола:
В пробирку наливают 2 мл 0,01%-го раствора аргинина, затем добавляют 2 мл 10%-го раствора едкого натра и несколько капель 0,2% спиртового раствора a-нафтола.
Видео:Качественные реакции на белки в сравнении с реакциями на аминокислоты. Химический опытСкачать

Спектрофотометрическое определение a-аминокислот в разных условиях проведения реакции с нингидрином
Содержимое пробирки хорошо перемешивают, приливают 0,5 мл раствора гипобромита и вновь перемешивают. Немедленно добавляют 1 мл 40%-го раствора мочевины для стабилизации быстро развивающегося оранжево-красного окрашивания.
Это реакция на цистеин и цистин.
При щелочном гидролизе «слабосвязанная сера» в цистеине и цистине достаточно легко отщепляется, в результате чего образуется сероводород, который, реагируя со щелочью, дает сульфиды натрия или калия.
При добавлении ацетата свинца(II) образуется осадок сульфида свинца(II) серо-черного цвета.
В пробирку наливают 1 мл раствора цистина, прибавляют 0,5 мл 20%-го раствора гидроксида натрия. Смесь нагревают до кипения, а затем добавляют 0,5 мл раствора ацетата свинца(II). Наблюдается выпадение серо-черного осадка сульфида свинца(II):
При взаимодействии a-аминокислот с формальдегидом образуются относительно устойчивые карбиноламины – N-метилольные производные, содержащие свободную карбоксильную группу, которую затем титруют щелочью:
Эта реакция лежит в основе количественного определения a-аминокислот методом формального титрования (метод Сёренсена).
В пробирку наливают 5 капель 1%-го раствора глицина и прибавляют 1 каплю индикатора метилового красного. Раствор окрашивается в желтый цвет (нейтральная среда). К полученной смеси добавляют равный объем 40%-го раствора формальдегида (формалин). Появляется красное окрашивание (кислая среда):
- РЕАКЦИЯ Циммермана
Это реакция на аминокислоту глицин.
Описание опыта. К 2 мл 0,1%-го раствора глицина, доведенного добавлением 10%-го раствора щелочи до рН = 8, приливают 0,5 мл водного раствора о-фталевого диальдегида. Реакционная смесь начинает медленно окрашиваться в ярко-зеленый цвет. Через несколько минут выпадает зеленый осадок.
- ОБРАЗОВАНИЕ КОМПЛЕКСОВ С МЕТАЛЛАМИ
a-Аминокислоты образуют с катионами тяжелых металлов внутрикомплексные соли.
Со свежеприготовленным гидроксидом меди(II) все a-аминокислоты в мягких условиях дают хорошо кристаллизующиеся внутрикомплексные (хелатные) соли меди(II) синего цвета:
В таких солях ион меди координационными связями соединен с аминогруппами.
В пробирку наливают 3 мл 3%-го раствора сульфата меди(II), добавляют несколько капель 10%-го раствора гидроксида натрия до образования голубого осадка. К полученному осадку гидроксида меди(II) приливают 0,5 мл концентрированного раствора глицина. При этом образуется темно-синий раствор глицината меди:
- КСАНТОПРОТЕИНОВАЯ РЕАКЦИЯ
Эта реакция используется для обнаружения a-аминокислот, содержащих ароматические радикалы.
Тирозин, триптофан, фенилаланин при взаимодействии с концентрированной азотной кислотой образуют нитропроизводные, имеющие желтую окраску. В щелочной среде нитропроизводные этих a-аминокислот дают соли, окрашенные в оранжевый цвет.
В пробирку наливают 1 мл раствора тирозина и добавляют 0,5 мл концентрированной азотной кислоты. Смесь нагревают до появления желтой окраски.
После охлаждения добавляют 1–2 мл 20%-го раствора гидроксида натрия до появления оранжевой окраски раствора:
- ОСАЖДЕНИЕ БЕЛКА СОЛЯМИ ТЯЖеЛЫХ МЕТАЛЛОВ
Описание опыта. В две пробирки наливают по 1–2 мл раствора белка и медленно, при встряхивании, добавляют по каплям в одну пробирку насыщенный раствор сульфата меди, а в другую – 20%-й раствор ацетата свинца.
Образуются осадки труднорастворимых солеобразных соединений белка. Опыт иллюстрирует применение белка как противоядия при отравлении солями тяжелых металлов.
- Открытие аминного азота в белках
Описание опыта. В сухую пробирку помещают немного сухого белка, например желатины. Прибавляют пятикратное количество натронной извести (смесь едкого натра и гидроксида кальция), перемешивают встряхиванием и подогревают.
Выделяется аммиак, вызывающий посинение розовой лакмусовой бумажки, смоченной водой. Одновременно ощущается запах жженого волоса, что всегда наблюдается при сжигании белковых веществ.
Описание опыта. В пробирку наливают около
0,5 мл раствора уксуснокислого свинца и прибавляют раствор едкого кали до растворения образовавшегося осадка гидроксида свинца.
В другую пробирку наливают
2–3 мл раствора белка и приливают такой же объем полученного раствора плюмбита. Нагревают смесь до кипения в течение 2–3 мин. Появление темного окрашивания указывает на образование сульфида свинца.
- РЕАКЦИЯ НА ПРИСУТСТВИЕ СЕРОСОДЕРЖАЩИХ a-АМИНОКИСЛОТ В БЕЛКЕ
Качественной реакцией на серосодержащие a-аминокислоты является реакция Фоля.
Белки, содержащие остатки цистеина или цистина, также дают эту реакцию.
Описание опыта. В пробирку наливают 10 капель раствора яичного белка и вдвое больший объем 20%-го раствора гидроксида натрия. Содержимое пробирки нагревают до кипения (1–2 мин). К полученному щелочному раствору добавляют 5 капель раствора ацетата свинца(II) и вновь кипятят реакционную смесь.
Наблюдается появление серо-черного осадка.
Триптофан, реагируя в кислой среде с альдегидами, образует окрашенные продукты конденсации. Например, с глиоксиловой кислотой (являющейся примесью к концентрированной уксусной кислоте) реакция протекает по уравнению:
По аналогичной схеме протекает и реакция триптофана с формальдегидом.
В ходе проведенного исследования мы выявили по литературным источникам имеющуюся информацию о цветных качественных реакциях на белковые аминокислоты; выполнили ряд перечисленных реакций и составили базу данных.
Эта база может быть использована в школьной практике как в теоретическом плане, так и в практическом, т. к. мы приводим краткие, но подробные описания выполнения всех опытов.
Из предложенных 18 качественных реакций каждая практически осуществима в школьном курсе химии и имеет важное практическое значение. Сопровождение реакций химическими уравнениями конкретизирует и углубляет знания по биологической и органической химии, особенно знания учащихся специализированных биологических и химических классов.
Использованная литература
Ермаков А.Н., Арасимович В.В., Смирнова-Иконникова М.И., Мирри И.К.
Методы биохимического исследования растений. М.,1952, 520 с.
Полянская А.С., Шевелева А.О. Методическая разработка по лабораторным работам: «Аминокислоты» и «Белки». Л., 1976, 37 с.
Пустовалова Л.М.
Практикум по биохимии. 1999, 541 с.
Руководство к практическим занятиям по органической химии. Под ред. В.М.Родионова.
М., 1954, 111 с.
Соловьев Н.А. Лабораторные работы по биологической химии. Методическая разработка. СПб., 1996, 70 с.
Филиппович Ю.Б., Егорова Т.А., Севастьянова Г.А. Практикум по общей биохимии. М., 1982, 311 с.
З.Саитов, С.В.Телешов, Б.Харитонцев, секция «Юный химик» РХО им.
Д.И.Менделеева (г. Тобольск)
Видео:10 класс Качественные реакции на белкиСкачать

Качественные реакции на аминокислоты, пептиды, белки
Аминокислоты можно обнаружить с помощью цветных реакций: нингидриновой, ксантопротеиновой, Фоля, Милона, биуретовой пробы и др.
Эти реакции неспецифичны, т.к. основаны на обнаружении отдельных фрагментов в структуре аминокислот, которые могут встречаться и в других соединениях.
Нингидриновая реакция, цветная реакция, применяемая для качественного и количественного определения аминокислот, иминокислот и аминов. При нагревании в щелочной среде нингидрина (трикетогидринденгидрата, С9НбО4) с веществами, имеющими первичные аминогруппы (—NH2), образуется продукт, который имеет устойчивую интенсивную сине-фиолетовую окраску с максимальным поглощением около 570 нм.
Т. к. поглощение при этой длине волны линейно зависит от числа свободных аминогрупп, нингидриновая реакция послужила основой для их количественного определения методами колориметрии или спектрофотометрии. Эта реакция используется также для определения вторичных аминогрупп (>NH) в иминокислотах — пролине и оксипролине; в этом случае образуется продукт ярко-жёлтого цвета.
Чувствительность — до 0,01%. Современный автоматический аминокислотный анализ проводят, сочетая ионообменное разделение аминокислот и количественное определение их с помощью нингидриновой реакции.
При разделении смесей аминокислот методом бумажной хроматографии позволяет определять каждую аминокислоту в количестве не менее 2—5 мкг.
По интенсивности окраски можно судить о количестве аминокислот.
Эта реакция положительна не только со свободными аминокислотами, но и пептидами, белками и др.
Ксантопротеиновая реакция позволяет обнаружить ароматические аминокислоты (фенилаланин, тирозин, гистидин, триптофан), основана на реакции электрофильного замещения в ароматическом ядре (нитрование).
При действии концентрированной азотной кислоты, например, на тирозин образуется продукт, окрашенный в желтый цвет.
Реакция Фоля. Это реакция на цистеин и цистин.
При щелочном гидролизе «слабосвязанная сера» в цистеине и цистине достаточно легко отщепляется, в результате чего образуется сероводород, который, реагируя со щелочью, дает сульфиды натрия или калия. При добавлении ацетата свинца(II) образуется осадок сульфида свинца(II) серо-черного цвета.
Описание опыта. В пробирку наливают 1 мл раствора цистина, прибавляют 0,5 мл 20%-го раствора гидроксида натрия.
Смесь нагревают до кипения, а затем добавляют 0,5 мл раствора ацетата свинца(II). Наблюдается выпадение серо-черного осадка сульфида свинца(II):
Реакция Циммермана. Это реакция на аминокислоту глицин.
Описание опыта. К 2 мл 0,1%-го раствора глицина, доведенного добавлением 10%-го раствора щелочи до рН = 8, приливают 0,5 мл водного раствора о-фталевого диальдегида.
Реакционная смесь начинает медленно окрашиваться в ярко-зеленый цвет. Через несколько минут выпадает зеленый осадок.
Реакция на триптофан. Триптофан, реагируя в кислой среде с альдегидами, образует окрашенные продукты конденсации. Например, с глиоксиловой кислотой (являющейся примесью к концентрированной уксусной кислоте) реакция протекает по уравнению:
По аналогичной схеме протекает и реакция триптофана с формальдегидом.
Реакция Сакагучи. Эта реакция на аминокислоту аргинин основана на взаимодействии аргинина с α-нафтолом в присутствии окислителя.
Ее механизм еще полностью не выяснен. По-видимому, реакция осуществляется по следующему уравнению:
Поскольку производные хинониминов (в данном случае нафтохинона), у которых водород иминогруппы –NH– замещен на алкильный или арильный радикал, всегда окрашены в желто-красные тона, то, по-видимому, оранжево-красный цвет раствора при проведении реакции Сакагучи объясняется возникновением именно производного нафтохинонимина.
Не исключена, однако, вероятность образования еще более сложного соединения за счет дальнейшего окисления оставшихся NH-групп аргининового остатка и бензольного ядра α-нафтола:
В пробирку наливают 2 мл 0,01%-го раствора аргинина, затем добавляют 2 мл 10%-го раствора едкого натра и несколько капель 0,2% спиртового раствора α-нафтола. Содержимое пробирки хорошо перемешивают, приливают 0,5 мл раствора гипобромита и вновь перемешивают. Немедленно добавляют 1 мл 40%-го раствора мочевины для стабилизации быстро развивающегося оранжево-красного окрашивания.
Биуретовая реакция – используется как цветная реакция на белки. В щелочной среде в присутствии солей меди(II) они дают фиолетовое окрашивание.
Окраска обусловлена образованием комплексного соединения меди(II), за счет пептидной группы -СО-NH- , которая характерна для белков.
Видео:25. Схема реакции и химическое уравнениеСкачать

Опыт 5. Реакция глицина с нингидрином.
Свое название эта реакция получила от производного мочевины — биурета, который образуется при нагревании мочевины с отщеплением аммиака:
Кроме белков и биурета такое же окрашивание дают и другие соединения, содержащие -эту группу: амиды, имиды карбоновых кислот, а также соединения, содержащие в молекуле группы -CS-NH- или =CH-NH-. Также реакцию дают белки, некоторые аминокислоты, пептиды, биурет и средние пептоны.
Цвет комплекса, получаемый при биуретовой реакции с различными пептидами, несколько отличается и зависит от длины пептидной цепи.
Пептиды с длиной цепи от четырех аминокислотных остатков и выше образуют красный комплекс, трипептиды – фиолетовый, а дипептиды – синий.
кетонная форма полипептида
енольная форма полипептида
При взаимодействии полипептида с Cu (OH)2 образуется комплекс, строение которого можно показать так:
В пробирку поместите 4 капли 0,2н раствора глицина и 2 капли 0,1% раствора нингидрина. Содержимое пробирки осторожно нагрейте до появления сине-красной окраски.
Какие аминокислоты могут быть обнаружены реакцией с нингидрином?
2. Для каких целей может быть использована данная реакция в качественном анализе?
ЗАДАЧИ ДЛЯ САМОСТОЯТЕЛЬНОГО РЕШЕНИЯ
1. При формировании пространственной структуры белковых молекул неполярные радикалы a-аминокислот располагаются внутри макромолекулы, а полярные и ионогенные радикалы-на поверхности. Отнесите следующие аминокислоты к неполярным (гидрофобным) и полярным (гидрофильным); объясните свой выбор: Тре, Цис, Фен, Три, Про, Глн, Сер, Мет, Лей.
Напишите структурные формулы и выберите среди следующих аминокислот положительно и отрицательно заряженные.
Напишите схемы их ионизации в воде:
Асп, Арг, Гис, Глу, Лиз, Асн, Глн, Гли, Тир.
3. В составе природных белков встречаются только L-аминокислоты. Напишите в виде проекций Фишера возможные конфигурационные стереоизомеры для валина, цистеина, изолейцина. Укажите D- и L-стереоизомеры.
4. Для разделения рацемической смеси D- и L-a-аланина его N-ацилированный продукт обрабатывают ферментом ацилазой и извлекают один из энантиомеров водным раствором HCl.
Какой энантиомер образуется под воздействием фермента в растворе в свободном, не ацилированном виде? Напишите реакцию его образования и взаимодействия с HCl.
Метионин (рКа 5,75) и гистидин (рКа 7,58) используют для лечения и предупреждения заболеваний печени. Пользуясь значениями рКа, определите, в какой ионной форме будут находиться перечисленные аминокислоты в крови (рН 7,3-7,5).
Незаменимые аминокислоты триптофан (рКа 5,88) и лизин (рКа 9,74) должны поступать в организм человека с пищей. Пользуясь значениями рКа определите, в какой ионной форме они присутствуют в желудке (рН
1) и в крови (рН 7,3-7,5).
7. Для белкового питания больным внутривенно вводят препарат «Полиамин», состоящий из 13 аминокислот, в том числе аргинина (рКа 10,76) и лейцина (рКа 5,98). Пользуясь значениями рКа, определите, в какой ионной форме будут находиться перечисленные аминокислоты в крови (рН 7,3-7,5).
Тиольная группа цистеина является одной из наиболее реакционноспособной в белках и особенно сильно подвергается модификации. Для выяснения ее роли в проявлении активности ферментов проводят модификацию тиольной группы путем алкилирования йодуксусной кислотой (I-CH2COOH) и йодацетамидом (I-CH2CONH2). Напишите уравнения реакции, назовите реакционные центры, которые участвуют в этом процессе, тип и механизм реакции.
Модификация остатков аминокислот помогает определить их локализацию, либо участие в выполнении биологической функции. В частности ацилирование с помощью радиоактивно моченого уксусного ангидрида было предложено в качестве метода определения локализации остатков лизина, расположенных на поверхности белковой глобулы. Напишите схему реакции ацилирования.
10. Сложные эфиры a-аминокислот обладают летучестью и используются для разделения a-аминокислот методом газожидкостной хроматографии.
Напишите схему образования сложного эфира треонина, укажите тип и механизм реакции, опишите ее механизм.
11. При участии ферментов декарбоксилаз в организме аминокислоты декарбоксилируются с образованием биогенных аминов. Напишите схемы реакций декарбоксилирования гистидина и триптофана.
Назовите продукты реакций, опишите их биологическую роль.
12. В количественном анализе аминокислот применяется метод Ван-Слайка и метод Серенсена. Напишите схемы реакций лежащих в основе этих методов.
13. Образование фенилтиогидантоиновых производных аминокислот используется для установления структуры пептидов.
Напишите схемы реакций получения таких производных для валина и аспарагиновой кислоты. Укажите реагент.
14. Качественная реакция на ароматические аминокислоты – ксантопротеиновая реакиця – основана на образовании нитросоединений под действием азотной кислоты. Напишите схему реакции нитрования тирозина. Укажите механизм реакции.
15. На начальных стадиях биосинтеза кофермента А (HS-KoA) аспарагиновая кислота декарбоксилируется до b-аланина, который образует амид с пантоевой (2,4-дигидрокси-3,3-диметилбутановой) кислотой – пантотеновую кислоту.
Напишите схемы реакций.
16. Трансаминирование – основной путь биосинтеза a-аминокислот, которое осуществляется с участием ферментов трансаминаз (аминотрансфераз) и кофермента пиридоксальфосфата. В этом процессе пиридоксальфосфат играет роль посредника при передаче аминогруппы от a-аминокислоты к оксокислоте. Напишите все схемы реакций, протекающих с участием пиридоксальфосфата в процессе трансаминирования цистеина с участием a-оксоглутаровой кислоты.
По наличию или отсутствию аланинтрансаминазы в сыворотке крови больного инфарктом миокарда можно судить о результатах лечения. К сыворотке крови добавляют a-аланин и a-оксоглутаровую кислоту. Какие продукты образуются, если аланинтрансаминаза присутствует?
У детей страдающих фенилкетонурией в крови (и моче) повышено содержание фенилаланина и продуктов его превращения, которые образуются при последовательном трансаминировании фенилаланина с образованием оксокислоты (А), восстановлении (А) с образованием гидроксикислоты (В), декарбоксилировании (В) с образованием продукта реакции (С). Небольшая часть (С) окисляется до соответствующей кислоты, которая экскретируется с мочой в виде комплекса с глутамином.
Напишите схемы последовательного превращения фенилаланина при фенилкетонурии. Назовите промежуточные продукты.
19. Допишите следующие реакции метаболизма аминокислот:




Катаболизм валина в организме человека включает следующие стади (в указанном порядке):
1) Трансаминирование, приводящее к образованию a-оксокислоты (А).
2) Окислительное декарбоксилирование (А) в присутствии HS-КоА, приводящее к образованию тиоэфира (Б).
3) Дегидрирование (Б) с образованием ненасыщенного производного (В).
4) Гидратация (В) против правила Марковникова с образованием (Г).
5) Гидролиз тиоэфира (Г) с образованием свободной кислоты (Д).
6) НАД+ зависимое окисление первичноспиртового гидроксида вещества (Д) с образованием альдегидокислоты (Е) и т.д.
Напишите эти реакции и назовите промежуточные продукты.
ЗАНЯТИЕ 15.
ПЕПТИДЫ И БЕЛКИ.
ЦЕЛЬ:Сформировать знания:
– принципов структурного построения пептидов и белков;
– первичной структуры пептидов и белков, методов ее определения;
– пространственной организации полипептидной цепи;
– кислотно-основных свойств и гидролиза пептидов;
– синтеза пептидов in vitro.
– писать структуру ди- и трипептидов, используя знания формул a-аминокислот;
– определять изоэлектрическую точку пептидов;
– изображать разные ионные формы пептидов в зависимости от рН среды;
– выполнять характерные и качественные реакции на пептиды и белки.
ВОПРОСЫ ДЛЯ САМОПОДГОТОВКИ К ЗАНЯТИЮ
Биологические функции пептидов и белков.
2. Принцип структурного построения пептидов и белков. Электронное строение и свойства пептидной связи.
Свойства пептидов. Изоэлектрическое состояние и изоэлектрическая точка пептидов, кислотный и щелочной гидролиз пептидов.
4. Первичная структура пептидов и белков. Определение аминокислотной последовательности по Эдману (фенилизотиоцианатный метод).
5. Синтез пептидов in vitro методом «активации» и «защиты» функциональных групп.
Понятие о стратегии пептидного синтеза.
6. Вторичная структура пептидов и белков. Регулярные a-спиральные и b-структурные участки полипептидных цепей. Понятие о третичной и четвертичной структурах белков.
7. Понятие о сложных белках.
Гемоглобин, строение, свойства, значение.
ЛИТЕРАТУРА:
[1]. Тюкавкина Н.А., Биоорганическая химия. / Н.А.Тюкавкина, Ю.И. Бауков– М.: Медицина, 1991.– С. [2]. Гидранович Л.Г. Биоорганическая химия: Учеб. пособие. /Л.Г.Гидранович. – Витебск: ВГМУ, 2009.– С. [3]. Гидранович Л.Г. Лабораторные занятия по биоорганической химии.: Учеб. пособие / Л.Г.Гидранович. – Витебск: ВГМУ, 2012.– С.107-113. [4]. Гидранович Л.Г. Курс лекций по биоорганической химии.– Витебск.– 2003.– С. 197-210.
ЗАДАНИЯ ДЛЯ КОНТРОЛЯ САМОПОДГОТОВКИ К ЗАНЯТИЮ.
1. Подготовить теоретический материал по вопросам для самоподготовки к занятиям.
Оформить протокол лабораторной работы.
3. Решить задачи 1-6,9,14, представленные на страницах 111-113 данного лабораторного практикума.
Примерный вариант заключительного контроля:
Напишите ионные формы дипептида Гис-Про при рН 1,0 и 7,5.
2. Напишите схемы реакций, обозначьте графически действующие реакционные центры, укажите, где возможно, тип и механизм реакций:
СОДЕРЖАНИЕ ЛАБОРАТОРНОГО ПРАКТИКУМА.
Нингидриновый реактив легко окисляется и темнеет при освещении и контакте с воздухом. Его следует хранить на холоду, в темноте и под азотом. Даже максимально короткие трубки подачи реактива приходится с помощью специального покрытия защищать от диффузии воздуха через их стенки. Для восстановления нингидрина в реактив иногда добавляют хлорид олова. От него в трубках постепенно накапливается нерастворимый осадок.
Приготовление нингидринового реактива: в сосуд из оранжевого стекла вместимостью 1 л помещают 375 мл монометилового эфира этиленгликоля ( ТУ 6 — 09 — 08 — 4398 — 77), прибавляют 125 мл натрий-ацетатного буферного раствора рН 5 5, при перемешивании на магнитной мешалке пропускают азот в течение 10 мин, затем прибавляют 10 г нингидрина и вновь пропускают азот в течение 10 мин, продолжая перемешивание на магнитной мешалке до полного растворения нингидрина.
После этого прибавляют 0 19 г олова двухлористого 2-водного и перемешивают.
Приготовление нингидринового реактива: 40 мг SnQ2 2Н2О растворяют в 25 мл цитратного буферного раствора и добавляют 4 0 мг нингидрина, предварительно растворенного в 12 5 мп метилцеллозольва.
Проявление проводят нингидриновым реактивом. Затем стеклянную пластинку с адсорбентом нагревают в сушильном шкафу 30 мин при 110 С.
Хрома-тограмму амина проявляют нингидриновым реактивом, причем после смачивания нингидрином нужно нагревать бумагу 5 мин при 105 С для получения интенсивной фиолетовой окраски.
Схема нингидринового анализатора, изготовленного из автоанализатора фирмы Technicon Chromatography Co.
Далее к пробе добавляется нингидриновый реактив, аналогичный по составу, описанному на стр.
Для определения пролина готовят нингидриновый реактив, содержащий 40 мл 6 М Н3Р04, 60 мл ледяной уксусной кислоты и 2 5 г нингидрина на каждые 100 мл смеси.
Для растворения нингидрина эту смесь нагревают до 70 на водяной бане.
Схема нингидринового анализатора, изготовленного из автоанализатора фирмы Technicon Chromatography Co. Далее к пробе добавляется нингидриновый реактив, аналогичный по составу, описанному на стр.
Последнее затруднение удалось преодолеть, применяя нингидриновый реактив, содержащий хлористое олово.
Важной особенностью работы автоматического аппарата является исключительно постоянный фон: 0 001 единиц оптической плотности до и после каждого пика. Уже с 1 / 10 мкмоль растворенного вещества можно получать удовлетворительные результаты; ввиду отличной воспроизводимости объемов вытекания удается идентифицировать компоненты смеси, присутствующие в низких концентрациях.
Применение тонкослойной хроматографии для проверки препаративного разделения на колонках ( с разрешения Am.
Chem. Soc.. Перешедшее на нее небольшое количество аминокислот элюировали нингидриновым реактивом. Разделенные на секции зоны анализировали далее методом ТСХ.
Розен [16] усовершенствовал методику Пье и Моррис [30], внеся некоторые изменения в состав нингидринового реактива, позволяющие получать более стабильные результаты и к тому же упрощающие методику.
Фактический предел детектирования ниже и до некоторой степени зависит от условий высушивания после нанесения нингидринового реактива.
Пробу ( 0 5 мл), если необходимо, разбавляют буфером еще до 2 мл и смешивают с 2 мл нингидринового реактива.
Петри; 7) NaHCO3; 8) 5 % — ная PbNO3 или РЬ ( СН3СОО) 2; 9) реактив Сальковского; 10) реактив Эрлиха; 11) нингидриновый реактив; 12) реактив Несслера; 13) гумусная почва; 14) свежие листья люпина или засушенные листья других бобовых; 15) рыбная, м
Видео:Денатурация БЕЛКА. Реакция со СПИРТОМ и АЦЕТОНОМ. Реакции с белком. Опыты по химии дома.Скачать

Лабораторная работа №1
Лабораторная работа №1
ХИМИЯ ПРОСТЫХ БЕЛКОВ.
ЦВЕТНЫЕ РЕАКЦИИ НА БЕЛКИ И АМИНОКИСЛОТЫ
Белки представляют собой высокомолекулярные полимерные органические соединения, построенные из остатков различных α-аминокислот, соединенных ковалентной пептидной связью.
Присутствие белка в растворах можно обнаружить с помощью цветных реакций, обусловленных наличием в белке аминокислот, их специфических групп и пептидных связей. Существуют универсальные цветные реакции, т. е. на все белки (биуретовая и нингидриновая), и специфические, т. е. на определенные аминокислоты (ксантопротеиновая, Миллона, Фоля и др.).
На основании некоторых цветных реакций разработаны методы количественного определения белков и аминокислот, которые широко используются в биохимических лабораториях.
Цель: Ознакомиться с универсальными цветными реакциями на белки и специфическими реакциями на отдельные аминокислоты, содержащиеся в белковых растворах.
Работа 1. Биуретовая реакция на пептидную связь (Пиотровского)
Биуретовая реакция обусловлена наличием в белке пептидных связей, которые в щелочной среде образуют с сернокислой медью комплексы фиолетового цвета с красным или синим оттенком. Группа, образующая пептидную связь, в щелочной среде присутствует в своей таутомерной енольной форме:
При избытке щелочи происходит диссоциация ОН-группы, появляется отрицательный заряд, с помощью которого кислород взаимодействует с медью. Возникает солеобразная связь. Кроме того, медь образует дополнительные координационные связи с атомами азота, участвующими в пептидной связи, путем использования их электронных пар. Возникающий таким образом комплекс очень стабилен. Интенсивность окраски комплекса зависит от концентрации белка и количества медной соли в растворе.
Биуретовой реакцией обнаруживаются все без исключения белки, а также продукты их неполного гидролиза – пептоны и полипептиды. Для ди — и трипептидов биуретовая реакция ненадежна. Оттенок зависит от длины полипептидной цепочки. Пептоны при этой реакции дают розовое или красное окрашивание. Биуретовая реакция положительна и с веществами небелкового характера, имеющими в составе не менее двух – CO – NH2-групп, к ним относятся, например, оксамид – NH2 – CO – CO – NH2, биурет – N2H – CO – NH – CO – NH2.
Исследуемый материал: раствор яичного белка, раствор растительного белка, 1% раствор желатина.
Реактивы: 10% раствор NaOH, 1% раствор CuSO4.
Оборудование: пробирки, капельницы.
Ход работы. К 5 каплям водного раствора белка добавляют 5 капель 10% раствора NaOH и 2 капли 1% раствора CuSO4. Содержимое перемешивают. Оно приобретает сине-фиолетовый цвет. Нельзя добавлять избыток CuSO4, так как синий осадок маскирует характерное фиолетовое окрашивание биуретового комплекса.
Работа 2. Нингидриновая реакция на α-аминокислоты
Белки, полипептиды и свободные α-аминокислоты дают синее или фиолетовое окрашивание с нингидрином. При нагревании белка с водным раствором нингидрина аминокислоты окисляются и распадаются, образуя СО2, NH3 и соответствующий альдегид. Нингидрин, являясь сильным окислителем, вызывает окислительное дезаминирование α-аминокислоты, приводящее к образованию аммиака, двуокиси углерода, соответствующего альдегида и восстановленной формы нингидрина. Нингидрин восстанавливается и связывается со второй молекулой нингидрина посредством молекулы аммиака, образуя продукты конденсации, окрашенные в синий, фиолетовый, красный, а в случае пролина – в желтый цвет.
📽️ Видео
Биохимия. Качественные реакции для определения белков, аминокислот и углеводов (С. Смирнов)Скачать

Понятно и просто: биосинтез белка для ЕГЭ по биологииСкачать