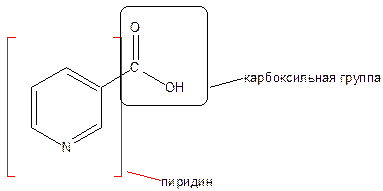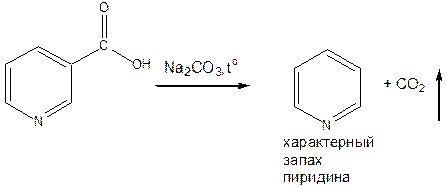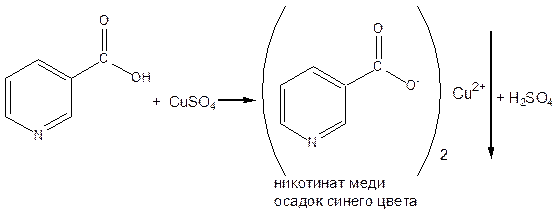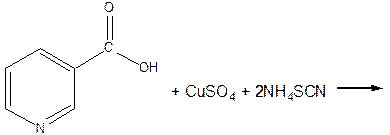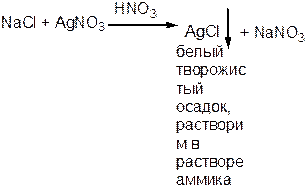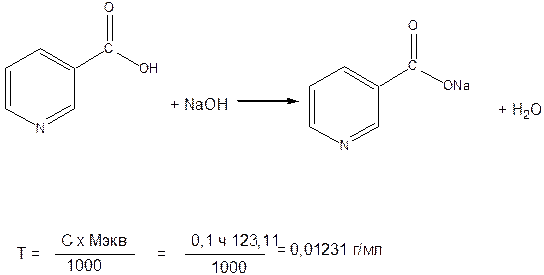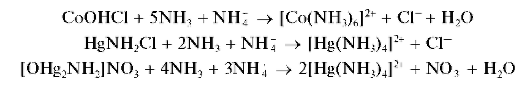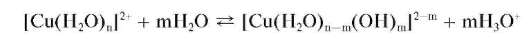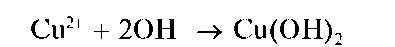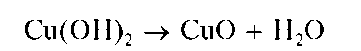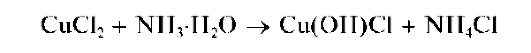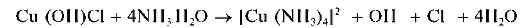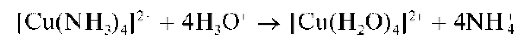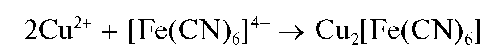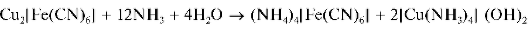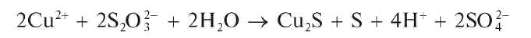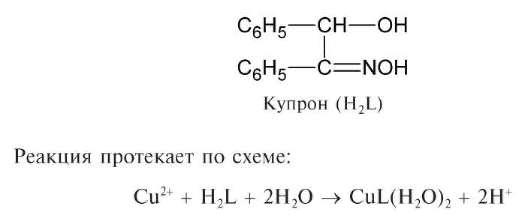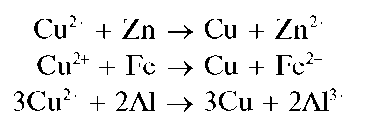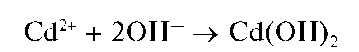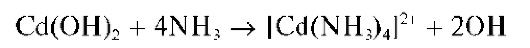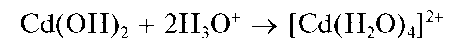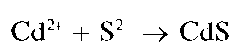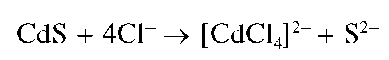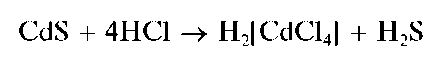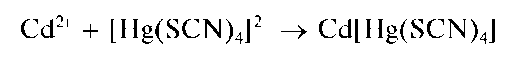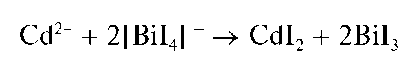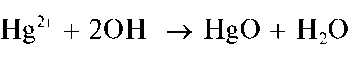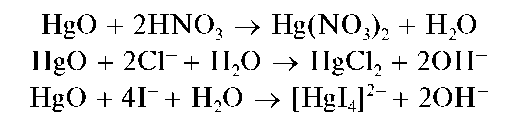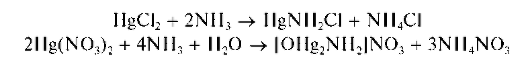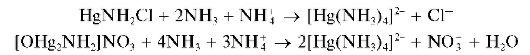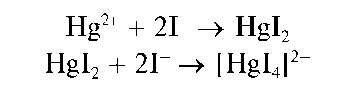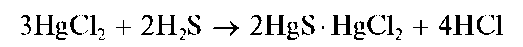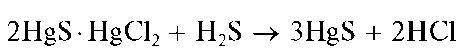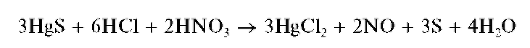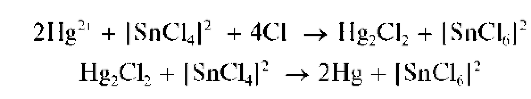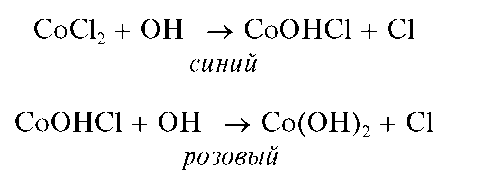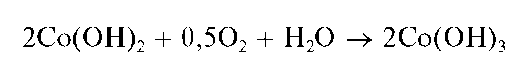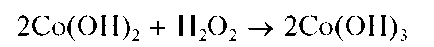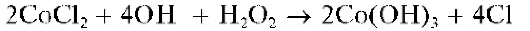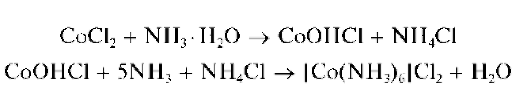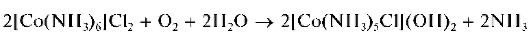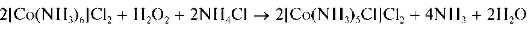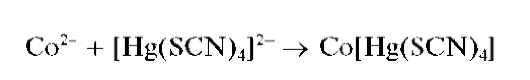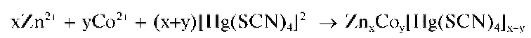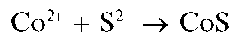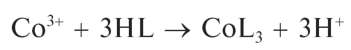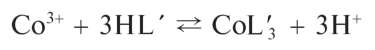Пиридинкарбоновая – 3 кислота
Никотиновая кислота является производным пиридина.
Описание: белый кристаллический порошок без запаха слабокислого вкуса.
Растворимость: трудно растворим в воде и спирте, растворим в горячей воде, очень мало растворим в эфире.
- ИК-спектр , снятый с таблетках, спрессованных с бромидом калия, или вазелиновом масле (пикамилон), должны иметь полное совпадение полос поглощения и их интенсивности с прилагаемыми к ФС рисунками спектров.
- УФ-спектр 0,002% раствора в 0,1 М растворе гидроксида натрия должне иметь в области 230-320 нммаксимумы поглощения при 258, 264, 270 нм; минимум поглощения при 240 нм и два плеча в области 240-258 нм.
- Т пл 234-238 о С.
- Пиролиз с натрия карбонатом кристаллическим. Образуется пиридин, который легко обнаружить по запаху. Навеску препарата нагревают с натрия гидрокарбонатом кристаллическим. Развивается характерный запах пиридина.
- Реакция комплексообразования. Реакция основана на способности кислоты никотиновой образовывать комплексы с солями меди (II). К теплому раствору кислоты никотиновой прибавляют раствор меди сульфата (II). Выпадает нерастворимый осадок никотината меди.
- Реакция комплексообразования. К водному раствору препарата прибавляют раствор меди сульфата (II) и раствор роданида аммония. Появляется устойчивое зеленое окрашивание.
- Прозрачность и цветность.
- Хлориды. Не должно быть помутнения.
- Сульфаты. Не должно быть помутнения раствора.
- Нитраты. Не должно появляться голубого окрашивания.
5. 2,6-пиридиндикарбоновая кислота. К водному раствору препарату прибавляют раствор закисного железа. Окраска не должна быть интенсивнее эталона.
Потеря в весе при высушивании.
6.Потеря в весе при высушивании.
7. Сульфатная зола и тяжелые металлы.
Алкалиметрия. Вариант нейтрализации. Метод основан на кислотных свойствах никотиновой кислоты.
Около 0,3 г препарата (точная навеска) помещают в коническую колбу ёмкостью 100 мл, растворяют в 25 мл свежеприготовленной прокипяченной горячей воды и по охлаждении титруют 0,1 н раствором едкого натра до не исчезающего в течение 1 – 2 минут розового окрашивания (индикатор – фенолфталеин).
1 мл 0,1 н раствора едкого натра соответствует 0,01231 г кислоты никотиновой, которой в препарате должно быть не менее 99,5% в пересчете на сухое вещество.
Т – 0,1 М гидроксид натрия
Хранение: список Б, в хорошо укупоренной таре, предохраняющей от действия света.
Применение: витаминный препарат группы Б, сосудорасширяющее, гипохолестеринемическое средство.
Видео:Качественная реакция на ион двухвалентной медиСкачать

Способ получения тиоцианата меди (i)
Владельцы патента RU 2289545:
Способ получения тиоцианата меди (I) относится к области химической технологии неорганических веществ. Продукт, полученный этим способом, может быть использован в качестве пигмента для необрастающих составов, катализатора процессов органического синтеза, стабилизатора искусственных волокон, для приготовления электролитов гальванического меднения, для получения других соединений меди. Тиоцианат меди (I) получают кристаллизацией из реакционного водного раствора, содержащего медь (II), тиоцианат, реагент-восстановитель. В качестве источника меди (II) используют отработанные растворы травления печатных плат или отработанные электролиты гальванического меднения различного химического состава. При этом рН в реакционном водном растворе устанавливают от 0,0 до 9,5. Предложенное изобретение позволяет снизить материальные затраты на получение тиоцианата меди (I), расширить арсенал применяемых для получения тиоцианата меди (I) медьсодержащих материалов, повысить технологичность процесса получения тиоцианата меди (I), утилизировать токсичные отходы и снизить затраты на охрану окружающей среды при производстве печатных плат и гальванических покрытий. 2 з.п. ф-лы.
Изобретение относится к области химической технологии неорганических веществ, в частности к способу получения тиоцианата меди (I). Вещество, получаемое этим способом, может применяться в качестве пигмента для необрастающих составов, катализатора процессов органического синтеза, стабилизатора искусственных волокон, для приготовления электролитов гальванического меднения, для получения других соединений меди.
Известен электрохимический способ получения тиоцианата меди (I), состоящий в растворении медного анода в водном растворе, содержащем тиоцианат калия, хлорид натрия, хлороводород, отделении осадка тиоцианата меди (I) от раствора фильтрованием при пониженном давлении и высушивании осадка при температуре 100-105°С (Авт. свид. СССР №423755 МПК С 01 G 3/00, опубл. 1975; Свиридов В.В., Попкович Г.А., Василевская Е.И. Неорганический синтез. — Минск: «Унiверсiтэцкае», 2000, с.209). Недостатком способа является необходимость дополнительных затрат на реагент — металлическую медь и дополнительных затрат на электроэнергию.
Известен химический способ получения тиоцианата меди (I), включающий нагревание порошка металлической меди с тиоцианатом аммония в неводном растворителе на основе диметилформамида или диметилсульфоксида, кристаллизацию тиоцианата меди (I) путем его осаждения из неводного раствора водой, отделение осадка от раствора фильтрованием и высушивание осадка при температуре 100-105°С (Свиридов В.В., Попкович Г.А., Василевская Е.И. Неорганический синтез. — Минск: «Унiверсiтэцкае», 2000, с.208; Авторское свидетельство СССР №1038283 МПК С 01 G 3/00, С 01 С 3/20, опубл. 1983). Недостатком способа является необходимость дополнительных затрат на реагент — металлическую медь и дополнительных затрат на неводный растворитель.
Известен способ получения тиоцианата меди (I), включающий обработку избытком диоксида серы при 40-50°С водной суспензии, содержащей гидроксиды металлов, главным образом гидроксид железа (III) и гидроксид меди (II), и тиоцианат при мольном соотношении гидроксид меди (II) : тиоцианат 1,0:1,0, кристаллизацию целевого продукта из раствора и его отделение от раствора фильтрованием (Авт. свид. СССР №1798324 МПК С 02 F 1/62). Способ основан на реакции:
Способ позволяет получать тиоцианат меди (I) из осадков с высоким содержанием меди (II), образующихся при нейтрализации сточных вод гальванических производств. Недостатками способа являются необходимость дополнительных затрат на нагревание реакционной смеси, недостаточно высокая чистота образующегося тиоцианата меди (I), недостаточно высокий выход целевого продукта, необходимость использовать большой избыток токсичного диоксида серы.
Известен способ получения тиоцианата меди (I), включающий приготовление реакционного раствора, содержащего соль меди (II), тиоцианат, реагент-восстановитель, с последующим выпадением целевого продукта в осадок (Реми Г. Курс неорганической химии. Т.2. — М.: Мир, 1974, с.381).
Известен также способ получения тиоцианата меди (I), включающий приготовление реакционного раствора, содержащего медь (II), тиоцианат калия, реагент-восстановитель, с последующим выделением целевого продукта в осадок (Рипан Р., Четяну И. Неорганическая химия. Т.2. — М.: Мир, 1972, с.702). В качестве реагента-восстановителя в указанном способе используют сульфат железа (II), диоксид серы, сульфиты щелочных металлов. Способ основан, в частности, на реакции:
Недостатком двух последних способов получения тиоцианата меди (I) является необходимость дополнительных затрат на реагент — соль меди (II).
Наиболее близким к заявленному способу является способ получения тиоцианата меди (I), включающий приготовление реакционного водного раствора, содержащего медь (II), тиоцианат, реагент-восстановитель, кристаллизацию целевого продукта из раствора, отделение осадка от раствора и высушивание осадка (Беленький Е.Ф., Рискин И.В. Химия и технология пигментов. IV изд. — Л.: Химия, 1974, с.644). Способ основан на реакции:
Выделяющуюся в результате реакции серную кислоту нейтрализуют раствором карбоната натрия для поддержания в реакционном растворе значения рН 2,6-2,8 с повышением значения рН после окончания процесса до 4,5-5,0. Процесс ведут при комнатной температуре. Для обеспечения полноты восстановления меди (II) до меди (I) в способе по прототипу используют небольшой избыток сульфита натрия. Недостатком этого способа является необходимость дополнительных затрат на реагент — сульфат меди (II), а также необходимость дополнительных затрат на улавливание выделяющегося токсичного побочного продукта реакции — диоксида серы.
При создании изобретения ставилась задача снизить материальные затраты на получение тиоцианата меди (I), расширить арсенал медьсодержащих материалов, применяемых для получения тиоцианата меди (I), повысить технологичность процесса получения целевого продукта, утилизировать токсичные отходы производства, снизить затраты на охрану окружающей среды при производстве печатных плат и гальванических покрытий.
Это достигается тем, что способ получения тиоцианата меди (I) включает приготовление реакционного водного раствора, содержащего медь (II), тиоцианат, реагент-восстановитель, кристаллизацию целевого продукта из раствора, отделение осадка от раствора и высушивание осадка.
Новым в этом способе является то, что для приготовления реакционного водного раствора в качестве источника меди (I) используют отходы производства — отработанный раствор травления печатных плат, содержащий в качестве основных компонентов медь (II), минеральную кислоту, или отработанный раствор травления печатных плат, содержащий в качестве основных компонентов медь (II), минеральную кислоту, соли аммония, или отработанный раствор травления печатных плат, содержащий в качестве основных компонентов медь (II), соли аммония, аммиак, или отработанный электролит гальванического меднения и в реакционном водном растворе устанавливают рН от 0,0 до 9,5. В качестве отработанного электролита гальванического меднения желательно использовать электролит, содержащий медь (II), серную кислоту или сульфаминовую кислоту, или тетрафтороборную кислоту, или гексафторокремниевую кислоту. В качестве реагента-восстановителя предпочтительно используют сульфит, тиосульфат, дитионит, гидразин, гидроксиламин, борогидрид, формальдегид, аскорбиновую кислоту, глюкозу.
Способ получения тиоцианата меди (I) заключается в приготовлении реакционного водного раствора путем смешивания отработанного раствора травления печатных плат, содержащего медь (II), или отработанного электролита гальванического меднения с реагентом, являющимся источником тиоцианата, и с реагентом-восстановителем или с их водными растворами, корректировании (при необходимости) значения рН реакционного водного раствора, кристаллизации тиоцианата меди (I) из раствора в течение определенного времени, отделении осадка от раствора, промывании (при необходимости) осадка растворителем и высушивании осадка.
Способ получения тиоцианата меди (I) основан на реакциях, например:
Для получения тиоцианата меди (I) желательно использовать медьсодержащие отработанные растворы травления печатных плат следующих видов: медно-аммиачные (содержат медь (II), аммиак, хлорид аммония), медно-щелочные (содержат медь (II), аммиак, хлорид аммония, карбонат аммония), медно-сульфатные (содержат медь (II), аммиак, сульфат аммония), кислые медно-хлоридные (содержат медь (II), соляную кислоту, хлорид аммония), кислые медно-сульфатные (содержат медь (II), серную кислоту, сульфат аммония), хлоритные (содержат медь (II), аммиак, хлорид аммония, хлорид натрия, хлорит натрия), пероксодисульфатные (содержат медь (II), аммиак, сульфат аммония, пероксодисульфат аммония или медь (II), серную кислоту, сульфат аммония, пероксодисульфат аммония), пероксидные (содержат медь (II), серную кислоту или медь (II), соляную кислоту) и некоторые другие. Отработанные растворы травления печатных плат являются одним из основных видов отходов радиоэлектронного производства, которые в больших количествах образуются при производстве печатных плат. Они содержат в высоких концентрациях медь (II) и некоторые другие компоненты, что определяет их токсичность для человека, животных и растений. Нейтрализация этого вида отходов радиоэлектронного производства требует значительных расходов (Федулова А.А., Устинов Ю.А., Котов Е.П., Шустов В.П., Явич Э.Р. Технология многослойных печатных плат. — М.: Радио и связь, 1990, С.186; Флеров В.Н. Химическая технология в производстве радиоэлектронных деталей — М.: Радио и связь, 1988, с.47).
Для получения тиоцианата меди (I) также желательно использовать отходы гальванического производства — отработанные электролиты меднения следующих видов: сульфатные (содержат медь (II), серную кислоту), сульфаматные (содержат медь (II), сульфаминовую кислоту), фтороборатные (содержат медь (II), тетрафтороборную кислоту, борную кислоту), фторосиликатные (содержат медь (II), гексафторокремниевую кислоту), хлоридные (содержат медь (II), хлороводород, уксусную кислоту) и некоторые другие (Гальванотехника. Справочник (под ред. Гинберга A.M., Иванова А.Ф., Кравченко Л.Л.). — М.: Металлургия, 1987, с.170).
Отработанные электролиты гальванического меднения содержат медь в форме меди (II), отработанные растворы травления печатных плат содержат медь, в основном, в форме меди (II), в меньшей степени — в форме меди (I), в то время как целевой продукт является солью меди (I). Поэтому для перевода меди (II) в медь (I) в реакционный водный раствор прибавляют реагент, обладающий свойствами восстановителя, в количестве, равном или большем, чем 1 эквивалент реагента-восстановителя на 1 моль меди (II) в медьсодержащем отходе производства печатных плат и гальванических покрытий. В качестве реагента-восстановителя могут быть использованы сульфиты, гидросульфиты, пиросульфиты, диоксид серы, тиосульфаты, дитиониты, гидразин и соли гидразиния, фенилгидразин и соли фенилгидразиния, гидроксиламин и соли гидроксиламмония, тетрагидридобораты, железо (II), альдегиды, моносахариды и восстанавливающие дисахариды, аскорбиновая кислота и ряд других веществ. По экспериментальным данным при получении тиоцианата меди (I) заявленным способом для восстановления меди (II) до меди (I) в отработанном растворе травления печатных плат или в отработанном электролите гальванического меднения наиболее пригодны следующие реагенты: сульфиты и гидросульфиты щелочных металлов и аммония, тиосульфаты щелочных металлов, дитиониты щелочных металлов, гидразин и его соли, гидроксиламин и его соли, формальдегид, аскорбиновая кислота, глюкоза, взятые по отдельности или в виде смеси друг с другом.
Для получения целевого продукта с высоким выходом необходимо устанавливать в реакционном водном растворе оптимальное значение рН. По экспериментальным данным при значениях рН ниже 0,0 выход тиоцианата меди (I) снижается за счет увеличения его растворимости в сильнокислой среде:
CuSCN+H + →Cu + +HSCN.
При значениях рН выше 9,5 выход тиоцианата меди (I) также снижается в результате протекания нежелательных реакций, например:
Поэтому для повышения выхода целевого продукта в реакционном водном растворе необходимо устанавливать рН от 0,0 до 9,5.
К 10,0 мл отработанного раствора травления печатных плат с концентрацией меди (II) 1,65 моль/л, аммиака 4,2 моль/л, хлорида аммония 0,22 моль/л, карбоната аммония 3,8 моль/л при перемешивании прибавляют 21 мл 15%-ного раствора тиоцианата калия ГОСТ 4139-75 марки «ч» и 19 мл 10%-ного раствора сульфита натрия ГОСТ 195-77 марки «ч». К полученному раствору при перемешивании по каплям прибавляют раствор азотной кислоты ГОСТ 4461-77 марки «ч» с концентрацией 5,0 моль/л до достижения рН 7,3. Раствор оставляют для кристаллизации на 2 суток при температуре 18-20°С. Осадок отфильтровывают при пониженном давлении на стеклянном фильтре ПОР 40, промывают осадок на фильтре сначала водой, затем ацетоном. Осадок высушивают на воздухе при комнатной температуре до постоянной массы. Выход 99,8%.
Найдено, %: Cu — 52,2; С — 9,4; S-26,1.
Вычислено для CuSCN, %: Cu — 52,25; С — 9,88; S — 26,36.
К 10,0 мл отработанного раствора травления печатных плат с концентрацией меди (II) 0,51 моль/л, аммиака 4,1 моль/л, сульфата аммония 0,74 моль/л, пероксодисульфата аммония 0,05 моль/л при перемешивании прибавляют 3,0 мл раствора тиоцианата калия с концентрацией 332 г/л и 5,5 мл раствора сульфита натрия с концентрацией 117 г/л. К полученному раствору при перемешивании по каплям прибавляют концентрированную азотную кислоту ГОСТ 4461-77 марки «чда» до достижения рН 6,4. Раствор оставляют для кристаллизации на 3 суток при температуре 23-25°С. Осадок отфильтровывают при пониженном давлении на стеклянном фильтре ПОР 16, промывают осадок на фильтре сначала водой, затем этанолом. Осадок высушивают на воздухе при комнатной температуре до постоянной массы. Выход 99,7%.
Найдено, %: Cu — 52,0; С — 9,7; S — 26,1.
К 10,0 мл отработанного раствора травления печатных плат с концентрацией меди (II) 1,45 моль/л, аммиака 4,8 моль/л, хлорида аммония 0,45 моль/л, карбоната аммония 0,55 моль/л при перемешивании прибавляют сначала раствор 4,3 г глюкозы в 20 мл воды, затем 10,5 мл раствора тиоцианата натрия ГОСТ 10643-75 марки «ч» с концентрацией 2,8 моль/л. К полученному раствору при перемешивании по каплям прибавляют концентрированную азотную кислоту ГОСТ 4461-77 марки «ч» до достижения рН 4,5. Раствор оставляют для кристаллизации на 2 суток при комнатной температуре. Осадок отфильтровывают на бумажном фильтре «синяя лента», промывают водой и высушивают в сушильном шкафу при температуре 85-90°С до постоянной массы. Выход 99,4%.
Найдено, %: Cu — 52,3; С — 9,1; S — 25,4.
К 10,0 мл отработанного раствора травления печатных плат с концентрацией меди (II) 1,58 моль/л, аммиака 4,2 моль/л, хлорида аммония 0,39 моль/л, карбоната аммония 2,5 моль/л при перемешивании прибавляют сначала раствор 2,8 г аскорбиновой кислоты в 20 мл воды, затем раствор 3,1 г тиоцианата калия ГОСТ 4139-75 марки «чда» в 10 мл воды. К полученному раствору при перемешивании по каплям прибавляют раствор азотной кислоты ГОСТ 4461-77 марки «чда» с концентрацией 5,5 моль/л до достижения рН 7,0. Раствор оставляют для кристаллизации на 10 часов при комнатной температуре. Осадок отфильтровывают при пониженном давлении на стеклянном фильтре ПОР 40, промывают сначала водой, затем этанолом и высушивают на воздухе при комнатной температуре до постоянной массы. Выход 99,9%.
Найдено, %: Cu — 52,0; С — 9,2; S — 25,6.
К 10,0 мл отработанного раствора травления печатных плат с концентрацией меди (II) 1,09 моль/л, аммиака 4,2 моль/л, хлорида аммония 0,34 моль/л при перемешивании прибавляют 6,5 мл раствора тиоцианата калия ГОСТ 4139-75 марки «чда» с концентрацией 330 г/л и раствор 0,70 г сульфата гидразиния ГОСТ 5841-74 марки «ч» в 20 мл воды. К полученному раствору при перемешивании по каплям прибавляют концентрированную азотную кислоту ГОСТ 4461-77 марки «хч» до достижения рН 2,5. Раствор оставляют для кристаллизации на 24 часа при комнатной температуре. Осадок отфильтровывают при пониженном давлении на стеклянном фильтре ПОР 40, промывают водой и высушивают на воздухе при комнатной температуре до постоянной массы. Выход 99,9%.
Найдено, %: Cu — 52,0; С — 9,1; S — 26,0.
К 10,0 мл отработанного раствора травления печатных плат с концентрацией меди (II) 1,70 моль/л, хлороводорода 0,40 моль/л, хлорида аммония 1,5 моль/л при перемешивании прибавляют 28 мл 10%-ного раствора тиоцианата аммония ГОСТ 27067-86 марки «чда», раствор 1,2 г хлорида гидроксиламмония ГОСТ 5456-79 марки «ч» в 10 мл воды. К полученной суспензии при перемешивании прибавляют 10%-ный раствор гидроксида натрия ГОСТ 4328-77 марки «ч» до достижения рН 6,1. Через 2 суток осадок отфильтровывают при пониженном давлении на стеклянном фильтре ПОР 16, промывают водой и высушивают на воздухе при комнатной температуре до постоянной массы. Выход 99,9%.
Найдено, %: Cu — 52,1; С — 9,5; S — 26,0.
К 10,0 мл отработанного раствора травления печатных плат с концентрацией меди (II) 1,62 моль/л, аммиака 4,8 моль/л, хлорида аммония 0,45 моль/л, карбоната аммония 1,9 моль/л при перемешивании прибавляют раствор 2,52 г тиоцианата аммония ТУ 6-09-4708-79 марки «хч» в 40 мл воды, 3,5 мл 40%-ного водного раствора формальдегида. Через 3 часа в раствор при перемешивании прибавляют концентрированную соляную кислоту до достижения рН 3,5. Раствор оставляют на 10 суток при комнатной температуре. Осадок отфильтровывают при пониженном давлении на стеклянном фильтре ПОР 40, промывают осадок на фильтре водой и высушивают на воздухе при комнатной температуре до постоянной массы. Выход 99,9%.
Найдено, %: Cu — 50,3; С — 9,1; S — 26,0.
К 20,0 мл отработанного раствора травления печатных плат с концентрацией меди (II) 1,65 моль/л, аммиака 4,9 моль/л, хлорида аммония 0,38 моль/л, карбоната аммония 1,0 моль/л при перемешивании прибавляют сначала раствор 16,4 г пентагидрата тиосульфата натрия ТУ 6-09-01-313-75 марки «чда» в 40 мл воды, затем 21 мл раствора тиоцианата калия с концентрацией 310 г/л. К полученному раствору при перемешивании прибавляют концентрированную азотную кислоту ГОСТ 4461-77 марки «ч» до достижения рН 7,8. Осадок отфильтровывают на бумажном фильтре, промывают водой и высушивают на воздухе при комнатной температуре до постоянной массы. Выход 80,5%.
Найдено, %: Cu — 52,2; С — 9,5; S — 25,9.
К 100 мл отработанного раствора травления печатных плат с концентрацией меди (II) 0,16 моль/л, аммиака 0,80 моль/л, хлорида аммония 0,03 моль/л, карбоната аммония 0,05 моль/л при перемешивании прибавляют сначала 15,8 мл 20%-ного раствора тиоцианата калия ТУ 2642-001-33813273-97 марки «техн.», затем раствор 2,8 г аскорбиновой кислоты марки «пищ.» и 4,0 г тиосульфата натрия ГОСТ 244-76 марки «фото» в 30 мл воды. К полученному раствору при перемешивании по каплям прибавляют концентрированную соляную кислоту ГОСТ 3118-77 марки «ч» до достижения рН 6,9. Через 3 часа осадок отфильтровывают при пониженном давлении на стеклянном фильтре ПОР 40, промывают водой и высушивают на воздухе при комнатной температуре до постоянной массы. Выход 99,8%.
Найдено, %: Cu — 51,8; С — 9,6; S — 26,2.
К 200 мл отработанного раствора травления печатных плат с концентрацией меди (II) 0,085 моль/л, хлороводорода 0,075 моль/л, пероксида водорода 0,010 моль/л при перемешивании последовательно прибавляют раствор 1,43 г хлорида гидроксиламмония ГОСТ 5456-79 марки «ч» в 5 мл воды, раствор 3,30 г тиоцианата калия ГОСТ 4139-75 марки «ч» в 10 мл воды и 15%-ный раствор гидроксида натрия ГОСТ 4328-77 марки «ч» до достижения рН 6,7. Через 3 часа осадок отфильтровывают при пониженном давлении на стеклянном фильтре ПОР 40, промывают водой и высушивают в сушильном шкафу при температуре 110-120°С. Выход 99,9%.
Найдено, %: Cu — 51,2; С — 9,1; S — 25,4.
К 10,0 мл отработанного электролита гальванического меднения с концентрацией меди (II) 0,88 моль/л, серной кислоты 0,51 моль/л при перемешивании прибавляют сначала 10%-ный раствор гидроксида натрия ГОСТ 4328-77 марки «чда» до достижения рН 8,0, затем раствор 1,71 г тиоцианата калия ГОСТ 4139-75 марки «ч» и 1,15 г сульфита натрия ГОСТ 195-77 марки «ч» в 30 мл воды и снова 10%-ный раствор гидроксида натрия до достижения рН 6,4. Раствор оставляют для кристаллизации на 25 часов при температуре 15-20°С. Осадок отфильтровывают при пониженном давлении на стеклянном фильтре ПОР 40, промывают сначала водой, затем ацетоном и высушивают на воздухе при комнатной температуре до постоянной массы. Выход 99,9%.
Найдено, %: Cu — 52,1; С — 9,3; S — 25,8.
К 10,0 мл отработанного электролита гальванического меднения с концентрацией меди (II) 0,85 моль/л, серной кислоты 0,46 моль/л последовательно прибавляют 100 мл воды, раствор 1,50 г аскорбиновой кислоты ФС 42-2668-95 в 20 мл воды, раствор 1,65 г тиоцианата калия ГОСТ 4139-75 марки «ч» в 10 мл воды и 10%-ный раствор гидроксида натрия ГОСТ 4328-77 марки «ч» до достижения рН 5,2. Через 2 часа осадок отфильтровывают при пониженном давлении на стеклянном фильтре ПОР 40, промывают водой и высушивают в сушильном шкафу при температуре 100-105°С до постоянной массы. Выход 99,8%.
Найдено, %: Cu — 51,9; С — 9,5; S — 25,9.
К 10,0 мл отработанного электролита гальванического меднения с концентрацией меди (II) 0,64 моль/л, тетрафтороборной кислоты 0,03 моль/л, борной кислоты 0,24 моль/л при перемешивании прибавляют 25,0 мл 5,0%-ного раствора тиоцианата калия ГОСТ 4139-75 марки «ч» и раствор 0,53 г сульфата гидроксиламмония ГОСТ 7298-79 марки «ч» в 5,0 мл воды. К полученной суспензии при перемешивании прибавляют 10%-ный раствор гидроксида натрия ГОСТ 4328-77 марки «ч» до достижения рН 6,3. Через 30 часов осадок отфильтровывают при пониженном давлении на стеклянном фильтре ПОР 40, промывают водой и высушивают на воздухе при комнатной температуре до постоянной массы. Выход 99,8%.
Найдено, %: Cu — 52,1; С — 9,6; S-26,1.
К 10,0 мл отработанного электролита гальванического меднения с концентрацией меди (II) 0,55 моль/л, гексафторокремниевой кислоты 0,08 моль/л при перемешивании прибавляют сначала 10%-ный раствор гидроксида натрия ГОСТ 4328-77 марки «ч» до достижения рН 8,3, затем прибавляют 7,0 мл 10%-ного раствора сульфита натрия ГОСТ 195-77 марки «ч», 4,0 мл 20%-ного раствора тиоцианата аммония и 10%-ный раствор гидроксида натрия до достижения рН 6,3. Раствор оставляют для кристаллизации на 2 суток при температуре 18-20°С. Осадок отфильтровывают при пониженном давлении на стеклянном фильтре ПОР 16, промывают водой и высушивают на воздухе при комнатной температуре до постоянной массы. Выход 99,8%.
Найдено, %: Cu — 52,0; С — 9,4; S — 26,0.
Полученный в примерах 1-14 тиоцианат меди (I) представляет собой бесцветное мелкокристаллическое вещество, плохо растворимое в воде, уксусной кислоте, этаноле, ацетоне, тетрахлориде углерода, бензоле. Вещество растворимо в водном аммиаке, концентрированных минеральных кислотах, разлагается щелочами.
Как видно из приведенных примеров, заявленный способ позволяет получить тиоцианат меди (I) состава, точно отвечающего формуле CuSCN, с выходом, близким к 100%. Использование для его получения отходов радиоэлектронного производства — отработанных растворов травления печатных плат различного состава и отходов гальванического производства — отработанных электролитов меднения различного состава позволяет значительно снизить себестоимость получения целевого продукта и расширить ассортимент медьсодержащих материалов, применяемых для получения тиоцианата меди (I). Дополнительное снижение себестоимости и повышение технологичности достигается в результате предотвращения выделения токсичного диоксида серы в процессе получения целевого продукта. В результате осуществления заявленного способа удается утилизировать токсичные медьсодержащие отходы производства, что позволяет значительно снизить затраты на охрану окружающей среды.
1. Способ получения тиоцианата меди (I), включающий приготовление реакционного водного раствора, содержащего медь (II), тиоцианат, реагент-восстановитель, кристаллизацию целевого продукта из раствора, отделение осадка от раствора и высушивание осадка, отличающийся тем, что для приготовления реакционного водного раствора в качестве источника меди (II) используют отход производства — отработанный раствор травления печатных плат, содержащий в качестве основных компонентов медь (II), минеральную кислоту, или отработанный раствор травления печатных плат, содержащий в качестве основных компонентов медь (II), минеральную кислоту, соли аммония, или отработанный раствор травления печатных плат, содержащий в качестве основных компонентов медь (II), соли аммония, аммиак, или отработанный электролит гальванического меднения, и в реакционном водном растворе устанавливают рН от 0,0 до 9,5.
2. Способ по п.1, отличающийся тем, что используют отработанный электролит гальванического меднения, содержащий в качестве основных компонентов медь (II) и серную кислоту, или медь (II) и сульфаминовую кислоту, или медь (II) и тетрафтороборную кислоту, или медь (II) и гексафторокремниевую кислоту.
3. Способ по п.1, отличающийся тем, что в качестве реагента-восстановителя используют сульфит, тиосульфат, дитионит, гидразин, гидроксиламин, формальдегид, аскорбиновую кислоту, глюкозу.
Видео:Качественные реакции на ион аммонияСкачать

—>Аналитические группы катионов —>
VI аналитическая группа: Cu 2+ ,Cd 2+ ,Hg 2+ ,Co 2+ ,Ni 2+
При действии группового реагента (25 % водный раствор аммиака) на водные растворы, содержащие катионы шестой аналитической группы, вначале выделяются осадки различного состава, которые затем растворяются в избытке группового реагента (осадки соединений кобальта и ртути растворяются в избытке водного аммиака только в присутствии катионов аммония ).
Осадки, выпавшие из растворов солей кобальта(II) и ртути(II) при действии группового реагента, растворяются в избытке аммиака в присутствии солей аммония с образованием аммиачных комплексов:
Аммиачный комплекс кобальта(II) грязно-желтого цвета окисляется на воздухе до аммиачного комплекса кобальта(III) вишнево-красного цвета.
Аналитические реакции катиона меди(П) Cu 2 +
Аква-ионы меди(II) [Cu(H2O)n] 2 + окрашены в голубой цвет, поэтому растворы солей меди(II) имеют голубую окраску с разными оттенками (от голубой до сине-зеленой). В водных растворах акво-ионы меди(11) частично гидролизуются с образованием растворимых гидро-ксоаквокомплексов состава [Cu (H2O)n-m(OH)m] 2-m по схеме:
Реакция с щелочами. При прибавлении раствора щелочи к раствору соли меди(II) выпадает осадок гидроксида меди(II) Cu(OH)2,имеющий окраску от сине-зеленой до голубой:
При кипячении смеси раствора с осадком гидроксид меди(II) разлагается, теряя воду, до черного оксида меди(II) CuO:
Осадок Cu(OH)2 растворяется в кислотах, в растворах аммиака (с образованием комплекса [Cu(NH3)4] 2+ синего цвета), комплексообразующих органических кислот (лимонная, винная), частично растворим в концентрированных щелочах с образованием гидроксокомплексов меди(II).
Методика. В пробирку вносят 3-4 капли раствора соли меди(II) и прибавляют 1-2 капли раствора NaOH. Образуется осадок гидроксида меди(II) голубого или сине-зеленого цвета.
Смесь осторожно нагревают до кипения и кипятят до потемнения осадка вследствие образования черного оксида меди(II).
Реакция с аммиаком (фармакопейная). При прибавлении раствора аммиака к раствору, содержащему соль меди(II), вначале выпадает
осадок основной соли меди (сине-зеленого цвета), который растворяется в избытке аммиака с образованием комплексного катиона [Cu(NH3)4] 2+ ярко-синего цвета. Так, из раствора хлорида меди(II) Cl2 аммиак осаждает голубой оксихлорид меди(II) Cu(OH)Cl:
В избытке аммиака осадок растворяется:
Раствор окрашивается в ярко-синий цвет.
В кислой среде комплексный тетрамминмедь(II)-катион разрушается:
и окраска раствора из ярко-синей становится голубой (цвет аквокомплекса меди(II)).
Мешают катионы Co 2 +,Ni 2 +, олово(II).
Методика. В пробирку вносят 3-5 капель раствора соли меди(II) и прибавляют по каплям разбавленный раствор аммиака при перемешивании смеси. Выпадающий вначале голубой (или голубовато-зеленоватый) осадок основной соли меди(II) затем растворяется с образованием ярко-синего раствора.
Прибавляют по каплям разбавленный раствор одной из кислот — HCl, HNO3 или H2SO4 Окраска раствора из ярко-синей переходит в голубую.
Реакция с гексацианоферратом(II) калия. Катионы d 2+ образуют с ферроцианидом калия K4[Fe(CN)6] в слабокислой среде красно-коричневый осадок гексацианоферрата(II) меди Cu2[Fe(CN)6]:
Осадок не растворяется в разбавленных кислотах, но растворяется в 25 % водном аммиаке:
Мешают катионы, также образующие окрашенные осадки ферроцианидов (Fe 3 +,Co 2 +,Ni 2 +).
Реакцию катионов меди(II) с ферроцианидом калия можно проводить капельным методом на фильтровальной бумаге.
а) В пробирку вносят 3-4 капли раствора соли меди(II) и прибавляют 2-3 капли раствора K4[Fe(CN)6]. Выпадает красно-коричневый осадок ферроцианида меди(II).
б) На лист фильтровальной бумаги, пропитанный раствором ферроцианида калия, наносят каплю раствора соли меди(II). На бумаге образуется красно-коричневое пятно.
Реакция с тиосульфатом натрия. При кипячении смеси подкисленного раствора соли меди(II) с избытком тиосульфата натрия Na2S2O3 происходит восстановление меди(II) до меди(I) с образованием сульфида меди(I) Cu2S. В результате выпадает темно-бурый осадок, представляющий собой смесь сульфида меди(I) Cu2S и свободной серы. Реакция, по-видимому, протекает по схеме:
В литературе встречаются и другие схемы, описывающие эту реакцию.
Методика. В пробирку вносят 3-4 капли раствора соли меди(II), 2-3 капли разбавленного раствора H2SO4 и несколько кристалликов тиосульфата натрия. Пробирку осторожно нагревают до кипения. Выпадает темный осадок, содержащий смесь Cu2S и S.
Реакция с купроном (1-бензоиноксимом). Катионы Cu 2+ при взаимодействии с органическим реагентом — купроном (обычно в аммиачной среде) образуют хлопьевидный зеленый осадок внутрикомплексного соединения состава CuL2H2O, где H2L — условное обозначение купрона — 1-бензоиноксима:
Протоны, очевидно, отщепляются от обеих гидроксильных групп молекулы купрона.
Осадок не растворяется в избытке аммиака.
Реакцию можно проводить капельным методом на фильтровальной бумаге. Предел обнаружения
а) В пробирку вносят 2-3 капли кислого раствора соли меди(II), прибавляют 1-2 капли спиртового раствора купрона и 2-3 капли раствора аммиака. Образуется зеленый осадок комплекса меди(II) с купроном.
б) На лист фильтровальной бумаги наносят каплю подкисленного раствора соли меди(II), каплю спиртового раствора купрона и каплю раствора аммиака. На бумаге возникает зеленое пятно.
Реакция восстановления меди(II) металлами до металлической меди (фармакопейная). Металлы, расположенные в ряду напряжений металлов левее меди, восстанавливают катионы меди(II) Cu 2 + до металлической меди. Чаще всего для этого применяют металлические алюминий, цинк, железо. При внесении этих металлов в растворы солей меди(II) поверхность металлов покрывается тонким слоем выделяющейся металлической меди красноватого цвета:
Методика. В пробирку с подкисленным раствором соли меди(II) погружают кусочек металлического алюминия или цинка, либо железа. Постепенно поверхность металла покрывается красным слоем металлической меди.
Окрашивание пламени газовой горелки. Соли меди окрашивают пламя газовой горелки в изумрудно-зеленый цвет.
Методика. Платиновую или нихромовую проволоку погружают в концентрированную хлороводородную кислоту, затем в сухую соль меди и вносят в пламя газовой горелки, которое окрашивается в зеленый цвет.
Другие реакции катионов меди(11). Катионы Cu 2 + дают целый ряд реакций, имеющих аналитическое значение. Так, с тиоцианатами образуется черный осадок Cu(SCN)2, постепенно переходящий в белый CuSCN; с сульфид-ионами — черный осадок сульфида меди CuS; с фосфатами — голубой Cu3(PO4)2 и т.д. Известны реакции комплексообразования меди(II) с различными органическими реагентами — купроном, купфероном, дитиооксамидом и др.
Используют также довольно чувствительную (предельное разбавление
10 4 г/мл) микрокристаллоскопическую реакцию образования желто-зеленых кристаллов Cu[Hg(SCN)4].
Аналитические реакции катиона кадмия Cd 2 +
Акво-ионы кадмия [Cd(H2O)n] 2+ в водных растворах бесцветны.
Реакция с щелочами и аммиаком. При прибавлении раствора щелочи или аммиака к раствору соли кадмия выпадает белый осадок гидро-ксида кадмия:
Осадок нерастворим в избытке щелочи, но растворяется в избытке аммиака с образованием бесцветного аммиачного комплекса [Cd(NH 3)4] 2+ :
Осадок гидроксида кадмия растворяется в кислотах:
Методика. В две пробирки вносят по 3-4 капли раствора соли кадмия. В одну пробирку прибавляют 1-2 капли раствора NaOH или КОН. Выпадает белый осадок гидроксида кадмия Cd(OH)2.
В другую пробирку прибавляют по каплям раствор аммиака. Образующийся вначале белый осадок гидроксида кадмия растворяется в избытке аммиака.
Реакция с сульфид-ионами. Катионы Cd 2+ образуют с сульфид-ионами S 2- в слабокислых или щелочных растворах желтый осадок сульфида кадмия CdS:
Осадок нерастворим в щелочах и в растворе сульфида натрия, частично растворяется в насыщенном растворе хлорида натрия с образованием хлоридного комплекса кадмия [CdCl4] 2- :
Сульфид кадмия нерастворим в кислотах, за исключением HCl, в которой он растворяется с образованием хлоридного комплекса кадмия:
Методика. В пробирку вносят 2-3 капли раствора нитрата кадмия, прибавляют две капли раствора сульфида натрия Na2S. Выпадает желто-коричневый осадок сульфида кадмия CdS.
К выпавшему осадку прибавляют по каплям насыщенный раствор хлорида натрия NaCl при перемешивании смеси до растворения осадка.
Реакцию на катионы кадмия можно проводить также с сероводородной водой при рН « 0,5.
Реакция с тетрароданомеркуратом(II) аммония. Катионы кадмия при взаимодействии с тетрароданомеркуратом(II) аммония (NH4)2[Hg(SCN)4] образуют белый кристаллический осадок тетрарода-номеркурата(II) кадмия Cd[Hg(SCN)4]:
Реакция высокочувствительна: предел обнаружения составляет около 1 мкг, предельное разбавление равно
Методика. В пробирку вносят 2-3 капли раствора соли кадмия и прибавляют примерно столько же капель раствора (NH4)2[Hg(SCN)4]. Выпадают бесцветные (или белые — в зависимости от размера частиц осадка) кристаллы тетрароданомеркурата(II) кадмия Cd[Hg(SCN)4].
Реакцию можно проводить как микрокристаллоскопическую. Для этого на предметное стекло наносят каплю раствора соли кадмия и каплю раствора тетрароданомеркурата(П) аммония. При рассмотрении под микроскопом можно видеть образовавшиеся бесцветные продолговатые кристаллы тетрароданомеркурата кадмия Cd[Hg(SCN)4].
Реакция с тетрайодовисмутатом(III) калия. Катионы кадмия дают с тетрайодовисмутатом(III) калия K[BiI4] черный осадок йодида висмута(III) BiI3:
Осадок йодида висмута(III) растворяется при прибавлении избытка растворов йодида калия KI или тиосульфата натрия Na2S2O3.
Методика. На лист фильтровальной бумаги наносят каплю раствора тетрайодовисмутата(III) калия K[BiI4] и каплю раствора соли кадмия. На бумаге появляется черное пятно. При добавлении по каплям раствора йодида калия или тиосульфата натрия черное пятно исчезает.
Другие реакции катионов кадмия. Известен целый ряд аналитических реакций на катионы кадмия, особенно — с комплексообразую-щими органическими реагентами: дитизоном, кадионом, меркапто-бензтиазолом, меркаптобензимидазолом, р-нафтохинолином, хинальдиновой кислотой, со смесью йодида калия с трис-а-дипиридилжелезом(II) и т.д.
ВНИМАНИЕ! Все соединения ртути(II) сильно ядовиты, поэтому при работе с ними следует принимать меры предосторожности!
Аквa-ионы ртути(II) [Hg(H2O)n] 2+ в водных растворах бесцветны.
Реакции с щелочами и аммиаком. При добавлении водного раствора щелочи к водному раствору, содержащему катион Hg 2+ , выпадает желтый осадок оксида ртути(II) HgO:
Осадок HgO растворяется в азотной кислоте, в растворах хлоридов и йодидов щелочных металлов с образованием соответственно Hg(NO3)2, HgCl2 и комплекса [HgI4] 2- :
Методика. В пробирку вносят 3-4 капли водного раствора соли ртути(II) и прибавляют по каплям водный раствор NaOH или KOH. Выпадает желтый осадок оксида ртути(II) состава HgO.
При реакции с водным раствором аммиака катионы Hg 2+ образуют белые осадки. Из водных растворов хлорида ртути(П)HgCl2 выпадает белый осадок состава HgNH2Cl, из водных растворов нитрата ртути(II) Hg(NO3)2 — белый осадок состава [OHg2NH2]NO3:
Осадки растворяются (лучше — при нагревании) в избытке аммиака, но только в присутствии солей аммония, с образованием бесцветного комплексного катиона тетрамминртути(II) [Hg(NH3)4] 2+ :
Методика. В одну пробирку вносят 3-4 капли водного раствора хлорида ртути(II) HgCl2, а в другую — столько же водного раствора нитрата ртути(II) Hg(NO3)2 В каждую пробирку прибавляют по каплям водный раствор аммиака до выпадения белых осадков. Затем в про-
бирки добавляют по 3- 4 капли водного раствора соли аммония (NH4Cl или NH4NO3) и по каплям — водный раствор аммиака при перемешивании до полного растворения осадков.
Реакция с йодидом калия (фармакопейная). Катионы Hg 2 + дают с йодид-ионами I — в водном растворе красный осадок йодида ртути(II) HgI2, который при избытке йодид-ионов растворяется с образованием бесцветного тетрайодомеркурат(II)-иона [HgI4] 2- :
Мешают катионы Pb 2+ ,Cu 2+ ,Ag + , висмут(III) и некоторые другие, а также окислители.
Методика. В пробирку вносят 2-3 капли раствора соли ртути(II) и прибавляют каплю разбавленного (5 %) раствора йодида калия. Выпадает красный осадок йодида ртути(II) HgI2.
При дальнейшем прибавлении по каплям (при встряхивании) раствора йодида калия осадок растворяется с образованием бесцветного раствора.
Реакцию можно также проводить капельным методом на фильтровальной бумаге — наблюдается появление красно-оранжевого пятна, исчезающего при добавлении избытка раствора йодида калия.
Методика. На лист фильтровальной бумаги наносят каплю разбавленного водного раствора йодида калия, затем — каплю раствора соли ртути(П). Возникает красно-оранжевое пятно. При дальнейшем добавлении по каплям раствора йодида калия пятно обесцвечивается.
Эта методика рекомендуется для открытия катионов Hg 2+ даже в присутствии мешающих катионов.
Реакция с сульфид-ионами (фармакопейная). Катионы Hg 2+ осаждаются из водных растворов сульфид-ионами S 2- в виде черно-коричневого осадка сульфида ртути(II) HgS. Реакция протекает в несколько стадий. Вначале образуется белый осадок, постепенно изменяющий окраску через желто-красную и бурую на коричнево-черную при избытке сульфид-ионов.
Так, при действии сероводорода H2S на водный раствор хлорида ртути(II) HgCl2 сначала выпадает белый осадок состава 2HgS*HgCl2:
При избытке H2S белый осадок превращается в коричнево-черный
HgS:
Аналогично протекает реакция HgCl2 с сульфидом натрия Na2S. Сульфид ртути(II) HgS не растворяется в разбавленной азотной кислоте, но растворим в царской водке (смесь HCl + HNO3):
Методика. В пробирку вносят 2-3 капли раствора хлорида ртути(II) HgCl2 и прибавляют по каплям раствор сульфида натрия Na2S сероводородной воды. Выпадает белый осадок, чернеющий при дальнейшем прибавлении раствора Na2S или сероводородной воды.
Реакция с хлоридом олова(II). Катионы Hg 2 + восстанавливаются оловом(II) вначале до катионов Hg2 2 +, а затем — до металлической ртути Hg. Так, при взаимодействии хлорида ртути(II) HgCl2 с хлоридом олова(II) образуется белый осадок каломели Hg2Cl2, который темнеет за счет выделения мелкодисперсной металлической ртути:
Мешают катионы Ag + , Hg 2 + , Sb(III), Bi(III).
Методика. В пробирку вносят 2- 3 капли раствора хлорида ртути(II) HgCl2 и прибавляют по каплям солянокислый раствор хлорида олова(II). Выпадает белый осадок Hg2Cl2, который постепенно темнеет.
Реакцию можно проводить капельным методом на фильтровальной бумаге: при нанесении на бумагу капли раствора хлорида олова(II) и капли раствора хлорида ртути(II) появляется темное пятно.
Аналогично протекают реакции солей ртути(II) c некоторыми другими восстановителями, например, с металлической медью. Для проведения этой реакции на медную поверхность наносят каплю раствора соли ртути(II). На поверхности возникает темное (черно-серое) пятно, которое при протирании фильтровальной бумагой становится серебристо-блестящим.
Другие реакции катионов ртути(II). Известны качественные реакции на ртуть(II) c рядом других неорганических и органических реагентов — с хромат-ионами (образуется желтый HgCrO4), с ортофос-фат-ионами (белый Hg3(PO4)2), с дифенилкарбазидом и с дифенилкарбазоном (комплексы сине-фиолетового цвета), с дитизоном (желто-оранжевый или красный комплексы, в зависимости от условий проведения реакции) и т.д.
Аналитические реакции катиона кобальта(II) Co 2+
Аквa-ионы кобальта(II) октаэдрической конфигурации [Co(H2O)6] 2+ окрашены в розовый цвет, поэтому разбавленные водные растворы солей кобальта(II) также имеют розовую окраску. Однако при упаривании водных растворов солей кобальта(II) их фиолетовая окраска меняется на синюю, характерную для комплексов кобальта(II) тетраэдрической структуры.
Соединения кобальта(II) сравнительно легко окисляются до соединений кобальта(III), причем в ряде случаев — уже кислородом воздуха (растворенным в воде), что необходимо учитывать при проведении качественных реакций на кобальт(II). В водных растворах кобальт(II) и кобальт(III) присутствуют исключительно в форме комплексных соединений. Комплексы кобальта(III) устойчивее комплексов кобальта(II), хотя известны и стабильные комплексы кобальта(II).
Реакция с щелочами. Катионы Со 2 приреакциисщелочами вначале образуют синий осадок гидроксосоли кобальта(II), которая затем переходит в розовый осадок гидроксида кoбальта(II) Co(OH)2 Так, при взаимодействии хлорида кобальта(II) со щелочью реакция протекает по схеме:
Розовый гидроксид кобальта(II) Co(OH)2 медленно буреет вследствие окисления кислородом воздуха до черно-бурого гидроксида кобальта(II) состава Co(OH)3:
Если к розовому осадку Co(OH)2 прибавить пероксид водорода H2O2, то реакция окисления Co(OH)2 вчерно-бурый Co(OH)3протекает практически мгновенно:
Действие смеси H2O2 со щелочью на раствор соли кобальта(II) сразу приводит к образованию черно-бурого осадка Co(OH)3:
Методика. В пробирку вносят 3 капли раствора соли кобальта(II), и медленно, по каплям, при непрерывном перемешивании смеси прибавляют водный раствор NaOH или КОН. Образуется синий осадок CoOHCl, переходящий при дальнейшем прибавлении щелочи в розовый осадок Co(OH)2, который через некоторое время постепенно темнеет за счет окисления до Co(OH)3.
Реакция с аммиаком. При реакции катионов Co 2+ с аммиаком также вначале образуется синий осадок основной соли. Дальнейшее прибавление раствора аммиака приводит к растворению осадка с образованием гексамминкобальт(II)-катионов [Co(NH3)6] 2+ грязно-желтого цвета (раствор — желтого цвета):
На воздухе раствор постепенно принимает вишнево-красный цвет вследствие окисления кобальта(II) до кобальта(III) с образованием хлоропентамминкобальт(III)-анионов [Co(NH3)5Cl] 2- вишнево-красного цвета:
В присутствии пероксида водорода и солей аммония реакция окисления [Co(NH3)6] 2+ до [Co(NH3)5Cl] 2+ протекает практически мгновенно:
Методика. В пробирку вносят 3 капли раствора хлорида кобальта(II) и медленно, по каплям прибавляют раствор аммиака до выпадения синего осадка CoOHCl. Добавляют несколько кристалликов хлорида аммония и продолжают прибавление раствора аммиака при перемешивании смеси до полного растворения осадка и образования желтого раствора. При стоянии на воздухе раствор постепенно меняет окраску на вишнево-красную.
В другую пробирку вносят 3 капли раствора хлорида кобальта(II), прибавляют 2 капли раствора пероксида водорода и затем по каплям — раствор аммиака до выпадения черно-бурого осадка гидроксида кобальта(III). Добавляют по каплям концентрированный раствор аммиака до растворения осадка и образования вишнево-красного раствора, содержащего комплексы [Co(NH3)5Cl] 2 +.
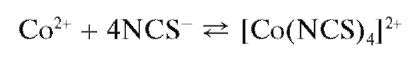
Реакция с тиоцианат-ионами. Катионы Co 2+ в слабокислой среде реагируют с тиоцианат-ионами NCS — c образованием синего комплекса — тетратиоцианатокобальтат(II)-иона [Co(NCS)4] 2- :
Комплекс в водных растворах неустойчив, и равновесие комплексообразования смещено влево в сторону образования розового аквa-комплекса кобальта(II). Поэтому реакцию проводят при избытке тио-цианат-ионов, чтобы сместить равновесие вправо.
Равновесие смещается вправо также в водно-ацетоновых растворах, в силу чего реакцию иногда проводят в водно-ацетоновой среде (ацетон хорошо смешивается с водой).
В растворах органических растворителей (изоамиловый спирт, эфир) устойчивость комплекса повышается. Поэтому при проведении данной реакции водный раствор, содержащий катионы ^^смешива-ют с небольшим количеством органического растворителя (обычно — смесь изоамилового спирта и диэтилового эфира). При этом тетратио-цианатный комплекс кобальта(П) переходит в органическую фазу и окрашивает ее в синий цвет.
Предел обнаружения ионов кобальта(II) этой реакцией — 0,5 мкг.
Проведению реакции мешают катионы железа(III) Fe 3 +, меди(II) Cu 2 +, также образующие окрашенные соединения с тиоцианат-ионами — желто-бурый комплекс меди(II) и красные комплексы железа(III). Мешающее действие этих катионов можно устранить, восстановив их хлоридом олова(II) до железа(II) и меди(I).
Мешающее действие катионов Fe 3+ устраняют также, связывая их в устойчивые бесцветные комплексы такими маскирующими агентами, как фторид- и тартрат-анионы, прибавляя фторид натрия NaF или тартрат натрия-калия NaKC4H4O6 соответственно. В качестве маскирующих агентов используют также оксалат-ионы C2O 4 2- и ортофосфат-ионы PO 4 3- .
Методика. В пробирку вносят 2-3 капли раствора соли кобальта(II), прибавляют 8-10 капель насыщенного раствора тиоцианата калия KNCS или аммония NH4NCS (или несколько кристалликов этих солей), 5-6 капель органического растворителя (изоамиловый спирт или смесь изоамилового спирта с диэтиловым эфиром) и встряхивают смесь. Верхний слой органической фазы окрашивается в синий цвет.
В другую пробирку вносят 2-3 капли раствора соли кобальта(II), 2-3 капли раствора соли железа(III) и прибавляют 5-6 капель насыщенного раствора тиоцианата калия или аммония. Раствор принимает
красную окраску — цвет тиоцианатных комплексов железа(III), на фоне которого нельзя увидеть синюю окраску тиоцианатных комплексов кобальта(II). К смеси прибавляют порошкообразные NaF или NaKC4H4O6 до исчезновения красной окраски. Затем добавляют 5-6 капель органического растворителя и встряхивают пробирку. Наблюдается синее окрашивание верхней жидкой органической фазы.
Реакцию можно также проводить капельным методом на фильтровальной бумаге. Для этого на лист фильтровальной бумаги наносят каплю концентрированного раствора тиоцианата калия или аммония, каплю раствора соли кобальта(II) и высушивают бумагу на воздухе. Наблюдают образование синего пятна.
Реакция с тетратиоцианатомеркуратом(II) аммония (с тетрароданомеркуратом(II) аммония). Катионы Co 2+ при реакции с тетратиоцианатомеркуратом(II) аммония (NH4)2[Hg(SCN)4] образуют комплекс Co[Hg(SCN)4], выпадающий из раствора в виде темно-синих кристаллов:
Из разбавленных растворов кристаллы выделяются медленно. Если же в растворе присутствуют катионы цинка Zn 2+ , то при проведении реакции сразу же выпадает голубой осадок смешанного тиоцианатного комплекса цинка и кобальта(II) состава ZnxCoy[Hg(SCN)4]x+y:
Прибавление даже небольших количеств соли цинка приводит к почти полному осаждению кобальта(II).
Проведению реакции мешают катионы Cd 2+ ,Cu 2+ ,Fe 3+ ,Ni 2+ .
Методика. В пробирку вносят 4-5 капель раствора соли кобальта(II), прибавляют каплю раствора соли цинка (например, ZnSO4 3-4 капли раствора (NH4)2[Hg(SCN)4]. Выпадает голубой осадок смешанного тиоцианатного комплекса цинка и кобальта(II).
Реакция с сульфид-ионами. Катионы Co 2+ приреакцииссульфид-ионами образуют черный осадок сульфида кобальта(II) CoS:
Свежевыпавший осадок CoS растворяется в минеральных кислотах, однако при стоянии он превращается в форму, трудно растворимую в разбавленной HCl, но растворимую в кислотах в присутствии окислителей.
Методика. В пробирку вносят 2-3 капли раствора соли кобальта(II) и прибавляют 2-3 капли раствора сульфида аммония (NH4)2S. Выпадает черный осадок сульфида кобальта CoS.
Реакция с солями цинка — образование «зелени Ринмана». Если на листок фильтровальной бумаги нанести несколько капель раствора нитрата цинка Zn(NO3)2 и несколько капель раствора нитрата кобальта Co(NO3)2, после чего листок подсушить и озолить (например, поместить его в фарфоровый тигель и внести в пламя газовой горелки), то образуется зола зеленого цвета — «зелень Ринмана» состава CoZnO2:
Реакция с 1-нитрозо-2-нафтолом — реактивом Ильинского. Кобальт(II) в этой реакции вначале окисляется до кобальта(III), который с 1-нитрозо-2-нафтолом образует внутрикомплексное соединение, выделяющееся в виде пурпурно-красного осадка. Если 1-нитрозо-2-наф-тол, который в растворе может существовать, как полагают, в двух тау-томерных формах, условно обозначить через HL
то реакцию можно описать схемой (после окисления кобальта(II) до кобальта(III)):
Реакцию проводят в нейтральной или слабокислой среде. Мешают катионы меди(II) Cu 2 +.
Методика.В пробирку вносят 2-3 капли раствора соли кобальта(II), 1-2 капли уксусной кислоты, 2-3 капли 1 % раствора 1-нитрозо-2-нафтола. При осторожном нагревании наблюдают выделение пурпурно-красного осадка внутрикомплексного соединения.
Реакцию можно проводить также капельным методом на фильтровальной бумаге. Для этого на листок фильтровальной бумаги наносят каплю раствора соли кобальта(II) и каплю 1 % раствора 1-нитрозо-2-нафтола в уксусной кислоте. На бумаге возникает красно-коричневое пятно.
Реакция с нитрозо-II-солью (фармакопейная). Нитрозо-Я-соль, которую, как и реактив Ильинского, можно представить в двух таутомер-ных формах
при взаимодействии с кобальтом(III), возникающем в кислой среде вследствие окисления кобальта(II) до кобальта(III), образует внутри-комплексное соединение состава CoL’3 (HI/ — условное обозначение молекулы нитрозо-II-соли, как указано в вышеприведенной схеме) красного цвета:
Реакцию проводят в кислой среде при нагревании. Раствор окрашивается в красный цвет. При достаточно больших концентрациях из раствора выпадает красный осадок внутрикомплексного соединения.
Реакция довольно чувствительна: предел обнаружения равен 0,05 мкг.
Методика. В пробирку вносят 3-4 капли раствора соли кобальта(II), 3-4 капли разбавленного раствора HCl. Раствор в пробирке нагревают до кипения, прибавляют 3-4 капли свежеприготовленного раствора нитрозо-Я-соли в 50 % уксусной кислоте и нагревают до кипения. Раствор окрашивается в красный цвет и из него выпадает красный осадок.
Другие реакции катионов кобальта(II). Катионы кобальта(II) c нитритом калия KNO2 в уксуснокислой среде образуют (после окисления до кобальта(III)) желтый кристаллический осадок гексанитрокобальтата(III) калия K3[Co(NO2)6]; по этой реакции катионы кобальта можно открыть в присутствии катионов никеля.
Соединения кобальта с бурой Na2B4O7*10H2O образуют перлы синего цвета, с рубеановодородной кислотой NH2CSCSNH2(формулу которой можно также представить в виде HN=C(SH)-C(SH)=NH) — желто-бурый осадок комплексного соединения.
Известны и некоторые другие реакции на катионы кобальта.
Аналитические реакции катионов никеля(II) Ni 2+
Аквaкомплексы никеля(II) [Ni(H2O)6] 2+ окрашены в зеленый цвет, поэтому водные растворы солей никеля(II) имеют зеленую окраску. В растворах никель(II) присутствует только в форме комплексных соединений.
Реакция с щелочами. Катионы никеля(II) Ni 2 + осаж
🎬 Видео
Качественная реакция на оксид медиСкачать

NH3 + HCl = NH4Cl | Получение хлорида аммонияСкачать

Качественная реакция на альдегиды с гидроксидом меди IIСкачать

Реакции солей металлов с раствором аммиака / Reactions of metal salts with ammoniaСкачать

Задание 17: Реакции исключения - разложение дихромата аммония и перманганата калия | Химия ЕГЭСкачать

25. Схема реакции и химическое уравнениеСкачать

Реакция замещения меди железом в растворе сульфата или хлорида меди IIСкачать

Обнаружение ионов в растворе. Качественные реакцииСкачать

Все реакции разложения в неорганике | Химия ЕГЭ 2022 | УмскулСкачать

Взаимодействие хлорида железа III с роданидом калияСкачать

Сульфат меди+аммиак+пероксид водорода!!! Бурная реакция!!! С объяснениями!!!Скачать

Признак химических реакций - выпадение или растворение осадкаСкачать

Типы химические реакции - обмена, соединения, разложения, замещенияСкачать

Хлорид Аммония. Аммиак. МНОГО ДЫМА БЕЗ ОГНЯ!Скачать

Качественная реакция на альдегиды с гидроксидом медиСкачать

Качественная реакция на хлорид, бромид, йодид ион.Скачать

Равновесие в растворе роданида железаСкачать

Реакция сульфата меди II ( медный купорос) с гидроксидом натрия ( щелочами)Скачать